14.8: Полігалогенізовані алкани та алкени
- Page ID
- 106271
Корисні сполуки
Поліхлорування метану дає ді-, три- і тетрахлорметани дешево і ефективно:

Ці речовини мають відмінні властивості розчинника для неполярних і слабополярних речовин. Хлороформ колись широко використовувався як інгаляційний анестетик. Однак він надає згубну дію на серце і повільно окислюється киснем атмосфери до високотоксичного карбонілдихлориду (фосген,\(\ce{COCl_2}\)). Комерційний хлороформ містить близько\(1\%\) етанолу, який руйнує будь-який\(\ce{COCl_2}\) утворений окисленням.
Тетрахлорид вуглецю зазвичай використовувався як очищуючий розчинник, хоча його значна токсичність тягне за собою значну небезпеку при використанні без розбору. Він був використаний як вогнегасна рідина для нафтових пожеж, але його токсичність і схильність до утворення ще більш токсичного карбонілдихлориду робить його небажаним для обмежених територій. Поширена лабораторна практика видалення слідів води від розчинників металевим натрієм не повинна застосовуватися до галогенізованих сполук; вуглецеві тетрахлоридно-натрієві суміші чутливі до ударів і можуть детонувати.
Трихлоретен («Tri-Clene», bp\(87^\text{o}\)) - широко застосовуваний розчинник для хімчистки. Його можна приготувати як з етену, так і з етину:

Порівняно з моногалоалканами, полігалогенні сполуки мають досить різну реакційну здатність і поведінку по відношенню до нуклеофілів і основ. Таким чином, дихлорметан реагує з гідроксид-іоном\(S_\text{N}2\) механізмом набагато менш легко, ніж метилхлорид. Утворений тоді хлорометанол піддається швидкій\(E2\) елімінації, щоб дати метанал (формальдегід), речовину, яка існує у воді в значній мірі як дигідроксиметан:

Трихлорметан (хлороформ) реагує зовсім інакше з основою, ніж хлорметан або дихлорметан - як буде описано в наступному розділі.
\(\alpha\)Ліквідація. Карбени
Тригалометани, такі як трихлорметан (хлороформ), досить реактивні по відношенню до міцної основи. Основа, така як гідроксид, видаляє водень\(\ce{HCCl_3}\) як протон набагато швидше, ніж атакує вуглець таким\(S_\text{N}2\) чином. Утворений таким чином карбоніон\(\ce{Cl_3C}^\ominus\) нестійкий і втрачає хлорид-іон, утворюючи високореактивний нейтральний проміжний продукт\(:\ce{CCl_2}\), званий дихлорокарбеном:

Цей проміжний продукт має лише шість валентних електронів навколо вуглецю і тому сильно електрофільний. У водному розчині він швидко реагує з утворенням окису вуглецю та метаноату (форміату) іона:

Утворення\(:\ce{CCl_2}\)\(\ce{HCCl_3}\) від реакцій Рівняння 14-6 призводить до усунення\(\ce{HCl}\) - відходять груп, причому, обох\(\ce{Cl}\), що походять від одного\(\ce{H}\) і того ж атома вуглецю. Такі реакції не рідкість і називаються\(\alpha\) елімінаціями або 1,1 елімінаціями, щоб відрізнити їх від\(E1\) і\(E2\) реакціями, які є\(\beta\) елімінаціями або 1,2 елімінації. Ще іншими можливостями є такі реакції, як\(\gamma\) або 1,3 елімінації, але вони приймають характер внутрішніх\(S_\text{N}2\) реакцій і не будуть детально розглянуті тут.

Продукт\(\alpha\) елімінації - нейтральний вид, який нагадує карбокатіон, маючи лише шість вуглецевих валентних електронів. Найпростіший\(:\ce{CH_2}\) карбене - метилен. Карбени високореактивні, настільки, що їх неможливо ізолювати. Їх участь у реакціях зазвичай доводиться виводити з природи продуктів або кінетики реакції. Характерні реакції карбену включають формування електронно-парного зв'язку з вуглецем карбену шляхом взаємодії з\(\sigma\) зв'язками,\(\pi\) зв'язками або нерозділеними парами\(\left( n \right)\). Деякі з цих реакцій проілюстровані тут для метилену\(:\ce{CH_2}\). \(^1\)
з\(\sigma\) зв'язками (вставкою):

з\(\pi\) зв'язками ([2 + 1] циклододавання):

з нерозділеними парами (димеризація, додавання):

Карбени набагато більш реактивні по відношенню до вуглецево-вуглецевих подвійних зв'язків, ніж до одиночних зв'язків. Без сумніву, найбільш корисною особливістю\(\alpha\) елімінації є те, що вона забезпечує практичний шлях до циклопропанів та циклопропенів шляхом [2 + 1] циклододавання карбенів до подвійних або потрійних зв'язків. Ці доповнення є стереоспецифічними надфаціальними добавками, якщо вони включають синглетні карбени, але можуть давати суміші з трійними карбенами:

Карбенові попередники - це сполуки, які мають або набувають хороші залишкові групи (наприклад, галогенідні іони). Таким чином, галогенні сполуки часто є джерелами карбену. Тригалометани є найдавнішими відомими джерелами дигалокарбенів; але існують і інші методи отримання карбенів, і деякі з них перераховані для довідки в таблиці 14-2 (див. Також Розділ 14-10С). Існує питання щодо того, чи дійсно «вільний» карбене утворюється в деяких з цих реакцій, особливо тих, що стосуються металів, але для наших цілей ми класифікуємо їх як шляхи до карбенів або карбенеподібних видів.
Таблиця 14-2:\(\alpha\) -Реакції елімінації, що виробляють напівпродукти карбену\(^a\)

Багато карбенів, як і карбокатіони, переставляються в більш стійкі структури шляхом міграції сусідньої групи в електронно-дефіцитний вуглець. Таким чином фенілметилкарбен перебудовується на етенилбензол (стирол):

фторохлорметани
Заміна одного або двох хлорів тетрахлориду вуглецю фтором може бути легко досягнута трифторидом сурми, що містить деяку пентахлорид сурми. Реакція припиняється після заміни двох хлорів. Трифторид сурми можна постійно регенерувати з хлориду сурми шляхом додавання безводного фтористого водню:

Обидва продукти корисні як холодоагенти, особливо для побутових холодильників та кондиціонерів під торговою назвою фреон. Дифтордихлорметан (фреон 12) також використовується як пропеллент в аерозольних бомбах, дозаторах крем-стружки та інших подібних ємностях. Він нетоксичний, без запаху, негорючий і не вступає в реакцію з гарячими концентрованими мінеральними кислотами або металевим натрієм. Цей недолік реакційної здатності, як правило, характерний для дифторметиленової групи за умови, що фтори не розташовані на ненасиченому вуглеці. Приєднання атома фтору до атома вуглецю, пов'язаного з одним або декількома атомами хлору, має тенденцію значно знижувати реакційну здатність хлору до майже всіх типів реагентів. Можливі екологічні проблеми, пов'язані з цими речовинами, були розглянуті у вступі до цієї глави.
фторуглероди
Під час Другої світової війни пластмаси та мастильні сполуки незвичайної хімічної та термічної стійкості були потрібні для багатьох застосувань, зокрема для насосних апаратів, використовуваних для відділення\(\ce{^{235}U}\) від\(\ce{^{238}U}\) дифузії корозійного гексафториду урану через пористі бар'єри. Природним було розглядати використання для таких цілей речовин, виготовлених тільки з вуглецю і фтору (фторуглеродів), і значні зусилля були витрачені на способи приготування таких сполук, як\(\ce{-(CF_2)}-_n\). Сьогодні багато таких речовин в загальному вживанні. Їх часто називають «перфторо-» сполуками, що свідчить про те, що всі наявні водні гени материнського з'єднання замінюються фтором. Таким чином перфторциклогексан є\(\ce{(CF_2)_6}\). Широко використовуваним перфторвуглецем є пластичний матеріал\(\ce{-(CF_2)}-_n\), який виробляється в кількості шляхом радикальної полімеризації тетрафторетену:

Продукт («Тефлон») являє собою тверде хімічно інертне речовина, стійке до навколо\(300^\text{o}\). Це робить відмінні електроізоляційні та прокладкові матеріали. Він також має самосмажувальні властивості, які використовуються при підготовці поверхонь з низькою адгезією (таких як «антипригарні» сковороди) і легких підшипників.
Тетрафторетен може бути виготовлений в комерційних масштабах наступним методом:
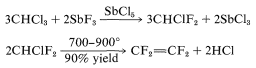
Остання реакція включає дифторкарбен\(\left( :\ce{CF_2} \right)\):

У присутності пероксидів тетрафторетен полімеризується до довголанцюгового полімеру. Якщо пероксиди виключені, [2 + 2] циклододавання відбувається з високим виходом для отримання октафторциклобутану (див. Розділ 13-3D):

Подібні реакції циклоприєднання відбуваються з хлортрифторетеном і 1,1-дихлор-2,2-дифторетеном.
Радикальна полімеризація хлортрифторетена дає корисний полімер (Kel-F), схожий на тефлон.
Відмінний еластомер високої хімічної стійкості (Вітон) може бути виготовлений шляхом сополімеризації гексафторпропену з 1,1-дифторетеном. Продукт стійкий до дії гарячої концентрованої азотної кислоти\(300^\text{o}\) і не піддається впливу. Хоча і дорогий, він не має собі рівних серед еластомерів по хімічній довговічності в екстремальних умовах.
Властивості фторуглеродів
Фторуглеводи мають надзвичайно низькі температури кипіння щодо вуглеводнів порівнянної молекулярної маси. Як видно на малюнку 14-3, їх температури кипіння майже однакові або навіть нижчі, ніж у алканів або циклоалканів з однаковою кількістю вуглецю. Таким чином октафторциклобутан або кипить\(17^\text{o}\) нижче, ніж циклобутан, незважаючи на майже вчетверо більшу молекулярну масу!

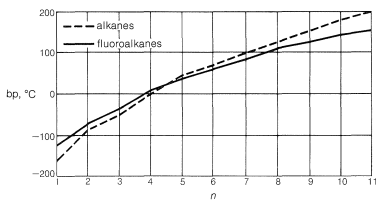
Фторуглероди дуже нерозчинні в більшості полярних розчинників і лише слабо розчинні в алканах в гасовому діапазоні. Фторуглероди з вищою молекулярною масою навіть не змішуються у всіх пропорціях з їх гомологами з нижчою молекулярною вагою.
Фізіологічні властивості органофторних сполук сильно різняться. Дихлордифторметан та насичені фторуглероди виявляються абсолютно нетоксичними. Навпаки, перфтор-2-метилпропен надзвичайно токсичний, більше, ніж військовий газ, карбонілдихлорид\(\left( \ce{COCl_2} \right)\). Фторетаноат натрію\(\left( \ce{CH_2FCO_2Na} \right)\) і 2-фторетанол є токсичними похідними фтору кисневмісних органічних речовин. Сіль фторетаноату продається комерційно як родентицид. Цікаво, що трифторетаноат натрію нетоксичний.
Похідні фторуглероду мають ще одну цікаву і потенційно корисну власти Вони розчиняють велику кількість кисню. Цей факт у поєднанні з їх нетоксичністю призвів до їх використання в якості заміни крові в хірургії серця на експериментальних тварин. Миші можуть жити повністю зануреними в насичені киснем рідкі фторуглероди.
\(^1\)Життя з карбенами істотно ускладнюється тим, що існує дві різні форми (синглетна і триплетна)\(:\ce{CH_2}\) і імовірно всіх інших карбенів. Дві форми значно\(:\ce{CH_2}\) відрізняються своєю реакційною здатністю. Один - синглет, який має свої нерозділені електрони в парі, а інший - триплет з тими ж електронами, непарними. Бо\(:\ce{CH_2}\), синглетна форма є менш стабільною і більш реактивною, тоді як з\(:\ce{CCl_2}\), триплет є менш стабільним і більш реактивним.
