14,7: Аріл галогеніди
- Page ID
- 106262
Арілогалогеніди мають галоген, безпосередньо пов'язаний з вуглецем ароматичного кільця. Прикладами є бромбензол, фторбензол та 2,4-дихлорметилбензол:

Деякі методи, за допомогою яких отримують алкілгалогеніди, не працюють для арілгалогенідів, оскільки важко утворювати\(\ce{C}\) галогенні зв'язки при ароматичних кільцевих вуглецях за допомогою реакцій нуклеофільного витіснення. Найбільш поширеними способами формування\(\ce{C}_\text{aryl}\) галогенних зв'язків є заміна\(\ce{C}_\text{aryl} \ce{-H}\) електрофільними галогенірующими агентами (наприклад,\(\ce{Br_2}\) або\(\ce{Cl_2}\)),

і шляхом заміни\(\ce{C-NH_2}\) на\(\ce{C}-\) галогенні. Ці реакції перераховані в таблиці 14-5 і будуть більш детально розглянуті в розділах 22 і 23.
Нуклеофільні ароматичні реакції зміщення
Вуглець-галогенні зв'язки арілгалогенідів схожі на алкенілгалогеніди набагато сильніші, ніж алкілгалогеніди (див. Таблицю 4-6). Прості арілгалогеніди, як правило, стійкі до атак нуклеофілів в будь-якому\(S_\text{N}1\) або\(S_\text{N}2\) реакціях (табл. 14-6). Однак ця низька реакційна здатність може бути різко змінена змінами умов реакції та структури арілгалогеніду. Насправді нуклеофільне зміщення стає досить швидким (а), коли арілгалогенід активується заміщенням сильно привертають електрони групами\(\ce{NO_2}\), такими як, і (б) коли використовуються дуже сильно основні нуклеофільні реагенти.
Механізм аддації-елімінації нуклеофільної заміщення
Хоча прості арілгалогеніди інертні до звичайних нуклеофільних реагентів, значна активація виробляється сильно привертають електрони замісниками за умови, що вони розташовані або в орто- або пара-позиціях, або в обох. Наприклад, витіснення іона хлориду з 1-хлор-2,4-динітробензолу диметиламіном відбувається легко в розчині етанолу при кімнатній температурі. За тих же умов хлорбензол повністю не реагує; таким чином активуючий вплив двох нітрогруп становить коефіцієнт щонайменше\(10^8\):
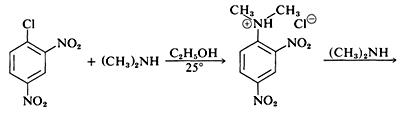
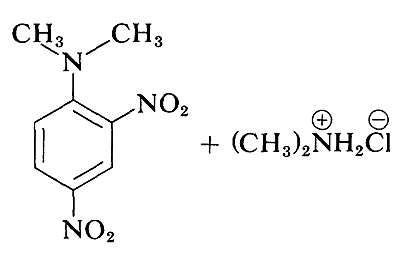
Пов'язаною реакцією є реакція 2,4-динітрофторбензолу з аміногрупами пептидів і білків, і ця реакція забезпечує засіб для аналізу N -кінцевих амінокислот в поліпептидних ланцюгах. (Див. Розділ 25-7B.)
В цілому реакції активованих арілгалогенідів дуже нагадують реакції\(S_\text{N}2\) -витіснення аліфатичних галогенідів. Однакові нуклеофільні реагенти ефективні (наприклад,\(\ce{CH_3O}^\ominus\)\(\ce{HO}^\ominus\), і\(\ce{RNH_2}\)); реакції другого порядку в цілому (перший порядок у галогенідів і перший порядок у нуклеофілів); і для даного галогеніду чим більше нуклеофільний атакуючий реагент, тим швидше реакція. Однак має бути більше, ніж тонка різниця в механізмі, оскільки арілгалогенід не в змозі пройти через той же тип перехідного стану, що і алкілгалогенід у\(S_\text{N}2\) переміщеннях.
Загальноприйнятий механізм нуклеофільного ароматичного заміщення арілгалогенідів, що несуть активуючі групи, включає два етапи, близькі до тих, що коротко описані в Розділі 14-4 для алкенілу та алкінілгалогенідів. Перший крок включає атаку нуклеофіла\(\ce{Y}^\ominus\) на вуглець, що несе галоген-замінник з утворенням проміжного карбоніону\(4\) (рівняння 14-3). Ароматична система руйнується при утворенні аніона, а вуглець в місці реакції змінюється з плоских (\(sp^2\)зв'язків) на тетраедричні (\(sp^3\)зв'язки).

На другому етапі втрата аніона,\(\ce{X}^ominus\) або\(\ce{Y}^\ominus\), регенерує ароматичну систему, і, якщо\(\ce{X}^\ominus\) втрачається, загальна реакція нуклеофільного зміщення\(\ce{X}\) по\(\ce{Y}\) (Рівняння 14-4).

У випадку нейтрального нуклеофільного реагенту,\(\ce{Y}\) або\(\ce{HY}\), послідовність реакції буде однаковою, за винятком необхідних коригувань в заряді проміжного:
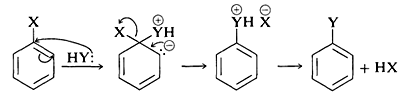
Чому цей шлях реакції взагалі несприятливий для простих арілгалогенідів? Відповідь полягає в тому, що проміжний\(4\), який ми можемо висловити як гібрид структур валенс-бонд\(4a\) - занадто високий за енергією\(4c\), щоб формуватися з будь-якою практичною швидкістю. Не тільки\(4\) втратила ароматичну стабілізацію бензольного кільця, але і його утворення призводить до перенесення негативного заряду на кільцеві вуглеці, які самі по собі не дуже електронегативні:

Однак, коли на кільці розташовані сильнопритягуючі електрони групи в орто-парах позиціях, проміжний аніон стабілізується шляхом делокалізації електронів з кільцевих вуглеців до більш сприятливих місць на групах заміщення. Як приклад розглянемо витіснення брому на\(\ce{OCH_3}\) в реакції 4-бромонітробензолу і метоксид-іона:
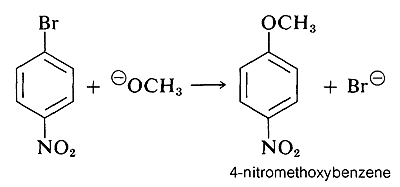
Аніонний проміжний продукт, утворений додаванням метоксид-іона до арілгалогеніду, може бути описаний структурами валенс-зв'язку\(5a\) -\(5d\). З цих структур особливо\(5d\) важливо тому, що в ній заряд переноситься з кільцевих вуглеводів в кисень нітрозамісника:
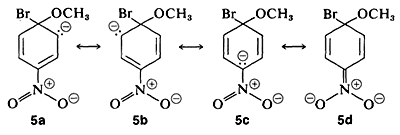
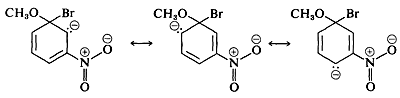
Замісники в мета-позиціях набагато менше впливають на реакційну здатність арілгалогеніду, оскільки делокалізація електронів до замісника неможлива. Ніякі формули не можуть бути записані аналогічно\(5c\) і\(5d\) в яких негативні заряди знаходяться як на атомах поруч з позитивним азотом, так\(\overset{\ominus}{\ce{C}} \overset{\oplus}{\ce{-N}-} \overset{\ominus}{\ce{O}}\) і\(\overset{\ominus}{\ce{O}} \overset{\oplus}{\ce{-N}-} \overset{\ominus}{\ce{O}}\),
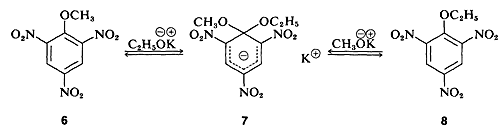
У кількох випадках були виділені стабільні сполуки, що нагадують постульований проміжний проміжний проміжний продукт реакції. Одним з класичних прикладів є комплекс\(7\) (виділений Дж. Мейзенгеймером), який є продуктом реакції або метиларілового ефіру 6\(6\) з етоксидом калію, або етиларілового ефіру\(8\) і метоксиду калію:
Механізм елімінації-додавання нуклеофільної ароматичної заміщення. Арінс
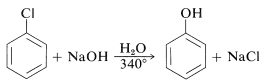
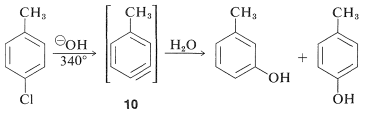
Реактивність арілгалогенідів, таких як галобензени, надзвичайно низькі по відношенню до нуклеофільних реагентів, які зазвичай впливають на переміщення алкілгалогенідів та активованих арилогалогенідів. Заміни відбуваються в умовах форсування або високих температур, або дуже міцних підстав. Наприклад, хлорбензол реагує з розчином гідроксиду натрію при температурах навколо,\(340^\text{o}\) і ця реакція колись була важливим комерційним процесом для виробництва бензолу (фенолу):
Крім того, арілхлориди, броміди та йодиди можуть бути перетворені в аренеаміни\(\ce{ArNH_2}\) кон'югатними основами амінів. Насправді реакція аміду калію з бромбензолом надзвичайно швидка, навіть при таких низьких температурах, як\(-33^\text{o}\) з рідким аміаком як розчинником:
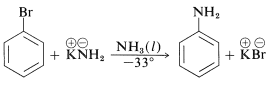
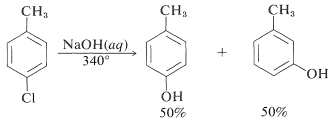
Однак реакції зміщення цього типу відрізняються від раніше обговорюваних переміщень активованих арілгалогенідів в тому, що часто відбувається перестановка. Тобто входить група не завжди займає таке ж положення на кільці, як і звільняється галоген-замінником. Наприклад, гідроліз 4-хлорметилбензолу при\(340^\text{o}\) дає рівномолярна суміш 3- і 4-метилбензолів:
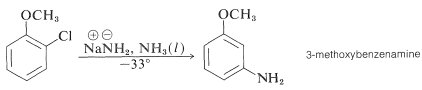
Ще більш вражаючим є виключне утворення 3-метоксибензоламіну при амінування 2-хлорметоксибензолу. Зверніть увагу, що цей результат є порушенням принципу найменших структурних змін (Розділ 1-1Н):
Механізм цього типу реакції широко вивчений, і накопичилося багато доказів на підтримку поетапного процесу, який протікає спочатку шляхом каталізованого основою усунення галогеніду водню\(\left( \ce{HX} \right)\) з арілгалогеніду - як показано нижче для амінування бромбензолу:
ліквідація
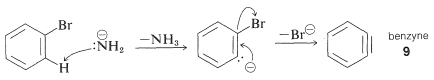
Продукт реакції елімінації - це високореактивний проміжний продукт, який\(9\) називається бензином, або дегідробензол, який відрізняється від бензолу тим, що має два менше водню та додатковий зв'язок між двома орто вуглецями. Бензин швидко вступає в реакцію з будь-яким наявним нуклеофілом, в даному випадку розчинником, аміаком, щоб надати продукту доповнення:
Додавання
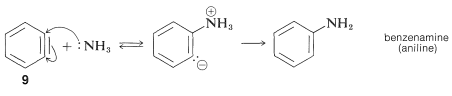
Перестановки в цих реакціях виникають внаслідок нападу нуклеофіла на той чи інший вуглець додаткової зв'язку в проміжному. З бензином симетрія така, що не буде виявлено жодної перестановки. З заміщеними бензинами можуть вийти ізомерні продукти. Так 4-метилбензин\(10\), від реакції гідроксид-іона з 4-хлор-1-метилбензолом дає як 3-, так і 4-метилбензоли:
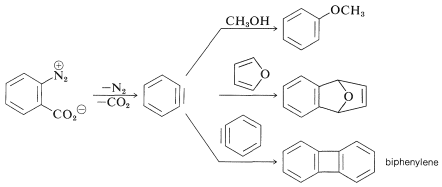
У вищезазначених реакціях бензин основа, яка виробляє бензин на стадії елімінації, походить від нуклеофіла, який додає на стадії додавання. Це не завжди потрібно так, в залежності від умов реакції. Насправді синтетична корисність реакцій арину значною мірою залежить від успіху, з яким арин може генеруватися одним реагентом, але захоплений іншим. Один з таких методів буде розглянуто в розділі 14-10С і включає в себе металоорганічні сполуки, отримані з арілгалогенідів. Інший метод полягає в генерації арину шляхом термічного розкладання 1,2-дизаміщеної аренової сполуки\(11\), наприклад, в якій обидва замісники залишають групи - один виходить з електронною парою, інший залишає без:
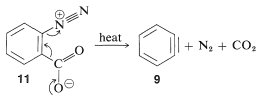
При\(11\) розкладанні в присутності доданого нуклеофіла проміжний бензин потрапляє в пастку нуклеофіла в міру його утворення. Або, якщо присутній кон'югований дієн, бензин буде реагувати з ним циклододаванням [4 + 2]. При відсутності інших сполук, з якими він може вступати в реакцію, бензин зазнає [2 + 2] циклододавання до себе:
Використовує для арилових галогенних сполук
Як і у більшості органічних галогенідів, арілгалогеніди найчастіше є синтетичними проміжними продуктами для отримання інших корисних речовин. Наприклад, хлорбензол є початковим арілгалогенідом для синтезу ДДТ; він також є джерелом бензолу (фенол, розділ 14-6C), який, в свою чергу, має багато застосувань (Розділ 26-1).
Кілька ароматичних хлоросполук широко використовуються як інсектициди, гербіциди, фунгіциди та бактерициди. Вони також набули великої популярності, оскільки в деяких випадках їх нерозбірливе використання призвело до серйозних проблем. Наприклад, гексахлорофен - зовнішній бактерицид, який до недавнього часу використовувався в косметичних препаратах, таких як мило, дезодоранти і так далі. Його використання було припинено через переконливі докази того, що він може всмоктуватися через шкіру в кількостях, небезпечних, якщо не смертельних, для немовлят та маленьких дітей.

Інші пестициди, зокрема ДДТ та гербіциди 2,4-D та 2,4,5-T, частково заборонені з різних причин.

