14.5: Алкеніл та алкініл галогеніди
- Page ID
- 106258
Найбільш доступним алкенілгалогенідом є хлоретен (вінілхлорид), який можна приготувати за кількома шляхами:

Найбільш економічним комерційним препаратом є високотемпературне хлорування етена. Корисна модифікація цього процесу використовує замість хлору хлористий водень. Окислювач необхідний для підвищення ступеня окислення хлору\(\ce{HCl}\) до рівня\(\ce{Cl_2}\); молекулярний кисень використовується для цієї мети разом з солями міді як каталізатори.
Загальні способи приготування алкенілу і алкінілгалогенідів наведені в табл. 14-5. Під алкінілогалогенідами ми маємо на увазі 1-гало-алкіни. Один цікавий метод, за допомогою якого вони можуть бути отримані, використовує 1-алкіни з гіпофалітами:

Такий вид реакції не протікає ні з алканами, ні алкенами.
Використання алкенілу галогеніду
Хлороетин виробляється у величезних кількостях для виробництва полімерів (полівінілхлориду) і сополімерів:

Ці полімери зазвичай описуються як ПВХ пластмаси або менш конкретно як «вініл». Це матеріали, які можуть бути як гнучкими, так і жорсткими відповідно до того, з чим вони змішуються, і вони використовуються у виробництві багатьох знайомих виробів, таких як пластикові штори, дощовик, плитка для підлоги, вироби з синтетичної шкіри, оббивка, килимки для столу, записи фонографа, ізоляція, пластикові труби, трубки та пакувальні матеріали.
Останнім часом було встановлено, що особи, що працюють на заводах, які виробляють і використовують хлороетин, мають надзвичайно високу частоту виникнення незвичайного типу раку печінки. В результаті були встановлені суворі правила безпеки та норми забруднення для рослин, де виробляється або використовується хлороетин. Колись широке використання хлороетена як пропелленту для аерозольних балончиків було скорочено. Сам полівінілхлорид здається цілком безпечним, але можливі проблеми з його включенням до внутрішніх будівельних матеріалів, одягу та оббивки, оскільки тепло, таке як вогонь, змушує розкладатися полівінілхлорид, тим самим утворюючи хлористий водень як один продукт розкладання. У закритих приміщеннях токсичність хлористого водню може бути такою ж серйозною небезпекою, як і сама пожежа. Інші полімери можуть виділяти аналогічно токсичні продукти при сильному нагріванні.
Хімічні властивості
Видатною хімічною характеристикою алкенілгалогенідів є їх загальна інертність в\(S_\text{N}1\) і\(S_\text{N}2\) реакції. Таким чином, хлороетин не реагує з нітратом срібла в етанолі (тобто з низькою\(S_\text{N}1\) реакційною здатністю), не реагує з йодидом калію в ацетоні (тобто низькою\(S_\text{N}2\) реакційною здатністю) і лише повільно реагує з гідроксидом натрію, щоб дати етин (низька\(E2\) реакційна здатність). Галоалкіни, такі як\(\ce{RC \equiv C-Cl}\), аналогічно нереактивні.
Не дивно, що\(\ce{=C-X}\) і\(\ce{\equiv C-X}\) зв'язки важко розірвати гетеролітично. Взагалі\(\ce{C-X}\) зв'язки міцні в алкенілгалогенідах (див. табл. 4-6), і ця властивість, як правило, робить їх менш реактивними, ніж алкілгалогеніди. Крім того, вуглеці з подвійним і потрійним зв'язком сильніше привертають електрони, ніж насичені\(sp^3\) вуглеці, що є причиною того, що 1-алкіни та алкени є сильнішими кислотами (Розділ 11-8), ніж алкани. Отже, простіше розірвати\(\ce{\equiv C-H}\) зв'язок у сенсі\(\ce{C}^\ominus \ce{H}^\oplus\), ніж як\(\ce{\equiv C}^\oplus \ce{H}^\ominus\). Також буде важче іонізувати вуглецево-галогенний зв'язок,\(\ce{C}^\oplus \ce{X}^\ominus\) якщо вуглець ненасичений. Тому етенилові та етинілові катіони, такі як\(\ce{CH_2=CH}^\oplus\) і\(\ce{HC \equiv C}^\oplus\), важко генерувати з відповідних галогенідів. Потрібні вищі групи виходу, такі як трифторметансульфонат,\(\ce{-OSO_3CF_3}\) (Розділ 8-7C):

Причиною відсутності\(S_\text{N}2\) реактивності у етинілових або етинілгалогенідів може бути те, що атакуючий нуклеофіл не здатний реагувати узгодженим інверсійним механізмом, який незмінно спостерігається з алкілгалогенідами:
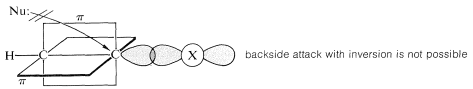
Проте, заміна галогену все ж відбувається за деяких обставин. У таких випадках нуклеофіл спочатку додає до множинного зв'язку, а на наступному етапі галогенід виходить у вигляді галогенідного іона. Це механізм «додавання-усунення», про який ми будемо мати більше прикладів пізніше:

