14,4: Алкілгалогеніди
- Page ID
- 106272
Важлива хімія алкілгалогенідів включає нуклеофільні\(\left( E \right)\) реакції\(\left( S_\text{N} \right)\) витіснення та елімінації, розглянуті в главі 8.\(\ce{RX}\) Нагадаємо, що третинні алкілгалогеніди в нормі реактивні в\(\left( S_\text{N}1 \right)\) реакціях іонізації, тоді як первинні галогеніди, і в меншій мірі вторинні галогеніди, реактивні в\(S_\text{N}2\) реакціях, які відбуваються узгодженим механізмом з інверсією конфігурації ( Секції 8-4 по 8-7).
Елімінація конкурує з заміщенням у багатьох\(S_\text{N}\) реакціях і може стати основним шляхом при високих температурах або при наявності міцної основи. Елімінація\(\left( E_2 \right)\)\(\left( S_\text{N}2 \right)\), на відміну від зміщення, нечутлива до стеричної перешкоди в алкілгалогеніді. Насправді реакційна здатність\(E_2\) алкілгалогенідів є tert\(\ce{RX} >\) sec\(\ce{RX} >\) prim\(\ce{RX}\), що протилежно їх\(S_\text{N}2\) реактивності.

Кілька корисних реакцій для синтезу алкілгалогенідів, з якими ми вже стикалися, узагальнені нижче з посиланнями на розділи, які надають більш детальну інформацію:

Короткий зміст цих та деяких інших реакцій для синтезу алкілгалогенідів або органогалогенних сполук наведено в табл. 14-5.
Аллілові (2-пропеніл) галогеніди
Галогенні сполуки, в яких вуглець-галогенний зв'язок сусідить з подвійним бондом, як в, відомі як алілові галогеніди. Найпростіший приклад - 3-хлоропропен\(\ce{CH_2=CHCH_2Cl}\), який виготовляється у великих масштабах шляхом радикального хлорування пропену при\(400^\text{o}\):
відомі як алілові галогеніди. Найпростіший приклад - 3-хлоропропен\(\ce{CH_2=CHCH_2Cl}\), який виготовляється у великих масштабах шляхом радикального хлорування пропену при\(400^\text{o}\):

Велика частина 3-хлоропропену, приготованого таким чином, перетворюється в інші важливі сполуки. Наприклад, додавання хлорноватистої кислоти дає суміш дихлорпропанолів, яка при обробці основою дає речовина, комерційно відоме як «епіхлоргідрин»:

Реакція закриття кільця з\(\ce{Ca(OH)_2}\) є внутрішньою\(S_\text{N}2\) реакцією. Гідроксид-іон перетворює спирт в іон алкоксиду, який діє як нуклеофіл у витісненні сусіднього хлору:

Отриманий таким чином епіхлоргідріс використовується в основному для виготовлення епоксидних смол (див. Розділ 29-5Е), хоча деякі з них гідролізуються до гліцерину:

Загальний спосіб отримання алілогалогенідів полягає в додаванні галогенідів водню до кон'югованих дієнів. Таку реакцію зазвичай виробляє суміш 1,2- і 1,4-продуктів додавання (див. Розділ 13-2):

Другий загальний метод включає бромування алкену N -бромосукцинімідом (реакція Воля - Циглера). Радикально-ланцюгова реакція відбувається між N -бромосукцинімідом (NBS) та алкенами, яка зазвичай ініціюється світлом, пероксидами або іншими каталізаторами, і дає аллілові броміди:

Ця реакція, як і хлорування пропену, є високоселективною в тому, що так званий\(\ce{C-H}\) алліл атакується переважно.
З енергій зв'язку (табл. 4-6) ми знаємо, що найслабші\(\ce{C-H}\) зв'язки пропену відносяться до алільних воднів,\(\ce{H_2C=CHCH_2-H}\). Тому на першому етапі радикально-ланцюгового хлорування пропену алліловий водень видаляється атомом хлору (рівняння 14-1). Аллілові\(\ce{C-H}\) зв'язки слабкіші за алкенічні\(\ce{C-H}\) зв'язки через додаткову стабілізацію радикала, отриманого на водневій абстракції (рівняння 14-1). Для 2-пропенільного радикала можна записати дві еквівалентні структури валентного зв'язку (\(1a\)і\(1b\)); електронна делокалізація підвищує стійкість радикала (див. Розділ 6-5С):

На другому етапі ланцюгової реакції (рівняння 14-2) пропеніловий радикал може утворювати вуглець-галогенний зв'язок на будь-якому кінці шляхом абстрагування атома галогену з галогенірующего агента:

Вироблений зараз\(\ce{Cl} \cdot\) атом може брати участь в Реакції 14-1, тим самим продовжуючи ланцюг. З пропеном проміжний радикал дає той же продукт, 2-пропенілхлорид, незалежно від того, переноситься атом хлору в 1- або 3-вуглець. Однак радикал, утворений при видаленні аллилового водню з 2-бутену, дає суміш продуктів:
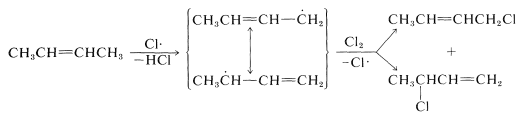
\(S_\text{N}\)Реакції алілових галогенідів
Вуглець-галогенні зв'язки аллілогалогенідів особливо реактивні в обох\(S_\text{N}1\) і\(S_\text{N}2\) реакціях (табл. 14-6). Причини підвищеної\(S_\text{N}1\) реактивності обговорювалися раніше (розділ 8-7B). Наприклад, легкість, з якою іонізується 1-хлор-2-бутен порівняно з 1-хлорбутаном, пояснюється стабільністю катіона 2-бутенілу, який розподіляється між\(\ce{C_1}\) і\(\ce{C_3}\), і нуклеофіл (вода) атакує в обох позиціях для отримання сумішей продуктів. Такі ж результати виходять, якщо почати з 3-хлор-1-бутену, оскільки утворюється однаковий катіон:



Бензилові (фенілметил) галогеніди
Реактивність, порівнянна з аллілогалогенідами, виявлена в реакціях витіснення нуклеофілів бензилових галогенідів за\(S_\text{N}1\) і\(S_\text{N}2\) механізмами (табл. 14-6). Здатність бензилових галогенідів піддаватися\(S_\text{N}1\) реакціям явно пов'язана зі стабільністю одержуваних бензилових катіонів, електрони яких інтенсивно делокалізовані. Таким чином, для фенілметилхлориду,

Коли галоген-замінник розташований два або більше вуглецю з арильної групи, як у 2-фенілетилброміду\(\ce{C_6H_5CH_2CH_2Br}\), виражений активуючий ефект, очевидний у бензилових галогенідів, зникає, а реакційна здатність галогенідів по суті є первинним алкілгалогенідом (наприклад,\(\ce{CH_3CH_2CH_2Br}\)).
Бензилові галогеніди можуть бути отримані тими ж радикально-галогенірующими агентами, які дають алкени алкенів алілові галогеніди. До них відносяться\(\ce{Cl_2}\)\(\ce{Br_2}\), N -бромосукцинімід (Розділ 14-3A)\(\ce{SO_2Cl_2}\), і трет-бутил гіпохлорит:

Бензиловий\(\ce{C-H}\) зв'язок слабкіше і більш обмежує, ніж первинні алканові\(\ce{C-H}\) зв'язки через стабілізацію бензилових радикалів (див. Таблицю 4-6).
