9.10: Освіта галогідринів
- Page ID
- 22901
Мета навчання
- прогнозувати продукти/вказати реагенти для гідрогалогенізації алкенів
Вступ
Протон - не єдиний електрофільний вид, який ініціює реакції приєднання до подвійного зв'язку алкенів. Кислоти Льюїса, такі як галогени, гідриди бору та певні іони перехідних металів, здатні приймати алкенові пі-електрони. Отримані позитивно заряджені проміжні продукти залучають нуклеофілів для отримання продуктів додавання. Електрофільний характер галогенів добре відомий. Фтор безконтрольно додає алкенами, а додавання йоду несприятливо, тому це не корисні препаративні методи. Хлор (Cl 2) і бром (Br 2) реагують вибірково з подвійним зв'язком алкенів, тому ми зупинимося на цих реакціях.
Додавання хлору і брому в алкени, як показано нижче, утворює віцінальні дигалосполуки. У цій реакції можна припустити, що розчинник був чимось, що не є нуклеофільним, наприклад тетрагідрофуран (THF).
R 2 С=КР 2 + Х 2 — -> R 2 С Х -КР 2 Х
Якщо ця ж реакція виконується в нуклеофільному розчиннику, такому як вода або спирт, то розчинник стає нуклеофілом на другому етапі і реагує з іоном бромонію (або хлоронію) з утворенням галогідрину, як показано нижче.
R 2 С=КР 2 + Х 2 + Н 2 О — -> R 2 С ОН -CR 2 X
Існують також інші галогенсодержащие реагенти, які додають до подвійних зв'язків, такі як гіпокаліозні кислоти, HOX та сульфенілхлориди, RscL. Ці реагенти несиметричні, тому їх додавання в несиметричні подвійні зв'язки може в принципі відбуватися двома способами. На практиці ці реакції приєднання є регіоселективними, при цьому один з двох можливих конституційно ізомерних продуктів віддається перевазі. Електрофільний фрагмент в обох цих реагентах є галогеном.
(СН 3) 2 С=СН 2 + ГБр — -> (СН 3) 2 С ОН -СН 2 Бр
(СН 3) 2 С = СН 2 + С 6 Н 5 СЛ — > (СН 3) 2 С Сл -СН 2 С С 6 Н 5
Механізми пояснюють регіоселективність
X 2/H 2 O або X 2 /ROH: Регіоселективність утворення галогідрину від реакції алкену з галогеном в нуклеофільному розчиннику аналогічна шляху оксимерції-демеркурації. Молекула галогену виконує роль електрофілу, що приймає нуклеофільні пі електрони з алкену, одночасно утворюючи зв'язок з іншим вініловим вуглецем для створення іона бромонію (або хлору). Утворення іонів бромонію (або хлоронію) стабілізує позитивний заряд і запобігає карбокатіонной перестановці. Розчинник бере на себе роль нуклеофіла, оскільки він присутній набагато більший відсоток, ніж вихідна група, і реагує з найбільш заміщеним вуглецем циклічного іона бромонію (або хлоронію) для створення регіохімії. Стереохімія цієї реакції є анти-додаванням, оскільки розчинник наближається до іона бромонію з орієнтацією на зворотну сторону для отримання продукту додавання. Однак, оскільки взаємодія галогену з алкеном може відбуватися зверху або знизу, в цій реакції немає стереохімічного контролю і при застосуванні буде вироблятися суміш енантіомерів. Завершальним етапом цього механізму є перенесення протона в молекулу води розчинника для нейтралізації продукту додавання.
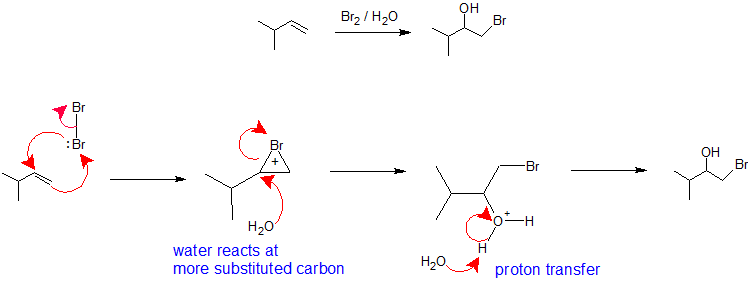
HOX або RscL: Регіоселективність реакцій гіпокаліозних кислот і сульфенілхлориду може бути пояснена тим самим механізмом, який ми використовували для раціоналізації правила Марковникова. Зв'язування електрофільного виду з подвійним зв'язком алкенових форм переважно для отримання більш стабільного (більш високо заміщеного) карбокатіону. Потім цей проміжний продукт повинен швидко поєднуватися з нуклеофільним видом для отримання продукту додавання.
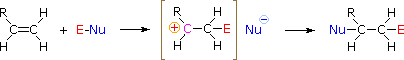
Для застосування цього механізму нам потрібно визначити електрофільний фрагмент в кожному з реагентів. Використовуючи відмінності електронегативності, ми можемо розсікати загальні реагенти додавання на електрофільні та нуклеофільні фрагменти, як показано праворуч. У випадку хлорноватистої та гібромної кислот (HOX) ці слабкі кислоти Brønsted (pKa ca. 8) не реагують як донори протонів; а оскільки кисень є більш електронегативним, ніж хлор або бром, електрофіл буде галогенідним катіоном. Нуклеофільний вид, який зв'язується з проміжним карбокатом, - це гідроксид-іон, або, швидше за все, вода (звичайний розчинник для цих реагентів), а продукти називаються галогідринами. Сульфенілхлориди додають протилежним чином, оскільки електрофіл є катіоном сірки, RS (+), тоді як нуклеофільний фрагмент є хлоридним аніоном (хлор більш електронегативний, ніж сірка).
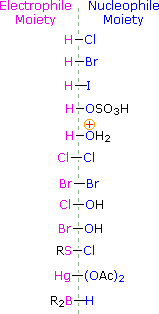
Нижче наведено кілька прикладів, що ілюструють додавання різних електрофільних галогенних реагентів до алкенових груп. Зверніть увагу на специфічну регіохімію продуктів, як пояснено вище.
Вправа
1. Передбачте продукт наступної реакції:

2. При обробці бутеном НБС в присутності води продукт показує, що бром знаходиться на найменш заміщеному вуглеці, це Марковников або антимарковников?
- Відповідь
-
1.

2. Так як бром є першим доповненням до алкену, це доповнення було б антимарковниковим доповненням.