10.3: сполуки хлору
- Page ID
- 17608
Порівняння з фтором
Щоб оцінити хімію хлору порівняно з хімією фтору, необхідно оцінити відмінності та тенденції між елементами. Як видно з табл.\(\PageIndex{1}\), хлориду значно більше, ніж фтору. Крім того, хоча хлор є електронегативним елементом, його електронегативність значно менша, ніж у фтору, що призводить до меншого полярного зв'язку.
| Елемент | Іонний радіус (Å) | Ковалентний радіус (Å) | Радіус ван дер Ваал (Å) | Електронегативність |
|---|---|---|---|---|
| Фтор | 1.33 | 0,64 | 1.47 | -4.1 |
| хлор | 1.81 | 0,99 | 1.75 | -2.9 |
Зв'язок X-Cl - це ковалентний зв'язок електронної пари з високополярною природою. У зв'язку з цим хлор схожий на фтор. Однак є дві ключові особливості зв'язку хлору, що відрізняє його від фтору.
- На відміну від фтору, хлор може утворювати множинні ковалентні зв'язки, наприклад, ClO 4 - і ClF 3.
- На відміну від фтору, хлор може утворювати π-зв'язки з киснем, т. Е.
Хлоридний іон (Cl -) утворює солі з іонними гратами (наприклад, NaCl), але також утворює широкий спектр комплексів, наприклад, [Fe (H 2 O) 5 Cl] 2+ і [rHCl 6] 3-. Хлорид також виступає в ролі мостового ліганда, в якому один, два або три хлорида можуть перемикати два металеві центри (рис.\(\PageIndex{1}\)).
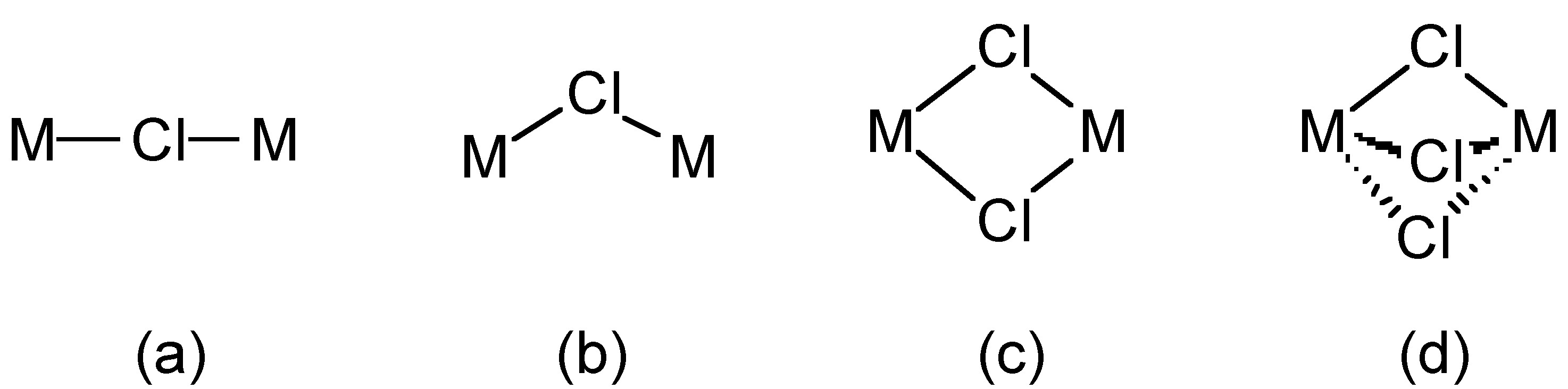
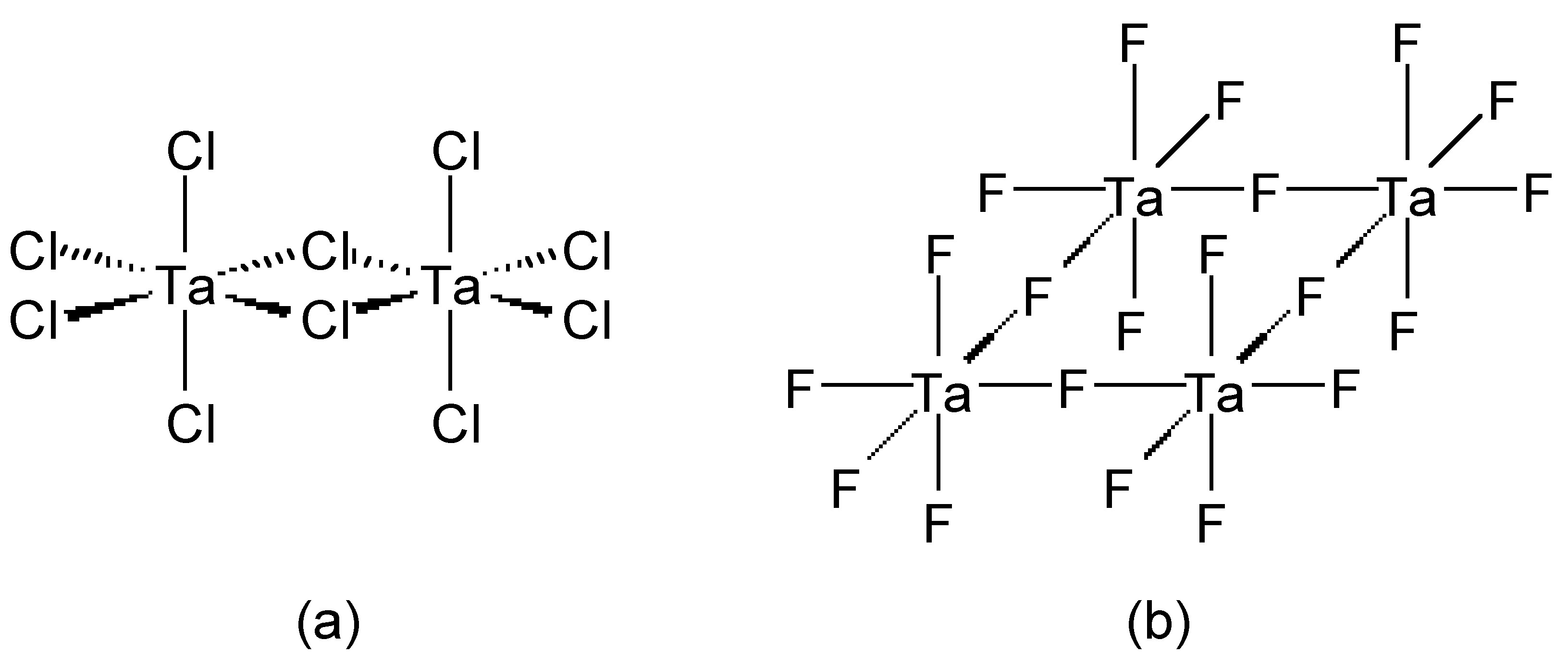
Хлоридні (і бромідні) мости зазвичай згинаються, тоді як фторидні мости можуть бути як лінійними, так і зігнутими. Як приклад, BeF 2 і BeCl 2 є ізоструктурними, що складаються з нескінченних ланцюгів з зігнутими перемичками (рис.\(\PageIndex{2}\)). На відміну від цього, пентагалогеніди перехідних металів показують різну структуру залежно від ідентичності галогеніду. При цьому TaCl 5 димеризується зігнутими мостами (рис.\(\PageIndex{3}\) А), тоді як TaF 5 утворює циклічний тетрамер з лінійними фторидними мостами (рис.\(\PageIndex{3}\) b).
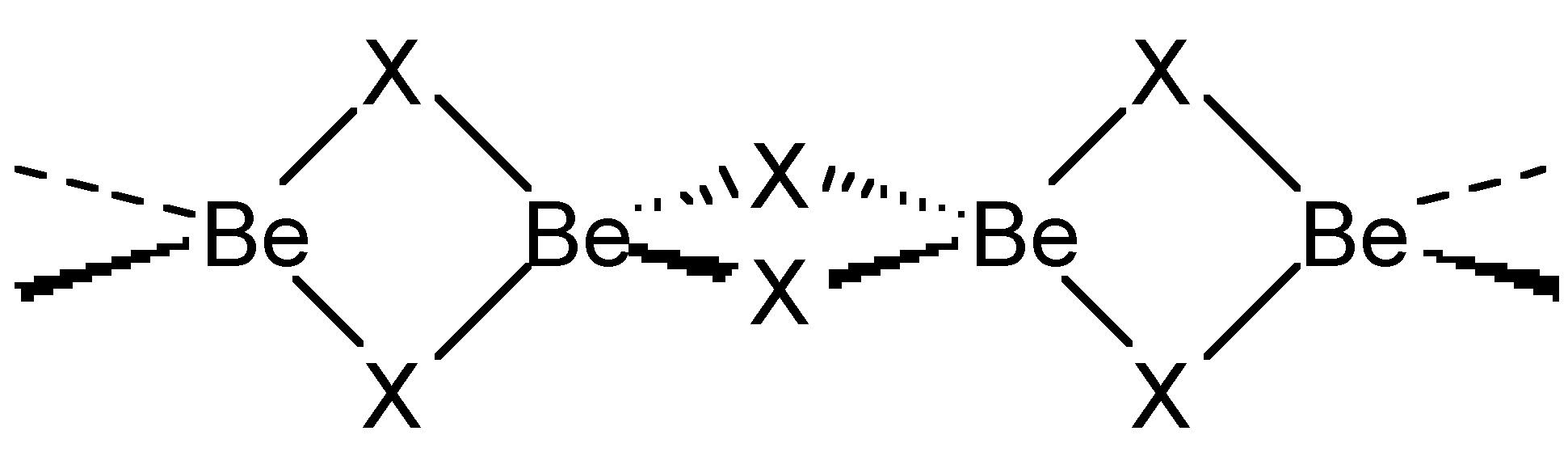
Галогенідний міст
Містові галогенідні зв'язки можуть бути описані як Льюїсом, так і молекулярно-орбітальною (МО) теорією. На простій картині можна вважати, що самотня пара термінального галогеніду виступає як ліганд донора бази Льюїса до другого кислотного металевого центру Льюїса. Дійсно, деякі галогеніди мостів асиметричні відповідно до цієї точки зору; однак симетричні можуть бути описані резонансною формою. З молекулярно-орбітальної точки зору, мостовий галогенід представлений комбінацією двох металевих центрованих орбіталей з двома галогенними орбіталями.
Хлористий водень
Хлористий водень (HCl) отримують реакцією концентрованої сірчаної кислоти (H 2 SO 4) або з NaCl або концентрованим розчином HCl.
Хлористий водень - полярна молекула з диполем 1,08 D. Однак нижча полярність порівняно з фтористого водню (1,91 D) відповідає фізико-хімічним властивостям. Хлористий водень - це газ кімнатної температури (Mp = -114,25° C, Bp = -85.09° C), а його низька температура кипіння відповідає слабкому водневому зв'язку в рідкому стані. У той час як самоіонізація, (10.3.1), дуже мала, рідкий HCl розчиняє деякі неорганічні сполуки, даючи провідні розчини, (10.3.2).
\[ \rm 3 HCl \rightleftharpoons H_2Cl^+ + HCl_2^-\]
\[ \rm R_3N + 2 HCl \rightleftharpoons R_3NH^+ + HCl_2^-\]
Хлористий водень розчинний (і реагує) у воді, (10.3.3). PK a реакції (-7,0) більший, ніж спостерігається для фтору (3.2) і як такий HCl є сильнішою кислотою, ніж HF.
\[ \rm HCl + H_2O \rightleftharpoons H_3O^+ + Cl^- \]
Оксиди хлору
Хлор утворює ряд оксидів (табл.\(\PageIndex{2}\)), в яких хлор має формальні ступені окислення +1, +4, +6 і +7. Фізичні властивості оксидів зведені в табл\(\PageIndex{2}\). Хоча оксиди хлору не дуже стабільні (насправді деякі з них чутливі до ударів і схильні до вибуху), кон'югатні оксикислоти стабільні.
| З'єднання | Мп (°C) | Ап (°C) |
|---|---|---|
| Сл 2 О | -116 | 4 |
| КЛО 2 | -5.9 | 10 |
| Сл 2 О 4 | -117 | 44.5 |
| Сл 2 О 6 | 3.5 | нестабільний |
| Сл 2 О 7 | -91.5 | 82 |
Монооксид дихлору (Cl 2 O, рис.\(\PageIndex{4}\) А) - жовтувато-червоний газ, який отримують реакцією хлору з оксидом ртуті, (10.3.4), або з розчином хлору в CCL 4.
\[ \rm 2 Cl_2 + 2 HgO \rightarrow HgCl_2 \cdot HgO + Cl_2O\]

При нагріванні або схилі до іскри Cl 2 O вибухає до Cl 2 і O 2. Монооксид дихлору вступає в реакцію з водою з утворенням оранжево-жовтого розчину хлорноватистої кислоти, (10.3.5).
\[ \rm H_2O_{(g)} + Cl_2O_{(g)} \rightleftharpoons 2 HOCl_{(g)} \]
Діоксид хлору (ClO 2) є жовтуватим газом при кімнатній температурі і зазвичай використовується в промисловості як окислювач. Найкращий синтез ClO 2 передбачає відновлення хлорату калію (KClO 3) щавлевою кислотою при 90 °С, оскільки утворений СО 2 діє як розріджувач для сильно вибухонебезпечного ClO 2. У промислових масштабах ClO 2 проводиться екзотермічною реакцією хлорату натрію з SO 2 в сірчаній кислоті, (10.3.6). Фотоліз ClO 2 дає темно-коричневе тверде тіло за формулою Cl 2 O 3; однак його легке вибухове розкладання виключає дослідження.
\[ \rm 2 NaClO_3 + SO_2 + H_2SO_4 \rightarrow 2 ClO_2 + 2 NaHSO_4\]
Структура ClO 2 (рис.\(\PageIndex{4}\) b) еквівалентна SO 2 з одним додатковим електроном, в результаті чого утворюється парамагнітний непарний вид електронів. Незвично, незважаючи на непарну електронну конфігурацію, ClO 2 не проявляє тенденції до димеризації. Це на відміну від аналогічної молекули NO 2.
Тетраоксид дихлору (Cl 2 O 4) прийнято називати перхлоратом хлору як наслідок його структури (рис.\(\PageIndex{4}\) с). Гексаоксид дихлору (Cl 2 O 6) - нестійке червоне масло, яке має іонну структуру в твердому стані: [ClO 2] + [ClO 4] -.
Гептоксид дихлору (Cl 2 O 7) є відносно стабільною олією, яка готується шляхом зневоднення хлорної кислоти при -10° C, (10.3.7) з подальшою вакуумною дистиляцією. Будову Cl 2 O 7 (рис.\(\PageIndex{4}\) d) визначали за допомогою газової фазової дифракції електронів.
\[ \rm HClO_4 \xrightarrow[-H_2O]{+ P_4O_5} Cl_2O_7\]
Реакція Cl 2 O 7 зі спиртами і амінами дає алкілперхлорати (RoClO 3) і перхлорати аміну (R 2 NClO 3) відповідно.
Фториди хлору
Враховуючи ізоглобальну залежність між галогенами, не дивно, що змішані дигалогени можуть бути отримані, наприклад, ClF, iCl та BrCl. Фторид хлору - це високореактивний газ (Bp = -100.1° C), який є потужним фторуючим агентом і готується окисленням хлору трифторидом хлору (10.3.8).
\[ \rm Cl_2 + ClF_3 \rightarrow 3 ClF\]
Більш висока електронегативність фтору в порівнянні з хлором (табл.\(\PageIndex{1}\)), і здатність хлору утворювати більше одного зв'язку означає, що відомі також більш високі фториди хлору, тобто ClF 3 і ClF 5. Трифторид хлору (CF 3, Bp = 11,75° C) є корисним фторуючим агентом, який отримують високотемпературною реакцією елементарного хлору та фтору, є корисним фторуючим віком. Газоподібний пентафторид (ClF 5, Bp = -31,1° C) отримують реакцією хлориду калію з фтором (10.3.10).
\[ \rm Cl_2 + 3 F_2 \xrightarrow{200 °C} 2 ClF_3\]
\[ \rm KCl + 3 F_2 \xrightarrow{200 °C} ClF_5 + KF\]
Структура ClF 3 має Т-подібну форму з двома одинокими парами на хлорі (рис.\(\PageIndex{5}\) А), тоді як структура ClF 5 - квадратна пірамідальна з однією самотньою парою на хлор (рис.\(\PageIndex{5}\) b).
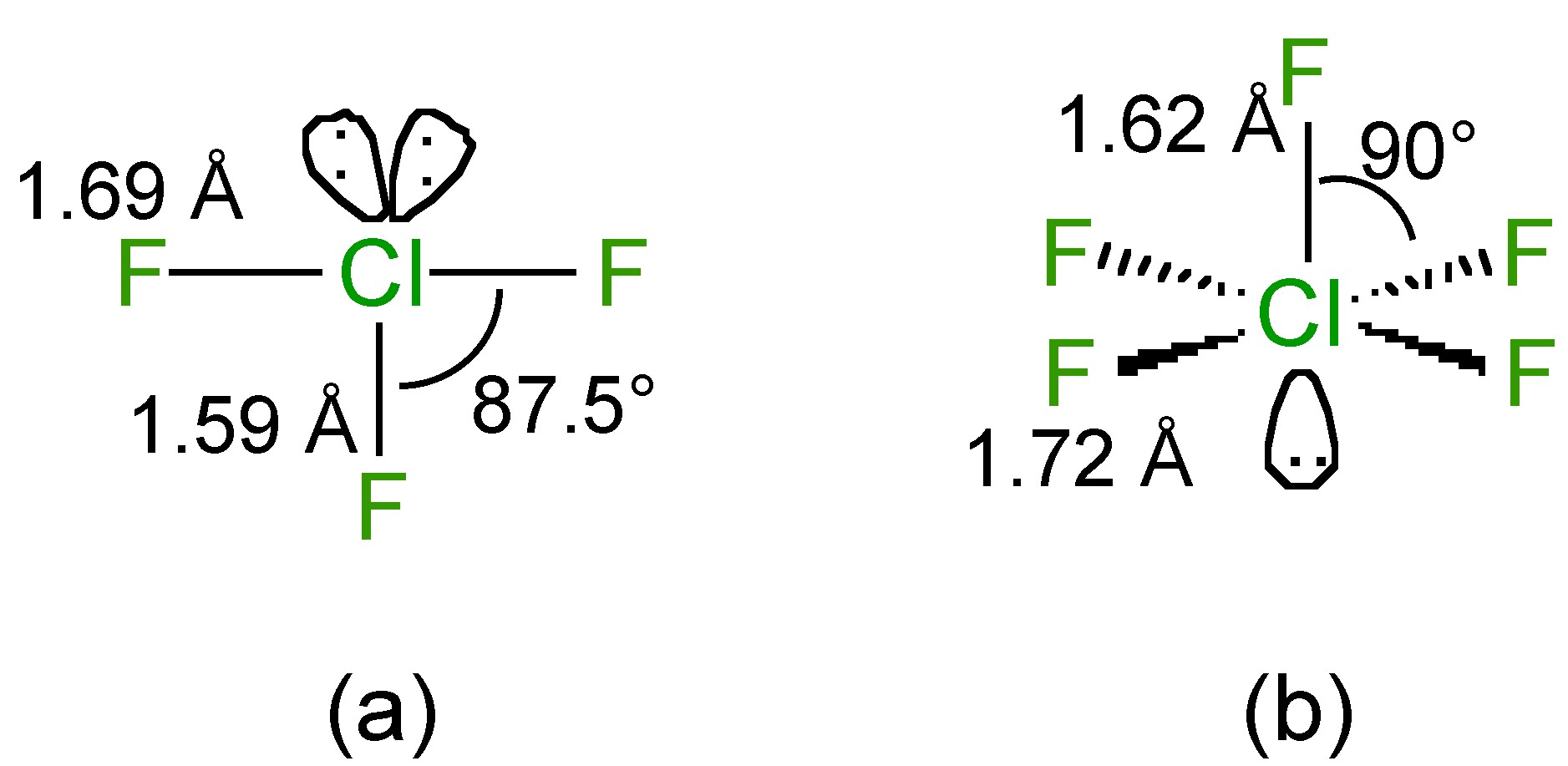
Взагалі галогенфториди дуже реактивні; вибухові реакції відбуваються з органічними сполуками. Всі вони є потужними фторующими агентами при розведенні азотом, і порядок реакційної здатності наступний:
\[ \rm ClF_3 > BrF_3 > BrF_5 > IF_7 > ClF > IF_5 > BrF\]
Як і більшість галогенфторидів, CLF, ClF 3 і ClF 5 реагують з сильними основами (наприклад, фториди лужних металів) з утворенням аніонів (10.3.12) і (10.3.13), а також сильних кислот (наприклад, AsF 5 і SbF 5) з утворенням катіонів (10.3.14), (10.3.15) та (10.3.16).
\[ \rm ClF + CsF \rightarro Cs^+ + ClF_2^-\]
\[ \rm ClF_3 + CsF \rightarrow Cs^+ + ClF_4^- \]
\[ \rm 2 ClF + AsF_5 \rightarrow FCl_2^+ + AsF_6^-\]
\[ \rm ClF_3 + AsF_5 \rightarrow ClF_2^+ + AsF_6^-\]
\[ \rm ClF_5 + SbF_5 \rightarrow ClF_4^+ + SbF_6^-\]
