10.2: сполуки фтору
- Page ID
- 17609
Елементарний фтор (F 2) є найбільш реактивним елементом. Фтор з'єднується безпосередньо з усіма іншими елементами, крім азоту і більш легких благородних газів. Він також реагує з багатьма сполуками, що утворюють фториди, і багато органічних сполук запалюються і згоряють в газі. Високореактивний характер обумовлений слабкою F-F зв'язком (термодинамічно нестабільною), яка забезпечує низьку енергію активації реакцій (кінетично нестабільну). ΔG для реакцій часто великий через міцність одержуваних X-F зв'язків. Слабкий зв'язок F-F (158 кДж/моль) обумовлений малим розміром (0,5 Å) та високим ядерним зарядом фтору, що призводить до невеликого перекриття орбіталів зв'язку та відштовхування між незв'язними орбіталями (одинокими парами) на двох атомах фтору.
Іонні солі
Легкість утворення F - аніона обумовлена високою електронною спорідненістю фтору (-322 кДж/моль). Оскільки іон фтору невеликий (1,33 Å) і найменш поляризуваний аніон (тобто твердий), він стабільний в іонних решітках з катіонами металів у високому ступені окислення (високий заряд), наприклад, MnF 4 і CrF 5. Взагалі найвищі ступені окислення для будь-якого металу виявляються з солями фтору. Великі енергії іонізації, необхідні для отримання катіонів, відновлюються високими енергіями решітки.
ковалентні сполуки
Висока електронегативність фтору означає, що він утворює полярний зв'язок однієї електронної пари з високим іонним характером. Полярний характер зв'язку означає, що всередині молекули існує великий індуктивний ефект. Наприклад, перфторетанол (CF 3 CF 2 OH) має кислотність, порівнянну з оцтовою кислотою.
Висока міцність X-F зв'язків (Таблиця\(\PageIndex{1}\)) також обумовлена високим іонним характером (до 50%), що призводить до високої енергії активації для розриву зв'язків. На відміну від цього, низька поляризуваність фтору означає, що міжмолекулярні зв'язки ван дер Ваальса дуже слабкі. Таким чином, навіть при дуже високих молекулярних масах температура кипіння може бути дуже низькою, наприклад, WF 6, Bp = 17° C, Mw = 297,84 г/моль.
| Бонд | Енергія зв'язку (кДж/моль) |
|---|---|
| С-Ф | 486 |
| Н-Ф | 272 |
| Р-Ф | 490 |
Широкий спектр фторидних комплексів може бути отриманий як з металевих (FeF 6, 3-, RuF 6 -, PtF 6, 2- і SnF 6 2-), так і з неметалевих (BF 4 -, SiF 6, 2- і PF 6 -) фториди. Хоча багато фторидів є солями, коли метал знаходиться у вищих ступенях окислення (наприклад, OsF 6 і WF 6), утворення іонної решітки з відповідним катіоном (тобто Os 6+ і W 6+ відповідно) є енергетично несприятливим.
Фтористий водень
Фтористий водень (HF) при контакті з вологою перетворюється в висококорозійну плавикову кислоту. Чистий фтористий водень повинен оброблятися в металевих або поліетиленових посудах, тоді як водні розчини легко травлять і розчиняють стандартний лабораторний посуд зі скла, що вимагає використання фторованих полімерних (наприклад, тефлонових) контейнерів.
Фтористий водень синтезується реакцією фторидної солі з концентрованою кислотою, (10.2.1). Пари ВЧ можуть конденсуватися, а потім очищатися шляхом дистиляції.
\[ \rm CaF_2 + H_2SO_4 \rightarrow CaSO_4 + 2 HF \uparrow \]
H-F зв'язок у фториду водню включає електронно-парний зв'язок з високим ступенем іонного характеру. Це призводить до дуже полярного зв'язку H-F та великого дипольного моменту (1,86 D).
У паровій фазі фтористий водень мономерний вище 80° C, але при більш низьких температурах він асоціюється в олігомери і дрібні полімери, наприклад, циклічні (HF) 6, як наслідок сильних міжмолекулярних водневих зв'язків. Як чиста рідина (Mp = -83° C, Bp = 19,5° C) фторид водню широко асоціюється сильним водневим зв'язком з утворенням зигзагоподібних полімерів (рис.\(\PageIndex{1}\)).

Фтористий водень має високу діелектричну проникність (84,2) і як такий є хорошим розчинником для полярних молекул. Однак це не хороший розчинник для солей (навіть фторидів), оскільки він не надто добре сольватує катіони. Незважаючи на це, він корисний як розчинник, оскільки він не окислюється і легко випаровується з продуктів.
Подібно до води, фтористий водень самоіонізується, (10.2.2). Відомі солі H 2 F +, а F- аніон додатково розчиняється HF з утворенням ряду солей, (10.2.3). Комплекс аніон HF 2 - утворюється також у водних розчині фтористого водню (рК = 0,7).
\[ \rm 2 HF \rightleftharpoons H_2F^+ + F^-\]
\[ \rm F^- + \text{n HF} \rightleftharpoons HF_2^- + H_2F_3^- + H_3F_4^- \text{ etc.}\]
Фтористий водень насправді є слабкою кислотою у водному розчині з низьким рК = 3,5. По суті, HF є більш слабкою кислотою, ніж інші галогенні аналоги:
\[ \rm HF<HCl<HBr<HI\]
Ця тенденція незважаючи на те, що фтор є більш електронегативним, ніж інші галогени, але відповідає міцності зв'язку H-F (568 кДж/моль).
Фтористий водень використовується як неокислювальна кислота для гідролізу білків і каталізованої кислотою реакції конденсації. Стабільність його солі (HF 2 -) дозволяють проводити дослідження дуже сильних кислот, (10,2,5) і (10.2.6).
\[ \rm 2 HF + R_2\text{C=O} \rightarrow R_2\text{C=OH}^+ + HF^+_2\]
\[ \rm 2 HF + H_2O \rightarrow H_3O^+ + HF_2^-\]
Кислотність HF може бути достатньо збільшена додаванням фтористого акцептора (наприклад, SbF 5) для полегшення реакції зі слабкою основою, такою як бензол, (10.2.7).
\[ \rm C_6H_6 + HF + SbF_5 \rightarrow C_6H_7^+ + SbF_6^-\]
Нарешті, фтористий водень може бути використаний в синтезі інших фторсодержащих сполук:
\[ \rm 6 HF + KCl + PCl_5 \rightarrow K[PF_6] + 6 HCl \uparrow\]

Органічні сполуки фтору
Органічні сполуки, в яких частина або всі атоми водню замінені фтором, мають унікальні (і часто важливі) властивості. Висока стабільність фторуглеродних сполук є наслідком енергії зв'язку C-F (486 кДж/моль) порівняно з енергією C-H (415 кДж/моль); однак, хоча і кінетично стабільні, фторуглероди не обов'язково особливо термодинамічно стабільні.
Заміна водню фтором призводить до підвищеної щільності; оскільки малий розмір фтору означає, що в результаті заміщення відбувається мінімальне спотворення або структурні зміни. Як і у випадку з солями металів, слабкі міжмолекулярні сили означають, що повністю фторовані органічні сполуки мають низькі температури кипіння. Одним з атрибутів низьких міжмолекулярних сил є низький коефіцієнт тертя для фторполімерів, таких як політетрафторетилен, широко відомий як тефлон (рис.\(\PageIndex{2}\)).
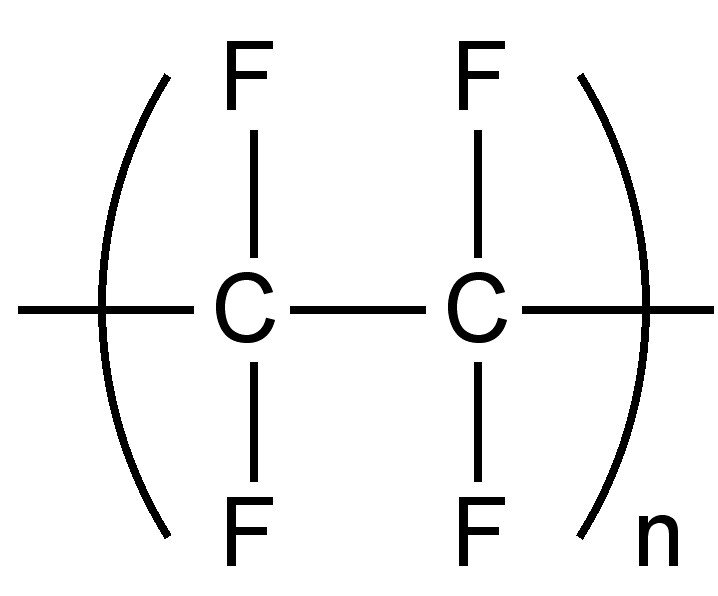
Синтетичні шляхи до фторуглеродних
Найпростіший шлях до фторуглеродних з'єднань передбачає пряму заміну іншого галогену на фторид металу, (10.2.9). Рушійна сила цієї реакції залежить від різниці вільних енергій MF і MCl, яка пов'язана з різницею енергій решітки. Таким чином, чим більше катіон металу, тим більше сприятлива реакція. У зв'язку з цим AgF і CSF є найбільш ефективним засобом фторування.
\[ \rm \text{R-Cl} + MF \rightleftharpoons \text{R-F} + MCl\]
Безводний фтористий водень (HF) вступає в реакцію з хлоровуглецевими сполуками в присутності такого каталізатора, як SbCl 5 або CrF 4, (10.2.10). Однак потрібні підвищені температури (50 - 150° C) і високий тиск (50 - 500 фунтів на квадратний дюйм).
\[ \rm 2 CCl_4 + 3 HF \rightarrow CCl_2F_2 + CCl_3F + 3 HCl \]
Безпосередня заміна водню фтором можлива, якщо реакція проводиться в розведених умовах в присутності каталізатора, (10.2.11).
\[ \rm C_6H_6 + 9 F_2 \xrightarrow{Cu} C_6F_{12} + 6 HF\]
Тетрафторид сірки (SF 4) є особливо селективним агентом фторування. Він може бути використаний для перетворення кетонів в дифторсполуки, (10.2.12).
\[ \rm 2 R_2\text{C=O} + SF_4 \rightarrow R_2CF_2 + SO_2 \]
