6.6: Реакції комплексів
- Page ID
- 20339
Реакції комплексів класифікуються на реакцію заміщення лігандів, реакцію перетворення лігандів та окисно-відновну реакцію центрального металу. Зокрема, були детально вивчені реакції заміщення та окислювально-відновного впливу.
(а) Реакція заміщення лігандів
Реакції заміщення лігандів комплексів
\[L_{n} MX + Y \rightarrow L_{n} MY + X\]
дуже важливі для приготування різного роду похідних. Детально вивчено умови, які виконують комплекси та ліганди, щоб зрозуміти їх стереохімію та досягти практичних темпів реакцій заміщення. Як і в інших видах хімічних реакцій, нам потрібно розуміння як рівноваги, так і швидкості реакції.
константа формування
Константа рівноваги реакції заміщення лігандів називається постійною освіти або стабільності. Поняття і метод обчислення послідовних констант формування були запропоновані Н.Бьеррумом (1941 р.). Константи рівноваги для заміни гідратованого іона М іншими лігандами L у водному розчині є
| $M + L\ стрілка вправо ML\ квадратний\ квадрат K_ {1} =\ frac {[ML]} {[M] [L]} $$ |
| $ML + L\ стрілка вправо ML_ {2}\ квадратний\ квадрат K_ {2} =\ frac {[ML_ {2}]} {[ML] [L]} $$ |
| $ML_ {2} + L\ стрілка вправо ML_ {3}\ квадратний\ квадрат K_ {3} =\ frac {[ML_ {3}]} {[ML_ {2}] [L]} $$ |
| ... |
| $ML_ {n-1} + L\ стрілка вправо ML_ {n}\ квадрад K_ {n} =\ frac {[ML_ {n}]} {[ML_ {n-1}] [L]} $$ |
і загальна константа\(beta_{n}\) формування
\[\beta_{n} = \frac{[ML_{n}]}{[M][L]^{n}} = K_{1}K_{2}K_{3} \cdots K_{n}\]
Термодинамічна стабільність продукту заміщення стає більшою зі збільшенням константи формування.
З іншого боку, розуміння впливу ліганду, що залишає, X та ліганду, що входить, Y, на швидкість заміщення та на сформовані проміжні види мають важливе значення для з'ясування хімії реакцій металевих комплексів. Особливо корисно узагальнити електронну структуру центральних металів, стереохімію комплексів та кореляцію між параметрами, що представляють їх стеричні властивості, та швидкістю реакції. Як правило, механізми реакції можна класифікувати на асоціативні, взаємообмінні та дисоціативні механізми відповідно до відмінностей у проміжному стані (рис.\(\PageIndex{26}\)).
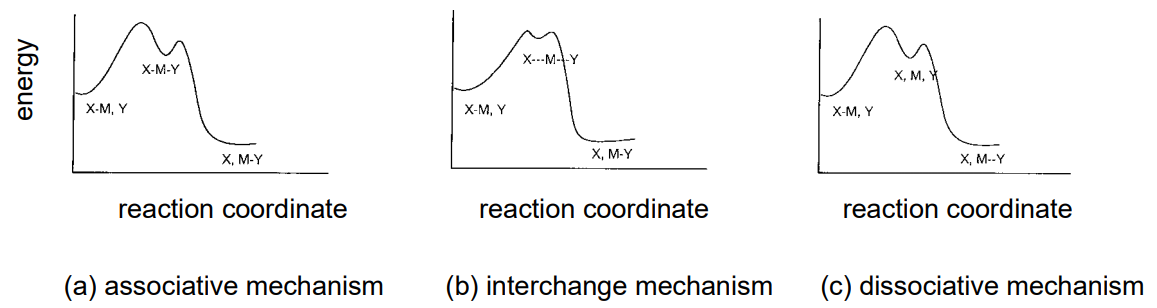
асоціативний механізм
Якщо швидкість заміщення ліганду заміщення комплексу залежить від вхідного ліганду, Y, координуючого з центральним металом і нечутлива до ліганду, що йде, X, передбачається прийняти асоціативний механізм, який збільшує координаційне число. Така реакція заміщення часто спостерігається в плоских тетракоординатних комплексах Pt (II), а проміжні види - трикутні біпірамідні пента-координатні комплекси. Реакція першого порядку по відношенню як до тетра-координатного комплексу, так і до Y, і є другим порядком в цілому. Оскільки вона супроводжується зменшенням молекулярних видів на проміжній стадії, термодинамічні вимірювання реакції вказують на негативну активаційну ентропію,\(Delta\) S. Проміжним видом у випадку асоціативного механізму в гексакоординатних комплексах є гептакоординатні комплекси.
механізм розв'язки
Коли життя проміжного стану дуже коротка, реакція протікає обмінним механізмом, так як узгодження Y і усунення X вважаються відбуваються одночасно.
дисоціативний механізм
Реакція заміщення, яка є високочутливою до ідентичності залишає ліганду X і практично нечутлива до ідентичності входить ліганду Y, передбачає дисоціативний механізм, при якому координаційне число зменшується в проміжному стані. Це часто спостерігається в октаедричних гексакоординатних комплексах, а проміжними станами є п'ятикоординатні комплекси, які утворюються при ліквідації X. Оскільки елімінація супроводжується збільшенням молекулярних видів на проміжній стадії, ентропія активації,\(\Delta\) S, стає позитивною.
Вправа\(\PageIndex{6}\)
Порядок швидкості лігандного заміщення комплексів Pt (II) становить H 2 O < Cl - < I - < PR 3 < CN - для введення лігандів. Який механізм, асоціативний або дисоціативний, приймають заміни?
- Відповідь
-
Так як вони залежать від входять лігандів, то асоціативний механізм більш імовірний.
Транс ефект
У квадратно-плоских тетракоординатних комплексах, як правило, Pt (II), ліганд транс до ліганду X регулює швидкість заміщення. Це називається транс-ефектом. Швидкість заміщення збільшується у міру збільшення донорської або π акцепторної здатності транс-ліганду в порядку NH 3 < Cl - < Br - < I - < NCS - < PR 3 < CN - < CO. Аналогічний ефект може спостерігатися і в восьмигранних гексакоординатних комплексах, хоча ефект зазвичай відносно невеликий.
Курс H 2 O в аква-іоні
Інертні, проміжні та лабільні - класифікація обмінного курсу, запропонована Н. Таубе (1952). Швидкість обміну аква-іонів (іонів, координованих молекулами води) основних груп і перехідних металів значно відрізняється залежно від ідентичності виду металу. Так як курс обміну водних лігандів добре корелює зкурсами обміну інших лігандів, він корисний для загального порівняння курсів валют в комплексах різних іонів металів. Для лужних і лужноземельних металів обмінні курси дуже високі (10 5 - 10 9 с -1), а комплекси цих металів відносять до лабільних. Оскільки в цих випадках зазвичай зустрічається дисоціативний механізм, іони з меншою іонічністю і більшого розміру менше притягують водні ліганди, і їх обмінні курси стають вищими. У групі 12 іонів металів Zn 2 +, Cd 2+, Hg 2 +, групи 13 іонів металів Al 3 +, Ga 3+, In 3 + і 3 групи іонів металів Sc 3 +, Y 3+, швидка вода обмін лігандів відбувається за дисоціативним механізмом.
З іншого боку, обмінні курси іонів M (II) в d блоці іонів перехідних металів є середнім (10 - 10 4 с -1), а іони M (III) все ще нижчі. Швидкості d 3 Cr 3 + і d 6 Co 3+ помітно повільні (10 -1 - 10 -9 с -1), а їх комплекси називаються інертними. Було проведено велике вивчення ліганд-обмінних реакцій. Курси валют менші, чим більша енергія стабілізації поля ліганду. Тому ліганд-обмінні курси 4d і 5d комплексів перехідних металів, як правило, повільні.
Експерименти з пробіркою
Легкі хімічні або біологічні реакції, що виконуються в пробірках, іноді називають експериментами з пробірками. Розчини в пробірках змішують при кімнатній температурі на повітрі і суміш струшують, щоб спостерігати зміну кольору або утворення опадів і спекулюють результати реакцій. Викладачі університетів іноді намагаються подібні експерименти. Хоча ці прості експерименти показують лише ефекти поглинання видимого світла та розчинності. Однак, оскільки з таких експериментів можуть народитися навіть великі відкриття, відкидати їх не варто.
Таубе писав, що знайшов натяк на внутрішньосферний механізм перенесення електронів від експериментів з пробірками. Він змішав Cr 2 + (aq) і I 2 в пробірці, щоб уточнити окислення Cr 2 + (aq) і спостерігав зміну кольору на ту, що характерна [Cr (H 2 O) 6] 3+ через зелений. Зелений колір обумовлений [(H 2 O) 5 CrI] 2+, який нестійкий і змінюється на [Cr (H 2 O) 6] 3+ I -. Він припустив, що це було пов'язано з утворенням зв'язку Cr-I до окислення Cr (II) I 2. Згодом він провів інший експеримент з пробіркою, використовуючи [(NH 3) 5 CoCl] 2+ як окислювач і виявив, що Cr 2 + (aq) був перетворений в [Cr (H 2 O) 6] 3+ через зелений [(H 2 O) 5 CrCl] 2+. Ця реакція встановила внутрішньосферний механізм перенесення електронів, при якому міст Co-Cl-Cr утворюється між Co 3 + і Cr 2 + і призвела до Нобелівської премії в більш пізньому році.
(б) Окислювально-відновні реакції
Число окислення центрального металу в з'єднанні перехідного металу може змінюватися в кілька кроків від низького до високого. А саме, ступінь окислення сполуки змінюється окислювально-відновними реакціями. Внаслідок цього змінюється відстань зв'язку і кут зв'язку між металом і координуючими елементами або між металами, і часом вся структура комплексу може бути перекручена чудово або з'єднання може навіть розкладатися.
Реакції з'єднання металу з різними відновниками або окислювачами також дуже важливі з точки зору синтетичної хімії. Особливо реакції відновлення використовуються при отриманні металоорганічних сполук, таких як карбоніли металів або кластерні сполуки.
Тим часом розвинулося дослідження перенесення електронів між комплексами, особливо окислювально-відновних реакцій комплексів перехідних металів. Таубе отримав Нобелівську премію (1983) за дослідження реакцій перенесення електронів в комплексах перехідних металів, класифікуючи такі реакції на два механізми. Механізм перенесення електронів, при якому мостовий ліганд ділиться між двома металами, називається внутрішньосферним механізмом, а той, що передбачає пряме перенесення електронів між двома металами без мостового ліганду, називається зовнішньосферним механізмом.
Внутрішньосферний механізм
Коли [CoCl (NH 3) 5] 2+ знижується на [Cr (OH 2) 6] 2+, утворюється проміжний комплекс [(NH 3) 5 Co-Cl-Cr (OH 2) 5] 4+, в якому атом хлору утворює міст між кобальт і хром. В результаті перенесення електронів з хрому в кобальт через хлор, [Co (NH 3) 5 Cl] +, при якому кобальт відновлюється з тривалентного до двовалентного стану окислення і [Cr (OH 2) 6] 3+, в якому хром окислюється з двовалентні до тривалентного ступеня окислення, утворюються. Цей вид реакції є окислювально-відновною реакцією через внутрішньосферний механізм. Аніонами, відмінними від галогенів, придатними для такого мостоутворення, є SCN -, N 3 -, CN - тощо.
Зовнішня сфера механізм
Коли [Fe (phen) 3] 3+ (фен ортофенантролін) зменшується на [Fe (CN) 6] 4-, між металами не утворюється лігандного моста, і електрон рухається від HOMO Fe (II) до LUMO Fe (III) в дуже короткому і прямому контакті між двома комплексами. В результаті перенесення електронів утворюються [Fe (phen) 3] 2+ і [Fe (CN) 6] 3-. Цей вид реакції є окислювально-відновною реакцією за допомогою зовнішньосферного механізму і характерний для складної системи, яка має дуже повільну швидкість заміщення лігандів порівняно зі швидкістю перенесення електронів, особливо в системах, які мають однакові ліганди, але різні окислювальні числа, наприклад, [Fe (CN) 6] 3- - [Fe (CN) 6] 4- має високу швидкість перенесення електронів. Маркус отримав Нобелівську премію (1992) за вивчення цього механізму перенесення електронів у зовнішню сферу.
проблеми
6.1
Яку порожнину, або восьмигранну, або чотиригранну, в масиві атомів кисню іони Fe 2 +, як правило, займають в оксиді заліза Fe 3 O 4, що містить як іони Fe 2 +, так і Fe 3 +?
6.2
Охарактеризуйте спосіб отримання транс - [PtCl (Et) (PET 3) 2].
6.3
Запропоновано мононуклеарні та двоядерні комплекси металів, що містять циклопентадієніл і карбонільні ліганди, які задовольняють 18-електронному правилу.
6.4
Розробити метод селективних синтезів цис - [PtCl 2 (NH 3) 2] і транс - [PtCl 2 (NH 3) 2] з використанням транс-ефекту.
6.5
Як можна довести, що реакція відновлення [CoCl (NH 3) 5] 2+ на [Cr (OH2) 6] 2+ протікає внутрішньосферним механізмом перенесення електронів?