6.1: Конструкції металокомплексів
- Page ID
- 20324
Перехідні елементи - це металеві елементи, які мають неповні d або f оболонки в нейтральному або катіонному станах. Вони називаються також перехідними металами і складають 56 з 103 елементів. Ці перехідні метали класифікуються на d-блокові метали, які складаються з 3d елементів від Sc до Cu, елементів 4d від Y до Ag та 5d елементів від Hf до Au, і f-блокових металів, які складаються з лантаноїдних елементів від La до Lu та актиноїдних елементів від Ac до Lr. Хоча Sc і Y належать до d-блоку, їх властивості схожі з властивостями лантаноїдів. Хімія d-block і f-block елементів значно відрізняється. У цьому розділі описані властивості та хімія переважно d-блокових перехідних металів.
Центральні метали
Властивості d-блокових перехідних металів значно відрізняються між металами першого (3d) та другого ряду (4d), хоча відмінності у властивостях металів другого та третього ряду (5d) не виражені. Металеві радіуси елементів від скандію, Sc, до міді, Cu, (166 до 128pm) значно менші, ніж у ітрію, Y, до срібла, Ag, (178 до 144pm) або лантану, La, до золота, Au, (188 до 146pm). Далі сполуки металів першого ряду перехідних металів рідко мають 7 координат, тоді як перехідні метали з другого і третього ряду можуть бути координати від 7 до 9. Церій, Ce, (радіус 182pm) ~ лютецій, Lu, (радіус 175pm) падають між La і Hf, і через скорочення лантаноїдів металеві радіуси перехідних металів другої та третьої рядів виявляють незначні зміни.
Більш високі ступені окислення в перехідних металах другої та третьої серій значно стабільніші, ніж у перехідних металів першої серії. Приклади включають гексахлорид вольфраму, WCl 6, тетроксид осмію, OSO 4 та гексафторид платини, PtF 6. Сполуки перехідних металів першої серії у вищих ступенях окислення є сильними окислювачами і, таким чином, легко відновлюються. З іншого боку, тоді як сполуки M (II) та M (III) поширені серед перехідних металів першої серії, ці стани окислення, як правило, рідкісні у сполуках металів другої та третьої серій. Наприклад, порівняно мало сполук Mo (III) або W (III) порівняно з багатьма Cr (III). Аква-іони (іони з водними лігандами) дуже поширені серед сполук металів першої серії, але мало хто відомий серед сполук другого і третього металів.
Карбонільні кластерні сполуки металів першого ряду перехідних металів з M-M зв'язками в низьких станах окислення існують, але галогенідні або сульфідні кластерні сполуки зустрічаються рідко. Взагалі зв'язки метал-метал утворюються набагато легше в 4d і 5d металах, ніж в 3d. Магнітні моменти сполук перехідних металів першого ряду можна пояснити термінами спінових значень (див. главу 6.2 (d)), але важко врахувати магнітні моменти сполук другого і третього рядів, якщо не враховані складні фактори, такі як спін-орбітальні взаємодії.
Таким чином, необхідно визнати і розуміти істотні відмінності в хімічних властивостях, які існують між металами сполук металів першої і більш пізньої серій, навіть для елементів однієї групи.
Властивості d-блокових перехідних металів відрізняються не тільки у верхньому і нижньому положеннях в таблиці Менделєєва, але і в лівій і правій групах. У групі 3 до 5 металів в даний час часто називають ранні перехідні метали, і вони, як правило, оксофільні і галофільні. Менші числа d електронів і твердість цих елементів пояснюють їх спорідненість до твердого кисню і галогенів. При відсутності мостових лігандів утворення зв'язків метал-метал ускладнюється для цих елементів. Відомо, що металоорганічні сполуки цих металів активно активують C-H зв'язки у вуглеводнях. Пізні перехідні метали в групах праворуч від таблиці Менделєєва м'які і мають високу спорідненість до сірки або селену.
Перехідні метали d-блоку мають s, p та d орбіталі, а ті, у яких n електронів на орбіталах d, називаються іонами з конфігурацією dn. Наприклад, Ti 3+ - це іон d 1, а Co 3 + a d 6 іон. Кількість електронів, що займають орбіталі, розділених лігандним полем (пор. 6.2 (а)), позначається надіндексом на орбітальному символі. Наприклад, іон з 3 електронами в t 2g і 2 електронами в e g описується як t 2g 3 e g 1.
Ліганди
З'єднання іонів металів, координовані лігандами, відносять до металевих комплексів. Більшість лігандів є нейтральними або аніонними речовинами, але відомі також катіонні, такі як катіон тропілію. Нейтральні ліганди, такі як аміак, NH 3 або окис вуглецю, СО, є незалежно стабільними молекулами у вільному стані, тоді як аніонні ліганди, такі як Cl - або C 5 H 5 -, стабілізуються лише тоді, коли вони узгоджені з центральними металами. Представницькі ліганди перераховані в табл\(\PageIndex{1}\) відповідно до лігуючих елементів. Поширені ліганди або ті, що мають складну хімічну формулу, виражаються в скорочених формах.
Ті ліганди з одним лігуючим атомом називаються монодентатними лігандами, а ті, що мають більше одного лігуючих атомів, називають полідентатними лігандами, які також називаються хелатними лігандами. Кількість атомів, пов'язаних з центральним металом, є координаційним числом.
| Ім'я | Абревіатура | Формула |
|---|---|---|
| гідридо | Н - | |
| карбоніл | КО | |
| ціано-блакитний | CN - | |
| метил | Мене | СН 3 - |
| циклопентадієніл | Cp | З 5 Н 5 - |
| карбонато | СО 3 2- | |
| аміачний | NH 3 | |
| піридин | Ру | С 5 Ч 5 Н |
| біпіридин | біпі | С 10 Ч 8 Н 2 |
| трифенілфосфін | рН 3 | П (С 6 Ч 5) 3 |
| аква | aq | Н 2 О |
| ацетилацетонато | асак | СН 3 С (О) СН 2 С (О) СН 3 - |
| тіоціанато | СКН - | |
| хлор | Кл - | |
| етилендіамінтетрацетат | едта | (ООЧ 2) 2 ДЮЙМ 2 СН 2 Н (СН 2 СОО) 2 4- |
Координаційний номер і структури
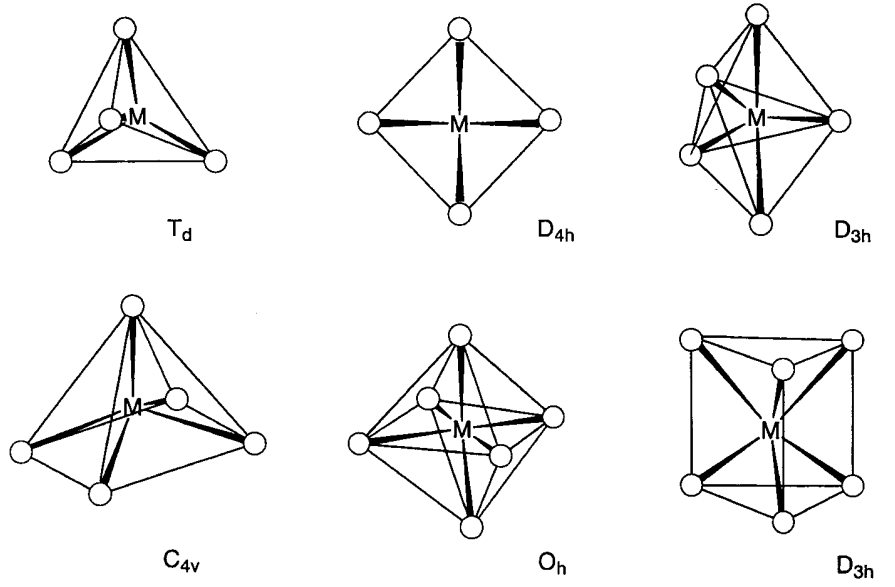
Молекулярні сполуки, які складаються з d-блокових перехідних металів і лігандів, називаються комплексами або координаційними сполуками. Координаційне число визначається розмірами центрального металу, кількістю d електронів, або стеричними ефектами, що виникають від лігандів. Відомі комплекси з координаційними числами між 2 і 9. Зокрема координації від 4 до 6 найбільш стійкі в електронному і геометричному відношенні і комплекси з цими координаційними номерами найбільш численні (рис.\(\PageIndex{1}\)). Комплекси з відповідними координаційними номерами описані нижче.
Два координатних комплекси
Багато багаті електронами іони d 10, а саме: Cu +, Ag + і Au +, утворюють лінійні комплекси, такі як [Cl-Ag-Cl] - або [H 3 N-Au-NH 3] -. Відомий також нульово-валентний комплекс [Pd (pCy 3) 2] з дуже об'ємними трициклогексилфосфіновими лігандами. Як правило, стабільні 2-координатні комплекси відомі для пізніх перехідних металів.
Три координатні комплекси
Хоча [Fe {N (SiMe 3) 3} 3] є одним із прикладів, відомо дуже мало 3-х координатних комплексів.
Чотири координатні комплекси
Коли чотири ліганди координуються з металом, чотиригранна (T d) координація є найменш перевантаженою геометрією, хоча відомо ряд квадратних плоских (D 4h) комплексів. [CoBr 4] 2-, Ni (CO) 4, [Cu (py) 4] +, [AuCl 4] - всі приклади тетраедричних комплексів. Є кілька відомих прикладів квадратних плоских комплексів з однаковими лігандами, наприклад [Ni (CN) 4] 2-, або [pdCl 4] 2-. У випадку змішаних лігандних комплексів повідомлялося про ряд квадратних плоских комплексів іонів d 8, Rh +, Ir +, Pd 2+, Pt 2 + та Au 3 +. Приклади включають [rHCl (PmE 3) 3], [IrCl (CO) (PMe 3) 2], [NiCl 2 (PET 3) 2] та [PTCl 2 (NH 3) 2] (Et = C 2 H 5).
Cis і транс-геометричні ізомери можливі для комплексів з двома різними видами лігандів, і вперше були відзначені, коли А.Вернер синтезував 4-координатний [PtCl 2 (NH 3) 2]. Оскільки чотиригранні комплекси не дають геометричних ізомерів, Вернер зміг зробити висновок, що його 4-координатні комплекси були квадратними площинними. Останнім часом для лікування пухлин використовується цис - [PtCl 2 (NH 3) 2] (Цисплатин) і примітно, що активний тільки цис-ізомер.
Вправа\(\PageIndex{1}\)
Напишіть формальну назву цис - [PtCl 2 (NH 3) 2].
- Відповідь
-
cis - діамміндіхлорплатина
П'ять координатних комплексів
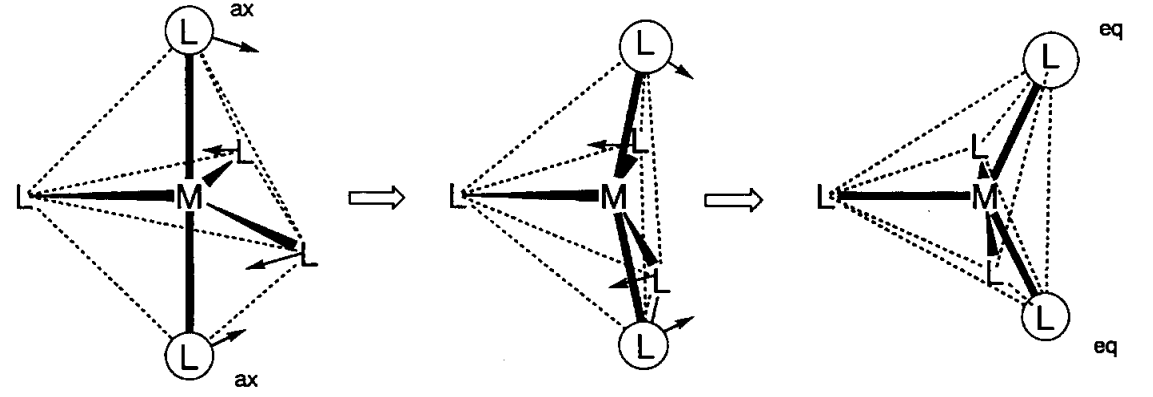
Тригональна біпірамідна (D 3h) Fe (CO) 5 або квадратна піраміда (C 4v) VO (OH 2) 4 є прикладами 5-координатних комплексів. Раніше 5-координатні комплекси були рідкісними, але кількість нових комплексів з такою координацією збільшується. Різниця енергій між двома режимами координації невелика, і структурне перетворення легко відбувається. Наприклад, молекулярна структура та інфрачервоний спектр Fe (CO) 5 узгоджуються з тригональною біпірамідною структурою, але спектр ЯМР 13 С показує лише один сигнал при можливій найнижчій температурі, що вказує на те, що осьові та екваторіальні карбонільні ліганди є флюксіональними в шкала часу ЯМР (10 -1 ~ 10 -9 с). Структурна трансформація відбувається за допомогою квадратної структури піраміди, і механізм добре відомий як псевдоротація Беррі.
Шість комплексів координат
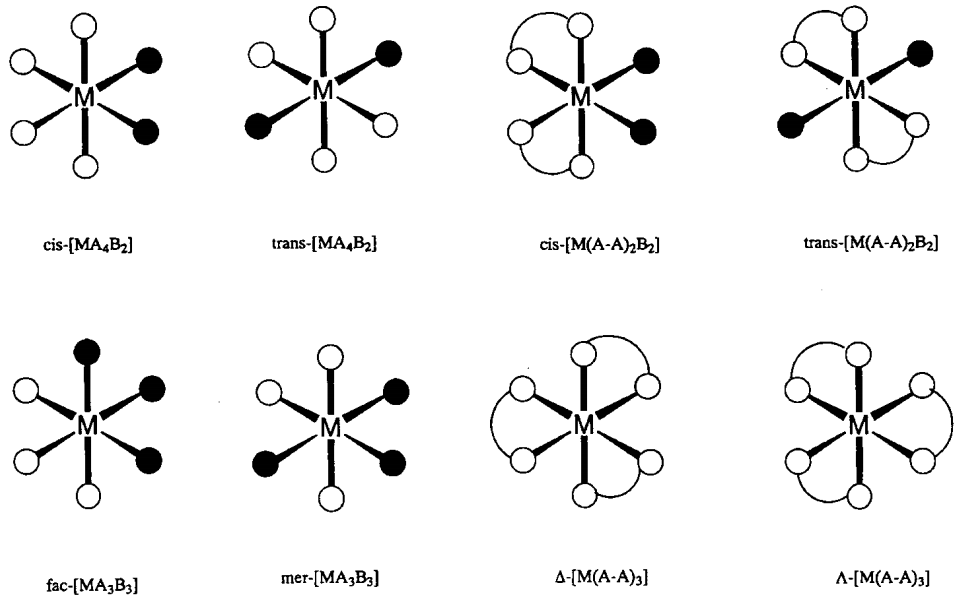
Коли шість лігандів координуються з центральним металом, октаедрична (O h) координація є найбільш стійкою геометрією і більшість таких комплексів припускають цю будову. Зокрема, існує ряд комплексів Cr 3 + та Co 3 +, інертних до реакцій обміну лігандів, представлених [Cr (NH 3) 6] 3+ або [Co (NH 3) 6] 3+. Вони були особливо важливими в історії розвитку координаційної хімії. [Mo (CO) 6], [rHCl 6] 3- і т.д. також є октаедричними комплексами. У випадку змішаних лігандів цис - і транс - [MA 4 B 2] і mer - і fac - [MA 3 B 3] геометричні ізомери, а для хелатних лігандів\(\Delta\) - [M (A-A) 3] і\(\Lambda\) - [M (A-A) 3] можливі оптичні ізомери (рис.\(\PageIndex{3}\)). Октаедрична структура показує тетрагональні (D 4h), ромбічні (D 2h) або тригональні (D 3h) спотворення, викликані електронними або стеричними ефектами. Тетрагональне спотворення [Cu (NH 3) 6] 2+ електронним фактором є типовим прикладом ефекту Яна-Теллера (див. 6.2 (а)).
Шість лігуючих атомів можуть припускати тригональну координацію призми. Хоча ця координація спостерігається в [Zr (CH 3) 6] 2- або [Re {S 2 C 2 (CF 3) 2} 3], відомо мало металевих комплексів з цією координаційною структурою, оскільки октаедрична координація стерично менш напружена. Незважаючи на це, давно відомо, що режим зв'язку атомів сірки навколо металу є тригональною призмою в твердотільних MoS 2 і WS 2.
Вправа\(\PageIndex{2}\)
Напишіть хімічну формулу діаммінетри калію (ізотіоціанато) хромату (III).
- Відповідь
-
K [Кр (НКС) 4 (NH 3) 2]
Вищі координатні комплекси
Іони металів другого і третього ряду перехідних металів іноді можуть зв'язуватися з більш ніж сімома лігуючими атомами і прикладами є [Mo (CN) 8] 3- або [ReH 9] 2-. У цих випадках менші ліганди сприятливі для зменшення стеричних заторів.