6.3: Електронна структура комплексів (частина 2)
- Page ID
- 20310
Молекулярна орбітальна теорія комплексів перехідного металу
Характеристики перехідних метал-лігандних зв'язків стають зрозумілими при аналізі молекулярних орбіталей 3d металу, координованих шістьма однаковими лігандами в октаедричних комплексах [ML 6]. В результаті взаємодії металу d і лігандних орбіталів утворюються склеювальні, несклеювальні і протисклеювальні складні молекулярні орбіталі.
Як правило, енергетичні рівні лігандних орбіталів нижчі, ніж у металевих орбіталів, що зв'язують орбіталі мають більший лігандний характер, а незв'язкові та антизв'язкові орбіталі мають більше металевого характеру. Процеси формування\(\sigma\) і\(\pi\) молекулярних орбіталей описані поетапно нижче.
\(\sigma\)облігація
По-перше, розглянемо\(\sigma\) зв'язок M-L між взаємодіями металевих орбіталів s, p, d та лігандів, прийнявши положення металу біля початку декартової системи координат і розташувавши ліганди на осях координат. Оскільки\(\sigma\) зв'язок є безвузловим зв'язком уздовж осей зв'язку, метал s орбітальний (a 1g, невироджений), p x, p y, p z орбіталі (t 1u, потрійний вироджений), і d x 2 -y 2, d z 2 орбіталі (е г, подвійно-вироджені) підходять симетрії (+, - знаки) і орбітальних форм з\(\sigma\) орбіталями лігандів (рис.\(\PageIndex{9}\)).
Коли орбіталі лігандів знаходяться\(\sigma_{1}\) і\(\sigma_{2}\) вздовж осі х,\(\sigma_{3}\) і\(\sigma_{4}\) по осі Y, і\(\sigma_{6}\) по\(\sigma_{5}\) осі z на малюнку\(\PageIndex{5}\), шість лігандних атомних орбіталей групуються шляхом складання лінійних комбінацій відповідно до симетрії металевих орбіталей. Тоді орбітальний, щоб відповідати металу a 1g орбітальний є 1g (\(\sigma_{1} + \sigma_{2} + \sigma_{3} + \sigma_{4} + \sigma_{5} + \sigma_{6}\)), той, який підходить до металу t 1u орбіталів t 1u, а той, який підходить до металу e g орбіталів є e g (\(\sigma_{1} + \sigma_{2} - \sigma_{3} - \sigma_{4}, \sigma_{5} + \sigma_{6} − \sigma_{1} - \sigma_{2} - \sigma_{3} - \sigma_{4}\)).\(\sigma_{1} - \sigma_{2}, \sigma_{3} - \sigma_{4}, \sigma_{5} - \sigma_{6}\) Існує зв'язуюча взаємодія між металевими орбіталями e g та орбіталями групи лігандів та утворюються склеювальні та протисклеювальні молекулярні орбіталі. Співвідношення показано на малюнку\(\PageIndex{10}\).
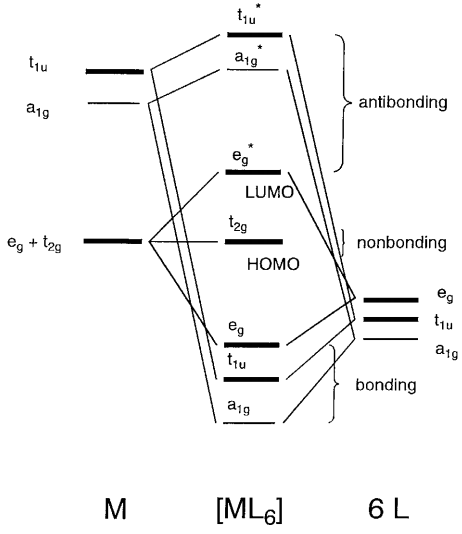
Рівні молекулярних орбіталів з найменшої енергії є склеюванням (a 1g < t 1u < e g) < незв'язуючий (t 2g) < анти-зв'язок (e g * < a 1g < t 1u *). Наприклад, в такому комплексі, як [Co (NH 3) 6] 3+, 18 валентних електронів, 6 з кобальту і 12 з аміаку, займають 9 орбіталей знизу вгору, а t 2g - HOMO і e g * LUMO. Різниця енергій між двома рівнями відповідає розщепленню поля ліганду. А саме, множина e g (d x 2 -y 2, d z 2) і ліганди на куті октаедра утворюють зв'язкові σ орбіталі, але множина t 2g (d xy, d yz, d xz) залишаються незв'язними тому що орбіталі не спрямовані на\(\sigma\) орбіталі лігандів.
\(\pi\)облігація
Коли атомні орбіталі ліганду мають\(\pi\) симетрію (тобто з вузлами) через вісь зв'язку, орбіталі e g (d x 2 -y 2) не зв'язуються, а орбіталі t 2g (d xy, d yz, d xz) мають склеювальні взаємодії з ними (рис.\(\PageIndex{11}\)). У галогенідних іонів, X -, або аква лігандів, H 2 O,\(\pi\) симетричні p орбіталі мають меншу енергію, ніж металеві t 2g орбіталі та склеювальну молекулярну орбіталь, яка нижче, ніж орбіталь t 2g, і протисклеювальна молекулярна орбіталь, яка вище ніж t 2g орбіталей, утворюють. Отже, різниця в енергії\(\Delta_{o}\) між e g і антисклеювальними орбіталями стає менше. З іншого боку, для лігандів, що мають антизв'язкові\(\pi\) орбіталі всередині молекули, такі як окис вуглецю або етилен,\(\pi^{*}\) орбіталі відповідають формі та симетрії орбіталів t 2g та молекулярних орбіталів, показаних на рис. 6.12 (b) форма. В результаті енергетичний рівень сполучних орбіталей знижується і\(\Delta_{o}\) стає більше.
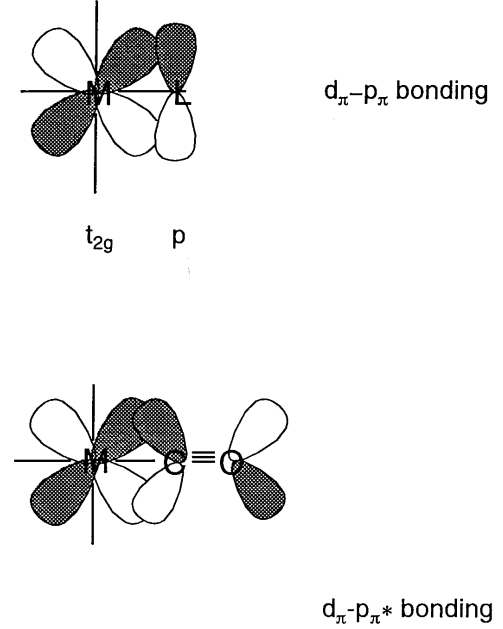
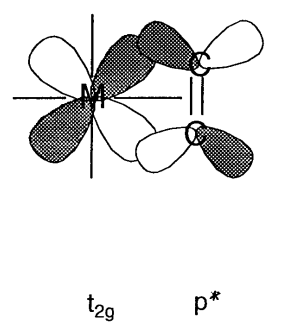
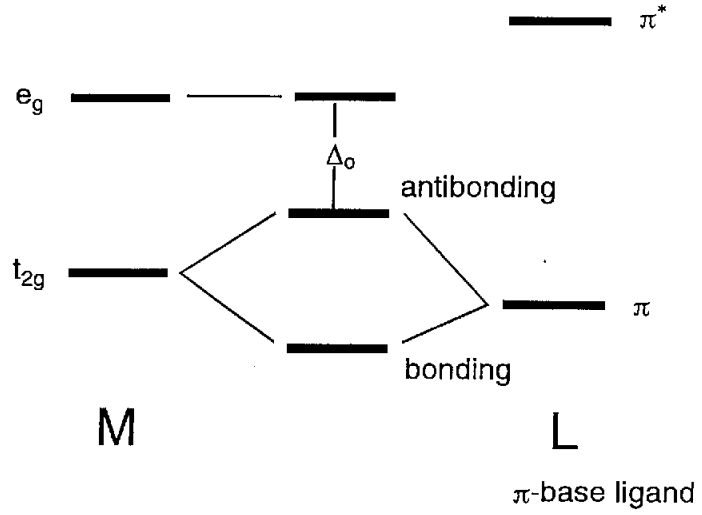
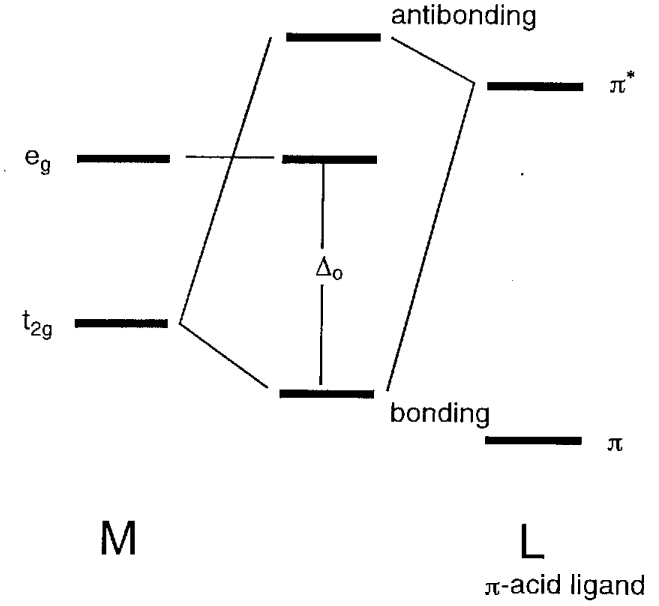
Використовуючи ці прості молекулярні орбітальні міркування, якісно зрозумілі наслідки\(\sigma\) та\(\pi\) орбітальні взаємодії між металом та лігандами на молекулярні орбіталі.
(c) Спектри
Багато комплекси перехідних металів мають характерні кольори. Це означає, що у видимій частині спектра відбувається поглинання в результаті збудження електрона видимим світлом від рівня, зайнятого електроном в молекулярній орбіталі комплексу, до порожнього рівня. Якщо різниця енергій між орбіталями, здатними до переходу, встановлена на\(\Delta\) ε, частота поглинання ν задається\(\Delta Ε = h \nu\). Електронні переходи оптичним накачуванням широко класифікуються на дві групи. Коли обидві молекулярні орбіталі, між якими можливий перехід, мають переважно характер металу d, перехід називається d-d переходом або переходом ліганд-поля, а довжина хвилі поглинання сильно залежить від розщеплення ліганд-поля. Коли одна з двох орбіталей має переважно металевий характер, а інша має великий ступінь лігандного характеру, перехід називається переходом заряду-передачі. Переходи переносу заряду класифікуються на металеві (M) на лігандні (L) передачі заряду-передачі (MLCT) і лігандні до металевих заряд-переносів (LMCT).
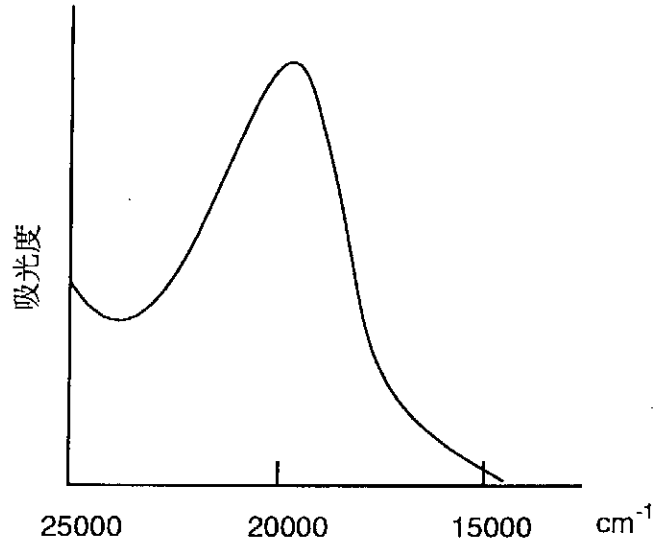
Оскільки аналіз спектрів октаедричних комплексів порівняно легкий, вони детально вивчалися протягом багатьох років. Коли комплекс має лише один d електрон, аналіз простий. Наприклад, Ti в [Ti (OH 2) 6] 3+ є іоном d 1, а електрон займає орбіталь t 2g, що утворюється при розщепленні поля октаедричного ліганду. Комплекс фіолетовий в результаті поглинання на 492 нм (20300 см -1) (рис.\(\PageIndex{13}\)), що відповідає оптичній накачуванні d електрона до орбіти. Однак в комплексі з більш ніж одним d електронами виникають репелентні взаємодії між електронами, а d-d спектр переходу має більше одного поглинання. Наприклад, комплекс d 3 [Cr (NH 3) 6] 3+ показує два d-d поглинання в області 400 нм (25000 см -1), припускаючи, що комплекс має дві групи молекулярних орбіталей, між якими можливий електронний перехід з високим ступенем ймовірність переходу. Це означає, що, коли три електрони в орбіталі t 2g збуджуються до орбіталі e g, виникають дві енергетичні відмінності через репелентні взаємодії між електронами.
Діаграми Танабе-Сугано побудовані на основі розрахунків на основі теорії поля лігандів і широко використовуються при аналізі спектрів поглинання іонів d 1 до d 9. Аналіз стає все складнішим для іонів з великою кількістю електронів. У будь-якому випадку існування d-d спектра вимагає, щоб різниця енергій зайнятої орбіти і порожньої орбіти була еквівалентна енергії УФ-видимого спектра, перехід допускається правилом відбору, а ймовірність переходу досить висока. Як правило, поглинання передачі заряду сильніше, ніж поглинання поля ліганду. LMCT виникає, коли ліганди мають незв'язну електронну пару порівняно високої енергії або метал має порожні орбіталі низької енергії. З іншого боку, MLCT має тенденцію з'являтися, коли ліганди мають низькоенергетичні\(\pi^{*}\) орбіталі, і комплекси біпіридину є хорошими прикладами цього. Оскільки термін служби збудженого стану рутенієвого комплексу [Ru (bipy) 3] 2+ надзвичайно тривалий, було проведено багато досліджень його фотоокислювально-відновних реакцій.
Спектрохімічний ряд
Величина параметра розщеплення поля\(\Delta_{o}\) ліганду визначається головним чином ідентичністю лігандів. Емпіричне правило під назвою спектрохімічний ряд було запропоновано японським вченим Рютаро Цучіда. Правило побудовано на основі емпіричних даних, зібраних при вимірюванні спектрів комплексів, які мають однаковий центральний метал, ступінь окислення, координаційне число тощо. Примітно, що ліганди з\(\pi\) акцепторними властивостями знаходяться в більш високому положенні в серії.
I - < Br - < S 2- < СН - < Cl - < НІ 3 - < F - < ОН - < Н 2 O < NH 3 < NH 2 < рРН 3 < СН - < СО
Хоча в такому порядку\(\Delta_{o}\) стає більшим, він також залежить від ідентичності центрального металу та його ступеня окислення. А\(\Delta_{o}\) саме, більше для 4d і 5d металів, ніж для 3d металів і стає більшим у міру збільшення числа окислення. Величина тісно\(\Delta_{o}\) пов'язана з його положенням поглинання в електромагнітному спектрі і є ключовим фактором при визначенні положення ліганда в спектрохімічному ряду. \(\pi\)Донорський ліганд (галоген, аква тощо) робить довжину хвилі поглинання довшою, а\(\pi\) акцепторний ліганд (карбоніл, олефін тощо) коротшим за внеском від\(\pi\) зв'язку.
(г) магнетизм
Намагніченість, М, (магнітний дипольний момент на одиницю об'єму) зразка в магнітному полі H пропорційна величині Н, а постійна пропорційності\(\chi\), залежить від зразка.
\[M = \chi H\]
\(\chi\)- об'ємна сприйнятливість і добуток\(\chi\) і молярний об'єм V m зразка є молярною сприйнятливістю\(\chi_{m}\). А саме,
\[\chi_{m} = \chi V_{m}\]
Всі речовини мають діамагнетизм, і крім цього речовини з непарними електронами проявляють парамагнетизм, величина якого приблизно в 100 разів більше, ніж у діамагнетизму. Закон Кюрі показує, що парамагнетизм обернено пропорційний температурі.
\[\chi_{m} = A + \frac{C}{T}\]
де T - абсолютна температура, а А і С - константи. У методах Гуя або Фарадея магнітні моменти обчислюються за зміною ваги зразка, підвішеного між магнітами при застосуванні магнітного поля. Крім цих методів, для проведення таких вимірювань останнім часом використовується високочутливий SQUID (надпровідний пристрій квантових перешкод).
Парамагнетизм індукується постійним магнітним моментом непарного електрона в молекулі, а молярна сприйнятливість пропорційна кутовому імпульсу електрону. Парамагнітні комплекси d-блокових перехідних металів мають непарні електрони спінового квантового числа 1/2, а половина від числа непарних електронів становить сумарне спіновий квантове число S. Тому теоретично можна вивести магнітний момент, заснований тільки на спіненнях.
\[\mu = 2 \sqrt{2S(S+1)} \mu_{B} = \sqrt{n(n+2)} \mu_{B}\]
Тут\(\mu_{Β}\) = 9.274 х 10 -24 JT -1 - це одиниця, яка називається магнетон Бора.
Багато 3d металокомплекси показують хорошу згоду між магнітними моментами парамагнітних комплексів, виміряних магнітним балансом, зі значеннями, розрахованими за вищевказаною формулою. Зв'язок між числом непарних електронів і магнітною сприйнятливістю комплексу наведена в табл\(\PageIndex{3}\). Через таку згоду з теорією можна визначити кількість непарних електронів за експериментальними значеннями магнітних вимірювань. Наприклад, можна припустити, що комплекс Fe 3 + d 5 з магнітним моментом близько 1,7\(\mu_{Β}\) - це низкоспіновий комплекс з непарним спіном, а комплекс Fe 3 + d 5 з моментом близько 5,9\(\mu_{Β}\) - це високоспіновий комплекс. з 5 непарними електронами.
| Металевий іон | непарний електрон | Спін-тільки магнітний момент (\(\frac{\mu}{\mu_{B}}\)) | |
|---|---|---|---|
| п | \ (\ frac {\ mu} {\ mu_ {B}}\)) "> Обчислено | Виміряний | |
| Ti 3 + | 1 | \ (\ frac {\ mu} {\ mu_ {B}\)) ">1.73 | 1,7 ~ 1,8 |
| В 3+ | 2 | \ (\ frac {\ mu} {\ mu_ {B}}\)) ">2.83 | 2,7 ~ 2,9 |
| Автомобіль 3 + | 3 | \ (\ frac {\ mu} {\ mu_ {B}\)) ">3.87 | 3.8 |
| Мн 3 + | 4 | \ (\ frac {\ mu} {\ mu_ {B}\)) ">4.90 | 4,8 ~ 4,9 |
| Фе 3+ | 5 | \ (\ frac {\ mu} {\ mu_ {B}\)) ">5.92 | 5.9 |
Однак виміряний магнітний момент більше не узгоджується з розрахунковим значенням лише спіну, коли внесок орбітального кутового імпульсу в магнітний момент стає великим.. Особливо в 5d металевих комплексах ця невідповідність між виміряними і розрахунковими значеннями збільшується.
Вправа\(\PageIndex{3}\)
Обчисліть тільки спінові магнітні моменти високого спіна і низького спіна комплексів Fe 3 +.
- Відповідь
-
Оскільки вони являють собою d 6 комплексів, то високоспіновий комплекс має чотири непарних електронів з магнітним моментом 4,90,\(\mu_{B}\) а низький спіновий комплекс не має непарного електрона і є діамагнітним.
Деякі парамагнітні тверді матеріали стають феромагнітними при низьких температурах, утворюючи магнітні домени, в яких тисячі електронних спінів вирівнюються паралельно один одному. Температура, при якій відбувається парамагнітно-феромагнітний фазовий перехід, називається температурою Кюрі. Коли спини вирівнюються антипаралельно один одному, матеріал змінюється на антиферомагнітну речовину, і ця температура переходу називається температурою Нееля. Матеріал стає феррімагнітним, коли спини в повному обсязі скасовуються. Останнім часом були зроблені спроби синтезувати поліядерні багатоспінові комплекси зі спеціальними лігандами, які змушують парамагнітні іони металів вирівнюватися, щоб викликати феромагнітні взаємодії між спинами. Такий ефект неможливий в мононуклеарних комплексах.