5.P: Проблеми
- Page ID
- 32867
Концепція Огляд Питання
1. Які припущення (аксіоми) теорії молекулярної орбіти (МО)?
2. Якісно поясніть, чому векторне додавання атомних орбіталів створює молекулярні орбіталі (яке основне фізичне явище описується векторним доповненням?).
3. Якісно поясніть, чому молекулярна орбітальна теорія підходить для опису ковалентного зв'язку.
4. Які три критерії визначають ступінь ковалентної взаємодії в теорії МО?
5. Які три правила визначають ступінь орбітального перекриття в теорії МО?
6. Поясніть, чому поєднання великої, дифузної орбіти і малої орбіти виробляє лише слабку ковалентну взаємодію.
7. Поясніть, чому сигма-взаємодії між атомними орбіталями зазвичай спричиняють більші орбітальні перекриття, ніж взаємодії пі.
8. Поясніть, чому поєднання орбіталей однієї і тієї ж енергії призводить до найбільшого ступеня ковалентної взаємодії.
9. Що можна сказати про енергію та розташування зв'язку та протисклеювальної молекулярної орбіталі, які виготовляються з атомних орбіталей великої різниці енергії?
10. Теорія МО - навіть незважаючи на те, що призначена для ковалентного зв'язку - також може робити заяви про іонне з'єднання. Поясніть чому.
11. Поясніть принципи SALC.
Завдання домашніх завдань
Секція 1
Вправа 1
Що, швидше за все, призведе до найменшого ковалентного взаємодії?
а) Перекриття малої і великої орбіти.
б) Перекриття двох малих орбіталей.
в) Перекриття двох великих орбіталей.
- Відповідь
-
а) Перекриття малої і великої орбіти.
Вправа 2
Що, швидше за все, призведе до найбільшої ковалентної взаємодії?
а) орбітальне перекриття в сигма-моді
б) орбітальне перекриття в пі-моді
в) орбітальне перекриття в дельта-моді
- Відповідь
-
а) орбітальне перекриття в сигма-моді
Вправа 3
Якісно побудувати MO діаграми, що складаються з
а) два 2s атома орбіталі A і B рівної енергії.
б) дві орбіталі атома 2s, де орбітальна енергія атома А значно вища, ніж у B. Якщо і зв'язок, і антизв'язуючий МО заповнені електронами, де в першу чергу будуть розташовані зв'язкові та антизв'язуючі електрони? Коротко поясніть своє рішення.
- Відповідь
-

Вправа 4
Вирішіть шляхом «огляду», які з наступних комбінацій орбіталей мають «правильні» симетрії для формування молекулярних орбіталей.
а) 2p x орбіталь першого атома N і 2p y орбіталі другого атома N в молекулі N 2. Вісь z визначається як вісь зв'язку в N 2.
б) F 2p x і H 1s орбіталі в молекулі ВЧ. Вісь z визначається як вісь зв'язку.
в) 2p z орбіталі F і 1s орбіталі в молекулі ВЧ. Вісь z визначається як вісь зв'язку.
- Відповідь
-
а)
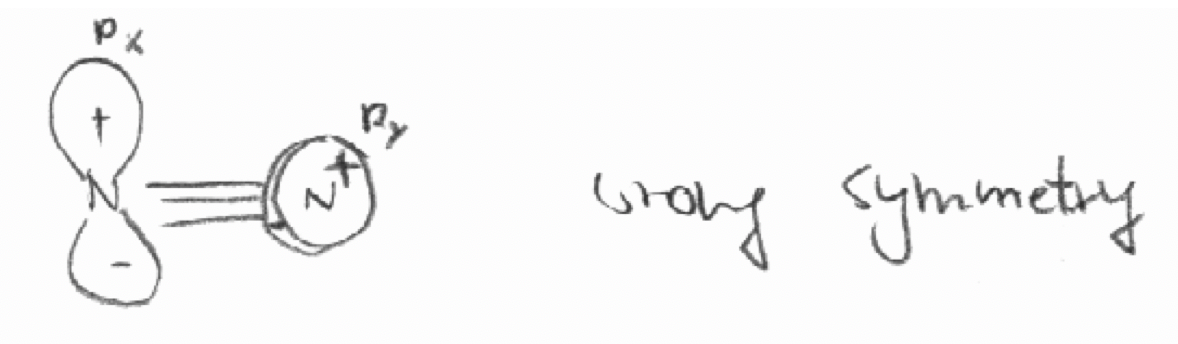
б)
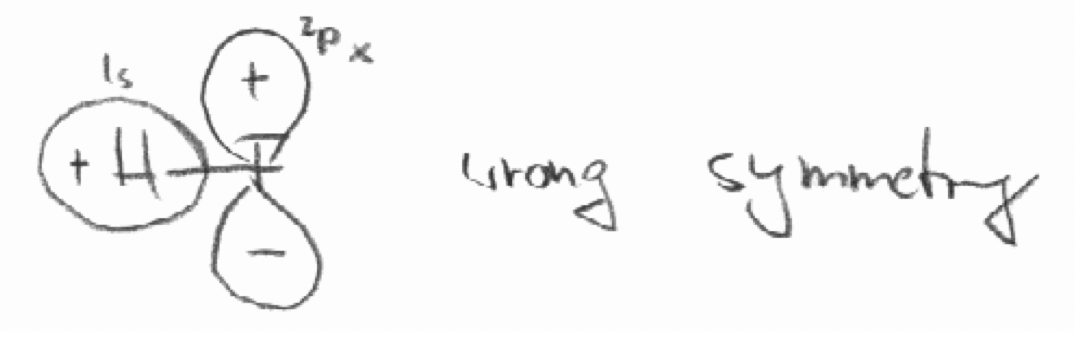
в)
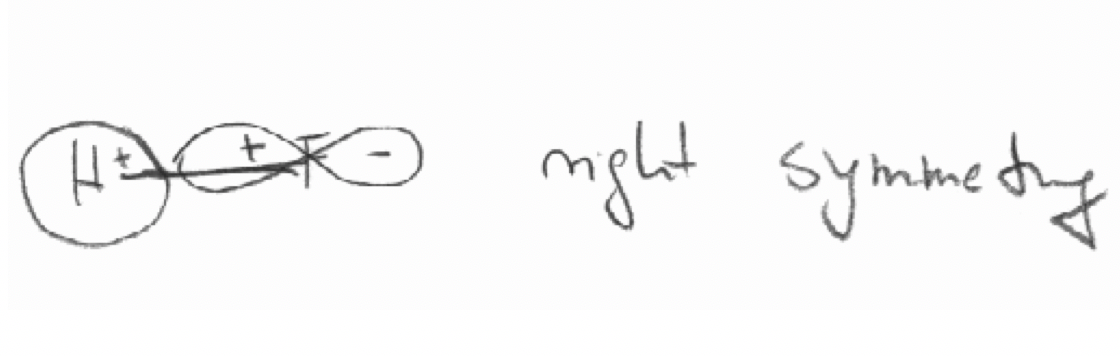
Вправа 5
Молекула СН 4 відноситься до точкової групи T d. Таблицю символів групи точок можна знайти в Інтернеті.
а) Обчисліть зведене уявлення для орбіталів лігандної групи (LGO).
б) Обчислити незвідні уявлення орбіталів групи лігандів (LGO).
в) Намалюйте якісну молекулярну орбітальну діаграму для CH 4.
- Відповідь
-
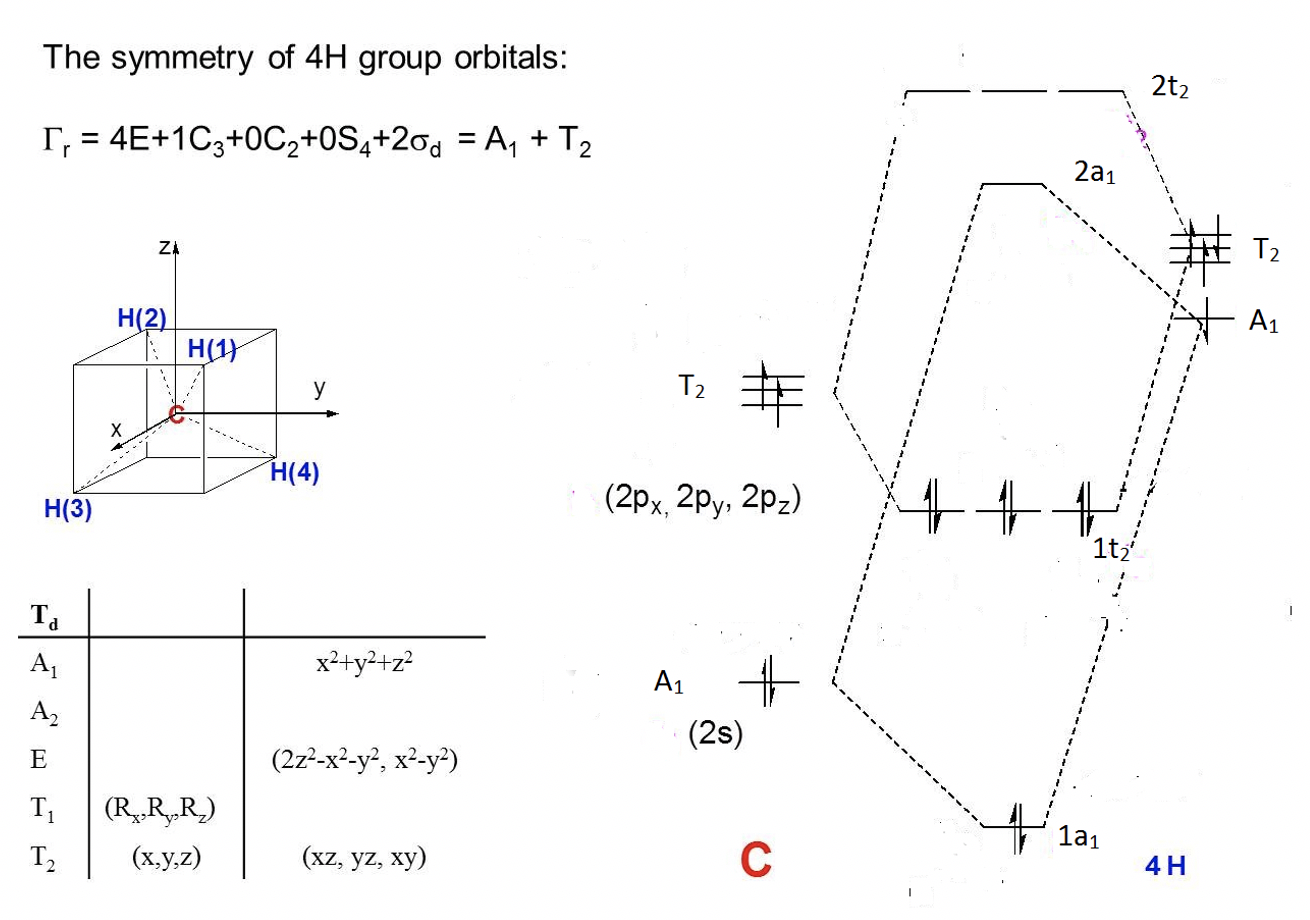
Вправа 6
Які типи симетрії орбіталів центрального атома в молекулі pCl 5?
- Відповідь
- 1. Визначити точку групи pCl 5. —> D 3h.
- 2. Вирішіть, які валентні орбіталі центрального атома: 3s, 3p
- 3. Подивіться таблицю символів D 3h, наприклад, в Інтернеті. Ви знайдете їх симетрії: A 1 '(3s), A 2 "(3p z), E' (3p x, 3p y)
Вправа 7
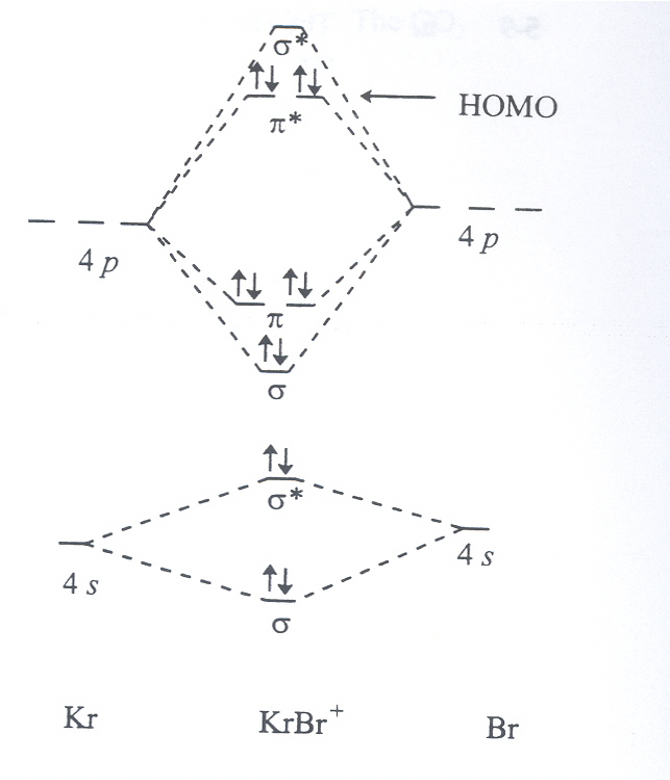
Для гіпотетичної молекули BrKr +: До якого атома поляризований HOMO? Поясніть коротко чому.
- Відповідь
-

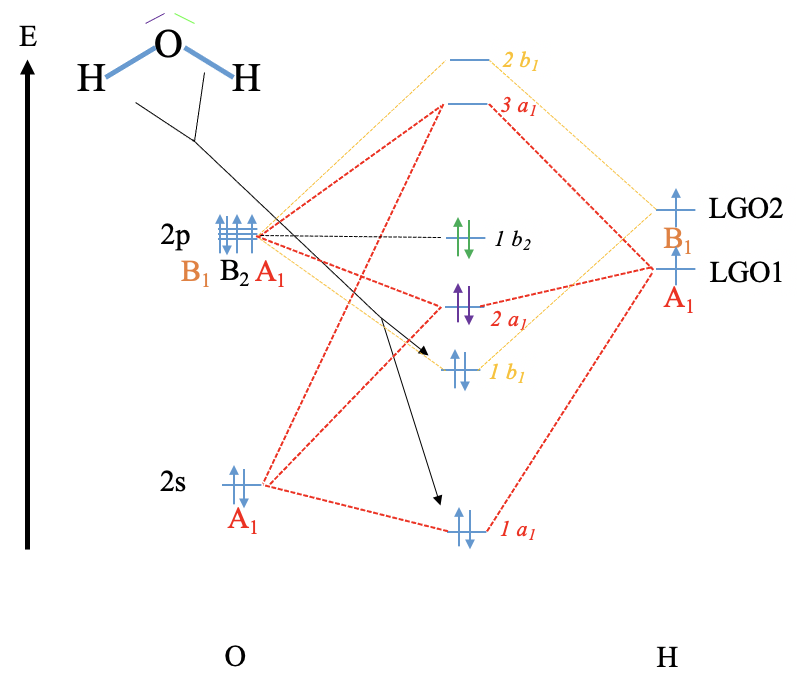
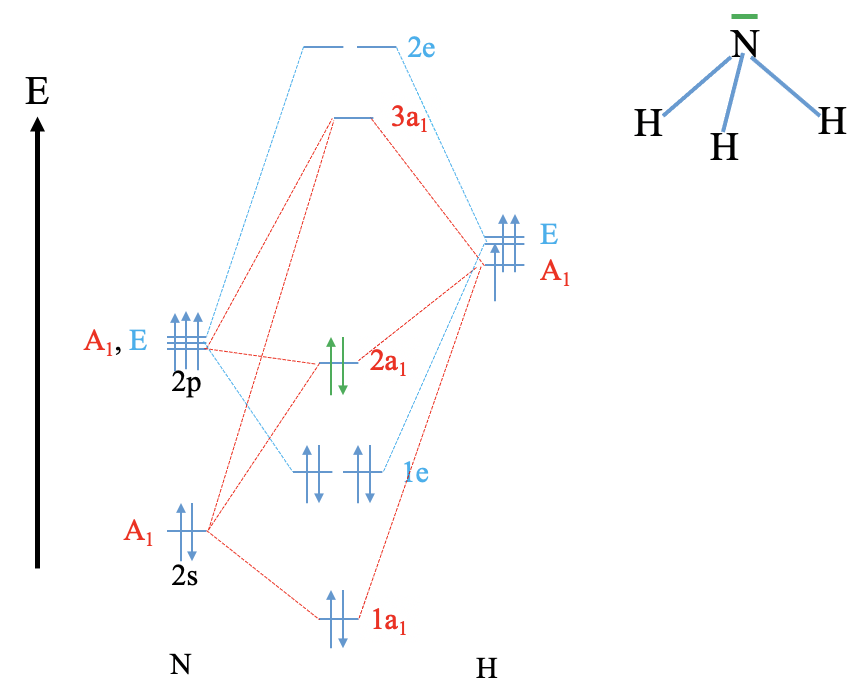
Вправа 8
Реконструюйте діаграму MO для води та NH 3 (повторіть те, що ми зробили в класі, не дивлячись на ваші нотатки (використовуйте лише відповідні таблиці символів).
- Відповідь
-
Вода
NH 3
Молекулярна орбітальна діаграма для двоатомної молекули (два атоми) завжди має однакову основну схему.
- Намалюйте картинку рівнів.
- Позначте кожен рівень σ, σ*, π, π*
- Відповідь
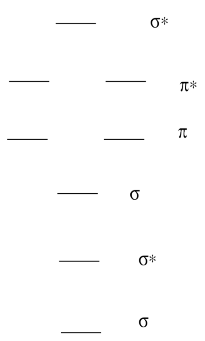
Молекулярна орбітальна діаграма для двоатомної молекули (два атоми) змінюється за кількістю електронів. Як ви заповнюєте електрони?
- Відповідь
-
• Підрахуйте валентні електрони на молекулі. Це кількість валентних електронів на кожному атомі, пристосоване під будь-який заряд на молекулі. (наприклад, C 2 - має 10 валентних електронів: 4 з кожного вуглецю - це 8 - і ще два для заряду 2).
• Спочатку заповніть електрони в орбіталі найнижчої енергії.
• Парні електрони після всіх орбіталів на одному енергетичному рівні мають один електрон.
Побудувати якісну молекулярну орбітальну діаграму для хлору, Cl 2. Порівняйте порядок зв'язку з тим, що спостерігається в структурі Льюїса (пам'ятайте, що електрон в антизв'язуючій орбіті скасовує стабілізацію за рахунок зв'язку електрона в орбіталі зв'язку).
- Відповідь
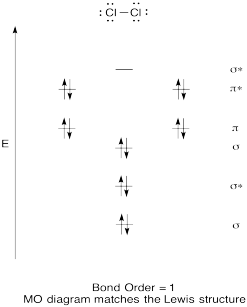
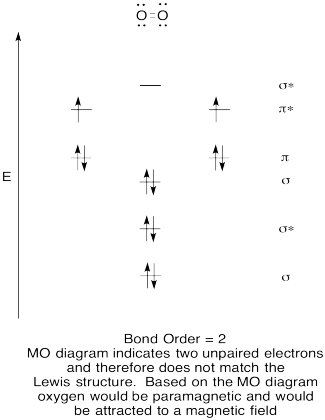
- Побудувати якісну молекулярну орбітальну діаграму для кисню, O 2.
- Порівняйте порядок облігацій з тим, що спостерігається в структурі Льюїса.
- Як ще ця MO картина кисню порівнюється зі структурою Льюїса? Що дві структури говорять вам про сполучення електронів?
- Сполуки, які мають всі свої електрони в парі, називаються діамагнітними. Ті, у кого непарні електрони, називаються парамагнітними. Парамагнітні матеріали притягуються магнітним полем, але діамагнітні речі - ні. Як би ви очікували, що молекулярний кисень буде вести себе?
- Відповідь
-
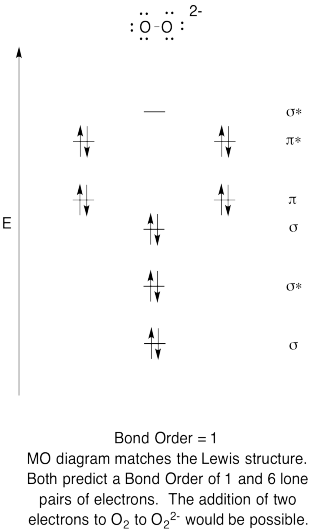
- Побудувати якісну молекулярну орбітальну діаграму пероксидного аніона, O 2 2 -.
- Порівняйте порядок облігацій з тим, що спостерігається в структурі Льюїса.
- Як ще ця MO картина кисню порівнюється зі структурою Льюїса? Що дві структури говорять вам про сполучення електронів?
- На основі молекулярних орбітальних знімків, як легко, на вашу думку, диоксиген може бути зменшений до пероксиду (шляхом додавання двох електронів)?
- Відповідь
-
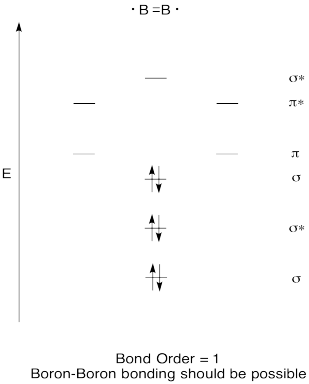
Побудувати якісну молекулярну орбітальну діаграму для дибора, B 2. Як ви думаєте, борно-борні зв'язки могли б легко сформуватися, виходячи з цієї картини?
- Відповідь
-
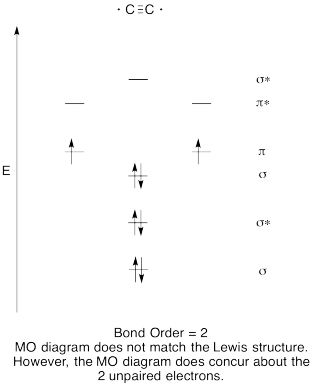
- Побудувати якісну молекулярну орбітальну діаграму для дикарбону, C 2.
- Порівняйте порядок облігацій з тим, що спостерігається в структурі Льюїса.
- Як ще ця MO картина кисню порівнюється зі структурою Льюїса? Що дві структури говорять вам про сполучення електронів?
- Відповідь
-
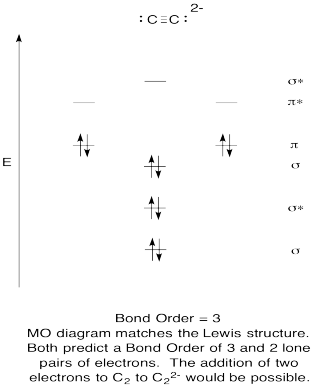
- Побудувати якісну молекулярно-орбітальну діаграму для ацетилідного аніону, С 2 2 -.
- Порівняйте порядок облігацій з тим, що спостерігається в структурі Льюїса.
- Як ще ця MO картина кисню порівнюється зі структурою Льюїса? Що дві структури говорять вам про сполучення електронів?
- На основі молекулярних орбітальних знімків, як легко, на вашу думку, дикарбон може бути зменшений до ацетиліду (шляхом додавання двох електронів)?
- Відповідь
-
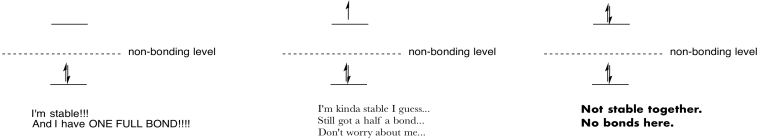
Зробіть малюнки та замітки, щоб узагальнити ефект заселення антизв'язуючих орбіталів.
- Відповідь
-
Дослідники Джона Хопкінса недавно повідомили про утворення Na 4 Al 2 в імпульсному дуговому розряді (вони подавали багато електричного струму через зразок натрію і алюмінію; Ксінксінг Чжан, Іван А. Попов, Кеті А. Лунделл, Хаопенг Ван, Чаонан Му, Вей Ван, Хансгеорг Шнекель, Болдирєв Олександр Іванович, Кіт Боуен, Міжнародне видання Анжеванде Хемі, 2018, 57 (43), 14060-14064. Авторське право 2018, Джон Вілі та сини. Використовується з дозволу.).
- З'єднання є іонним. Поясніть, які атоми утворюють катіони, виходячи з періодичних тенденцій.
- Отже, які атоми утворюють аніон?
- Аніон - це одна молекула. Який заряд на цій молекулі?
- Покажіть, як розрахувати загальну валентність електронів у цьому молекулярному аніоні.
- Намалюйте структуру Льюїса для цього молекулярного аніону.
- Побудувати двоатомну молекулярно-орбітальну діаграму рівня енергії для цієї молекули. Позначте енергетичні рівні (сигма, пі і т.д.) і додайте правильну кількість електронів.
- Покажіть, як розрахувати порядок зв'язку в молекулі.
- Відповідь
-
а) Na, оскільки Na має менший потенціал іонізації (і меншу електронегативність), ніж Al.
б) Всі
в) 4-, тому що є чотири Na +
г) всього е - = 2 х 3 е - (на Ал) + 4 е - (для негативного заряду) = 10 е-

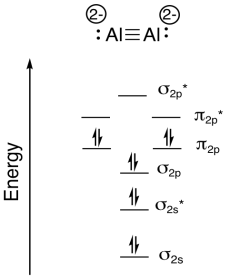
г)\(\textrm{bond order} = \frac{( \# bonding \: e^{-} - \# antibonding \: 3^{-})}{2} = \frac{8-2}{2}= 3\)
Намалюйте молекулярну орбітальну діаграму для (\(\ce{NO^-}\)).
- Відповідь
-
Додайте сюди тексти. Не видаляйте цей текст спочатку.
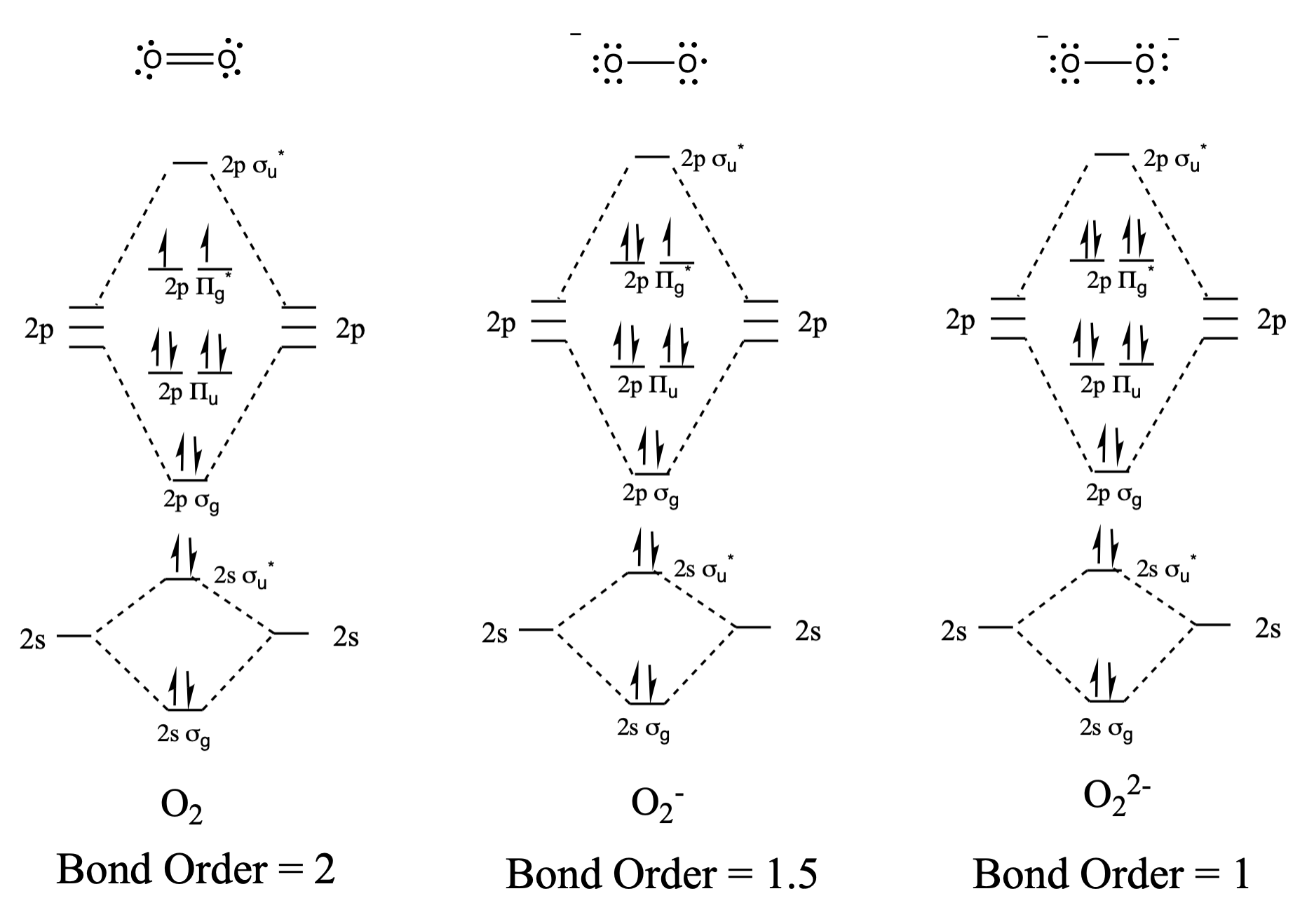
Намалюйте та порівняйте молекулярні орбітальні діаграми з діаграмами структури Льюїса для\(\ce{O2}\)\(\ce{O2^-}\), і\(\ce{O2^2-}\).
- Відповідь
-
Структури Льюїса та діаграми МО наведені нижче. Загалом, порядок зв'язку, отриманий з діаграми МО, узгоджується зі структурою Льюїса для кожного виду. У випадку з двома іонами кількість непарних електронів з теорії МО та структури Льюїса також узгоджується. Однак у випадку з диоксигеном існує невідповідність між поданням Льюїса та діаграмою МО. Хоча структура Льюїса привела б нас до думки, що всі електрони парні, діаграма МО вказує на парамагнетизм з двома непарними електронами. Діаграма МО пояснює магнітну поведінку диоксигену.
Намалюйте молекулярно-орбітальну діаграму для гідроксид-іона (\(\ce{OH^-}\)).
- Відповідь
-
Додайте сюди тексти. Не видаляйте цей текст спочатку.
Намалюйте молекулярно-орбітальну діаграму гідроксиду фториду (\(\ce{HF}\)).
- Відповідь
-
Додайте сюди тексти. Не видаляйте цей текст спочатку.
Намалюйте молекулярно-орбітальну діаграму для борану (\(\ce{BN}\)).
- Відповідь
-
Додайте сюди тексти. Не видаляйте цей текст спочатку.
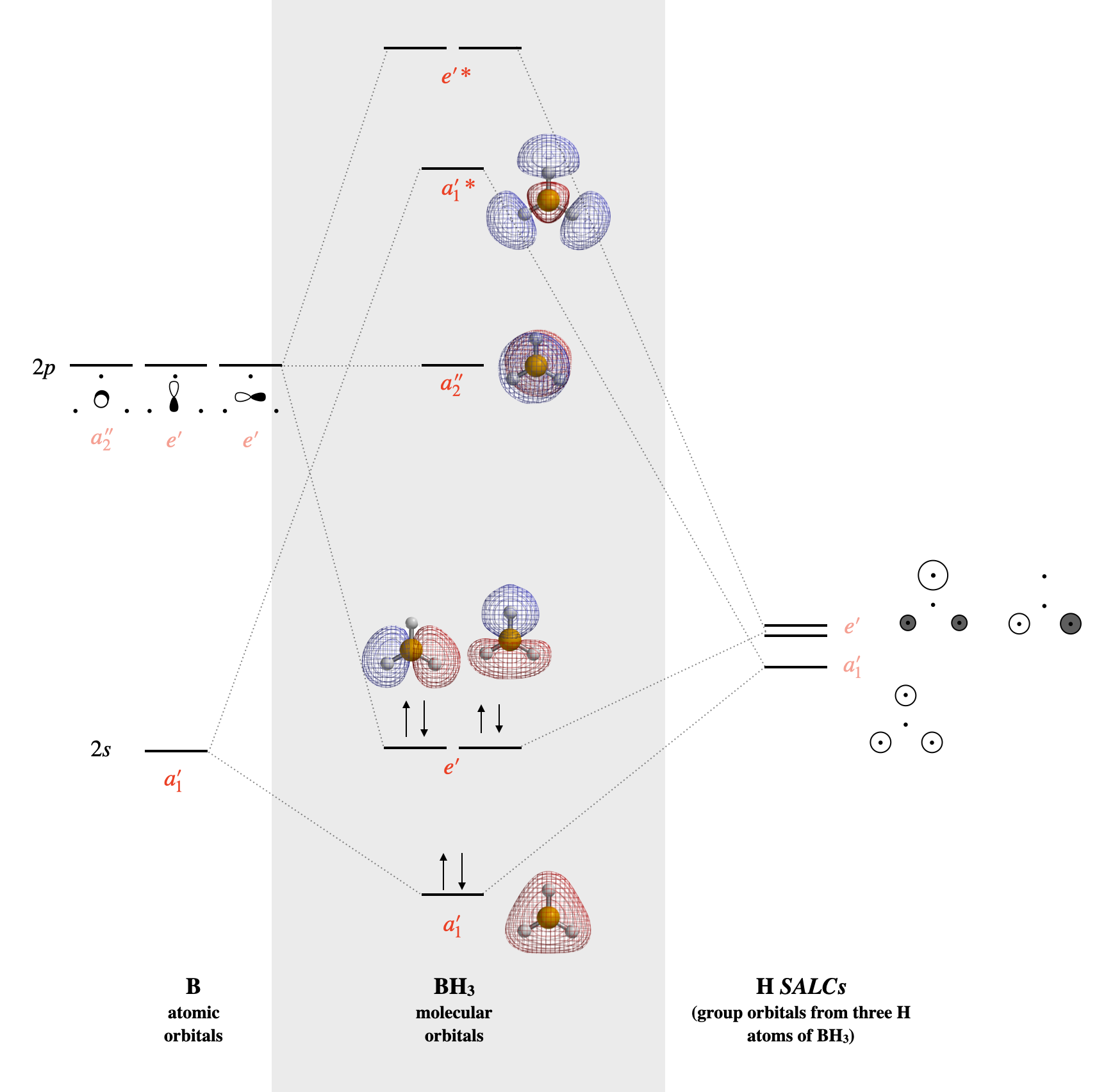
BH3
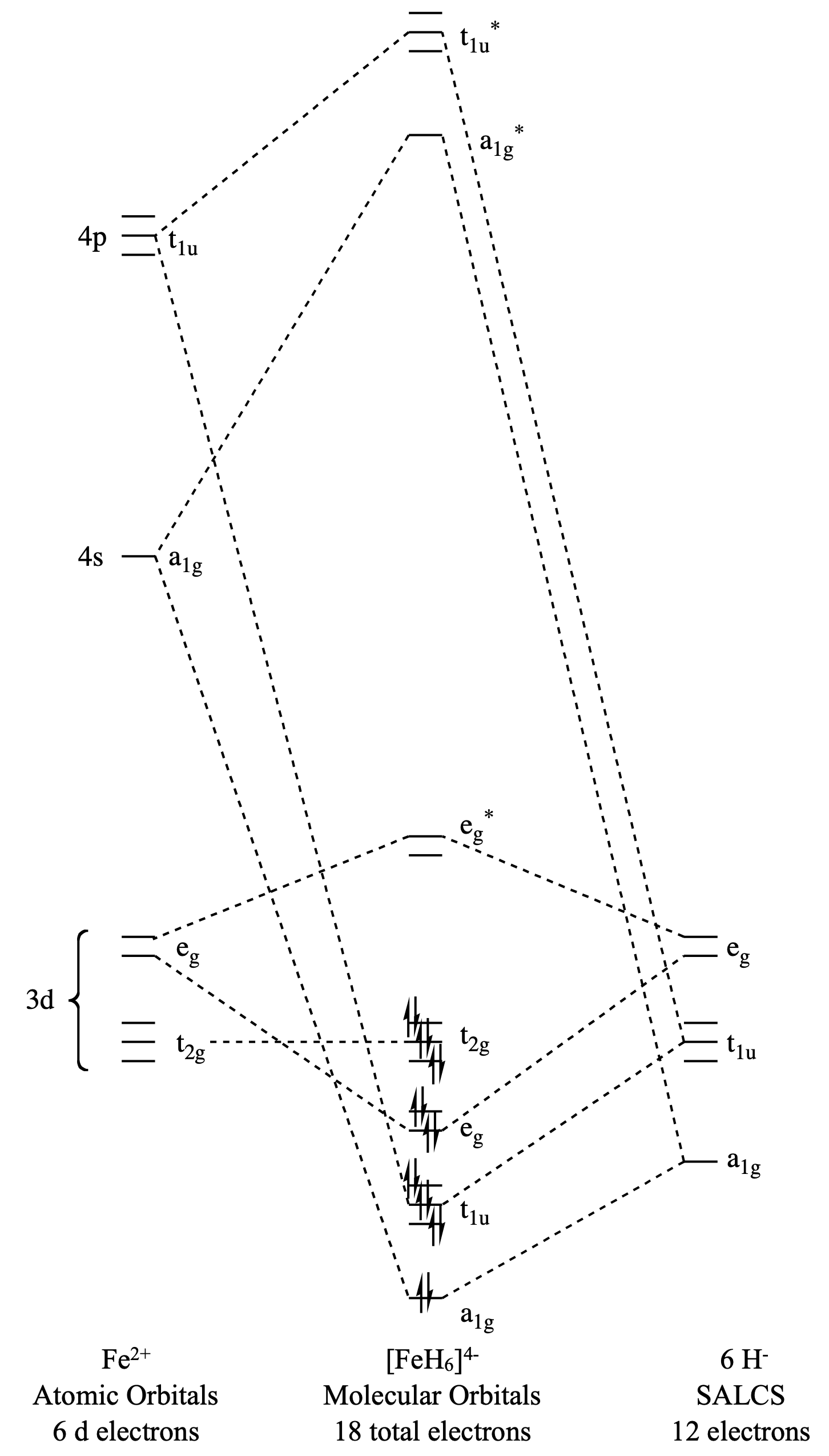
Намалюйте молекулярну орбітальну діаграму для (\(\ce{FeH6}\)).
- Відповідь
-
Намалюйте молекулярно-орбітальну діаграму для трифториду бору (\(\ce{BF3}\)).
- Що таке несклеювальна орбітальна?
- Що таке орбіталі HOMO та LUMO?
- Чому e' має 2 лінії енергетичних рівнів порівняно з a1', який має лише 1-лінійний енергетичний рівень?
- Який порядок облігацій\(\ce{BH3}\) у цій діаграмі МО?
- Відповідь
-
Розрахункова діаграма МО показана нижче.
- \(a_2''\)є самотньою орбітальною, що не зв'язується.
- HOMO - це\(a_2''\) незв'язкова орбітальна, LUMO - це склеювальний\(e'\) набір з двох вироджених орбіталів/
- \(e'\)подвійно вироджується
- Порядок облігацій - 3