5.3.2: Полярні зв'язки
- Page ID
- 32863
Молекулярно-орбітальні діаграми для гетероядерних двоатомних молекул
Молекулярна орбітальна діаграма гетеронуклеарної двоатомної молекули наближається таким чином, як у гомоядерної двоатомної молекули. Орбітальні діаграми також можуть виглядати аналогічно. Основна відмінність полягає в тому, що більш електронегативний атом матиме орбіталі на більш низькому енергетичному рівні. Два приклади гетероядерних двоатомних молекул будуть досліджені нижче як наочні приклади.
Діаграма монооксиду вуглецю MO
Окис вуглецю є прикладом гетеронуклеарної двоатомної молекули, де обидва атоми є елементами другого ряду. Валентні молекулярні орбіталі в обох атомах є\(2p\) орбіталями\(2s\) і. Молекулярна орбітальна діаграма для окису вуглецю (рис.\(\PageIndex{1}\)) побудована таким чином, як ви будуєте дивуглець або диоксиген, за винятком того, що кисневі орбіталі мають меншу потенційну енергію, ніж аналогічні вуглецеві орбіталі. Маркування молекулярних орбіталів на цій діаграмі слідує за конвенцією, за якою орбіталям дають серійні мітки відповідно до типу орбіталів (\(\sigma\)тощо).\(\pi\) Найнижчим енергійним орбіталям будь-якого типу присвоюється значення 1 і вище енергії орбіталям одного типу присвоюється шляхом збільшення інтервалів (.. 2, 3, 4...). Описана раніше орбітальна система маркування неприйнятна для гетероядерних двоатомних молекул, які не можуть бути призначені\(g\) і\(u\) індекси.
Наслідком нерівних рівнів атомної орбітальної енергії є те, що орбітальне змішування є значним. Зверніть увагу на порядок молекулярних орбіталей,\(1\pi\) позначені і на\(3\sigma\) малюнку\(\PageIndex{1}\). Це подібний порядок\(\sigma\) орбіталів\(\pi\) та орбіталів до того, який ми бачили у випадку з\(\pi_u\) орбіталями\(N_2\) та легшою діатомікою другого періоду.\(\sigma_g\) Оскільки киснева\(2p_z\) орбіталь близька за енергією як до вуглецю, так\(2p_z\) і до вуглецю\(2s\), ці три орбіталі матимуть значну взаємодію (змішування). Результатом є збільшення енергії орбіти і зниження енергії\(3\sigma\) орбіти, в результаті чого виходить діаграма, показана на малюнку\(\PageIndex{1}\).\(2\sigma^*\)
У випадку з чадним газом (рис.\(\PageIndex{1}\)) атомні орбіталі вносять неоднаковий внесок у кожну молекулярну орбіталь. Наприклад, оскільки\(2s\) орбіта кисню дуже близька за енергією до\(2\sigma\) молекулярної орбіти, це сприяє цій молекулярній орбіталі більше, ніж\(2s\) орбітальна з вуглецю. Зверніть увагу на форму цієї\(2\sigma\) орбіти і те, як вона нерівномірно розподілена по двох атомах; вона більш сильно розподілена на кисні, тому що він найбільше схожий на кисень\(2s\). Це відповідає припущенню, що електронна щільність більше розподіляється на кисні, оскільки вона більш електронегативна, ніж вуглець. Так само\(1\pi\) орбіталі розподілені нерівномірно, з більшим розподілом, близьким до кисню.
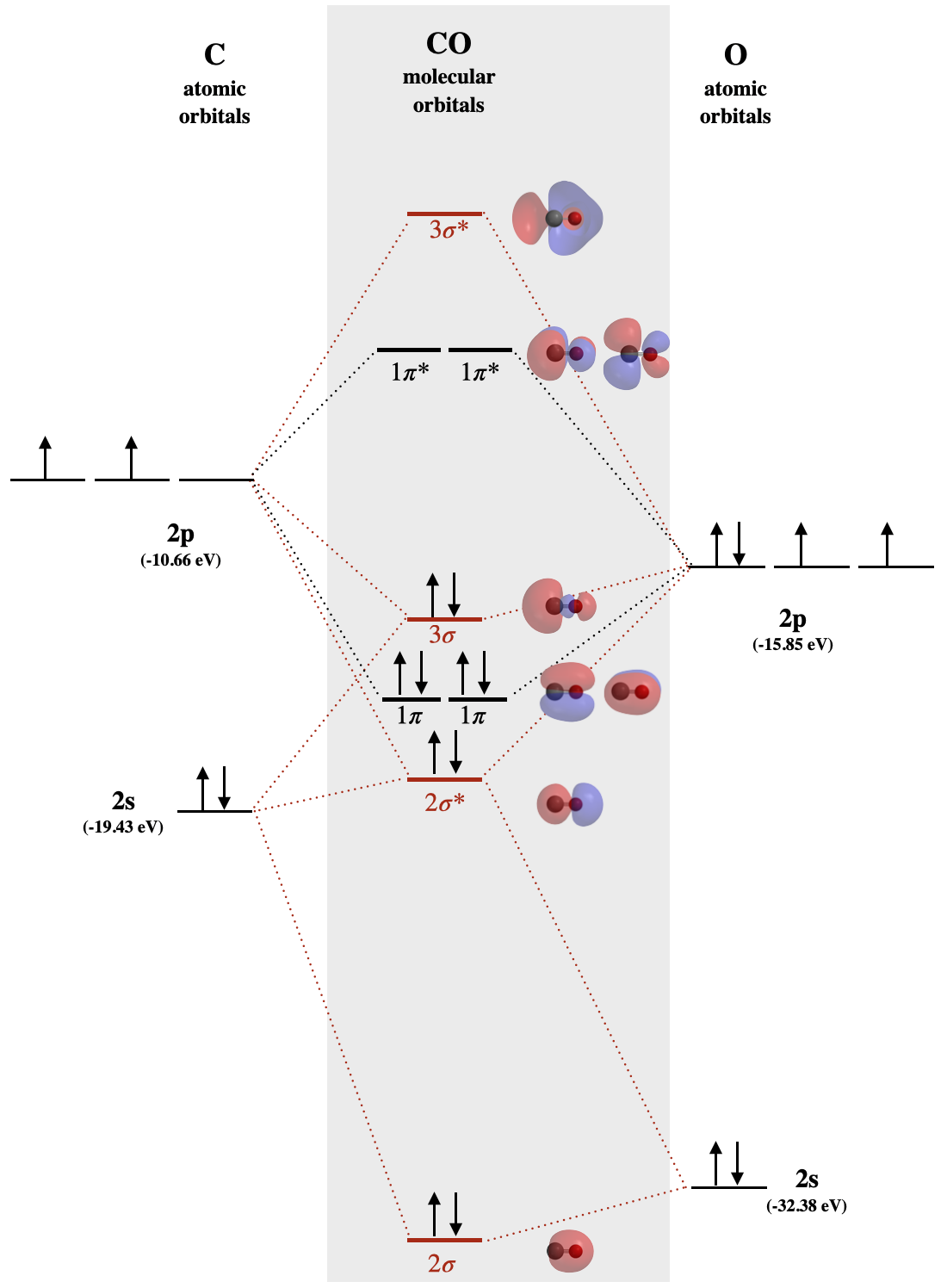
Вивчіть форму\(3\sigma\) орбіти окису вуглецю на рис\(\PageIndex{1}\). Опишіть, якими способами ця форма відрізняється від форми\(\sigma_g\) орбіталей другого періоду гомоядерних двоатомних молекул (див. Рис. 5.2.1.1). Раціоналізуйте ці відмінності. Обидві орбіталі заново створюються нижче для зручності.

- Відповідь
-
\(\sigma\)Орбітальна 3 схожа на\(\sigma_g\) те, що вона має три частки і два вузли, розподілені уздовж міжядерної зв'язку. Вони різні за своїм поширенням. Дві зовнішні частки\(\sigma_g\) рівномірно розподілені, оскільки вони є рівною комбінацією двох\(p_z\) орбіталей (по одній від кожного атома). \(3\sigma\)Орбітальна більш сильно розподілена по відношенню до атома вуглецю, тим менше електронегативного атома, ніж до кисню. Нерівний розподіл\(3\sigma\) простежується в нерівних розмірах його зовнішніх пелюсток і нерівній формі внутрішньої пелюстки. Більш важкий розподіл всередині зовнішньої частки на вуглеці викликано змішуванням вуглецевої\(2s\) орбіти з вуглецевими та кисневими\(2p_z\) орбіталями. Нерівна форма внутрішньої частки, де вона схиляється до кисню, найкраще пояснюється тим, що\(3\sigma\) орбіталь ближче за енергією до кисню,\(2p_z\) ніж вуглець\(2p_z\).
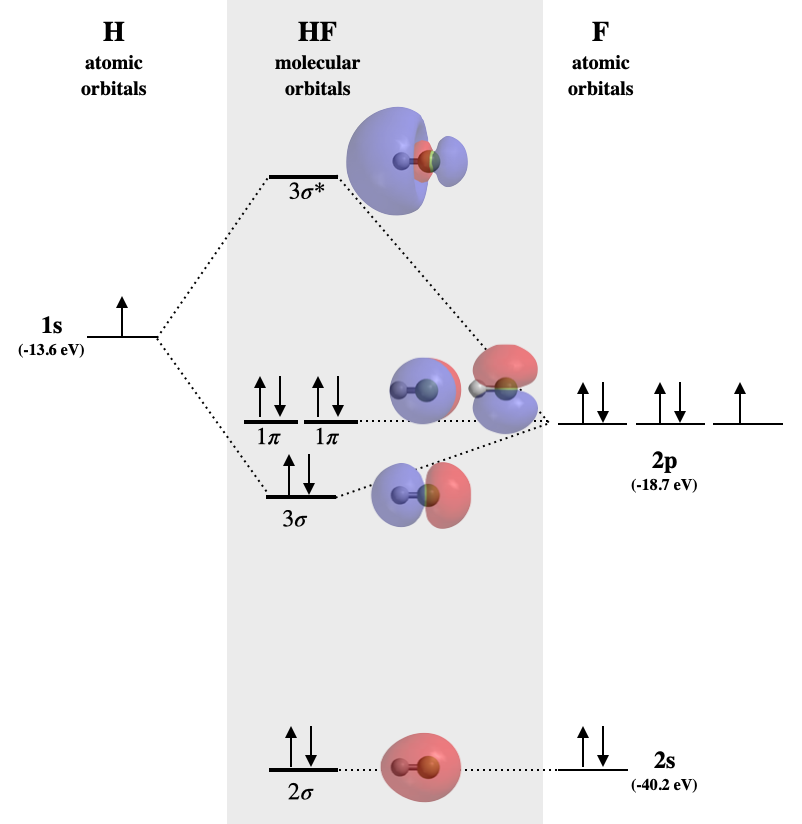
Діаграма Фтористого водню MO
Фторид водню є прикладом гетеронуклеарної двоатомної молекули, в якій два атоми знаходяться з різних періодів. У цьому випадку валентна орбіта H є\(1s\) тоді як ті F є\(2s\) і\(2p\). Молекулярна орбітальна діаграма для ВЧ показана на рис\(\PageIndex{2}\).
Три з цих орбіталів мають сумісну симетрію для змішування; це водень\(1s\)\(2s\), фтор та фтор\(2p\). Однак ступінь, в якій вони будуть взаємодіяти, залежить від їх відносних енергій. Фтор більш електронегативний, ніж Н, а атом фтору має вищу першу енергію іонізації, ніж водень. З цих тенденцій можна очікувати, що орбіталі валентності фтору нижчі за енергією, ніж у водню. З таблиці 5.3.1 ми знаходимо, що 1s орбіталь H (-13,6 еВ) вище за енергією, ніж обидві фторорбіталі (-18.7 і -40.2 еВ відповідно для\(2p\) і\(2s\)). Енергії водню\(1s\) та фтору добре\(2p\) поєднуються; однак\(2s\) орбітальна фтор занадто різна, щоб створити продуктивну взаємодію. Тому ми очікуємо, що фтор\(2s\) створить незв'язну молекулярну орбіталь, тоді як\(1s\) і\(2p_z\) орбіталі об'єднуються, щоб зробити\(\sigma\) склеювання та\(\sigma^*\) антизв'язуючі молекулярні орбіталі. Решта\(2p_x\) і\(2p_y\) орбіталі не мають сумісної симетрії для зв'язку з воднем, і вони будуть утворювати незв'язні\(\pi\) молекулярні орбіталі. Незв'язні орбіталі матимуть аналогічну енергію та характер, як їх складові атомні орбіталі.
Хімічні реакції відбуваються на орбіталах HOMO та LUMO
Знання молекулярних орбітальних діаграм та форм молекулярних орбіталів можуть бути використані для точного пояснення та прогнозування хімічної реактивності. Хімічні реакції відбуваються з використанням найвищих зайнятих молекулярних орбіталів (HOMO) нуклеофіла або основи Льюїса та найнижчої незайнятої молекулярної орбіти (LUMO) електрофілу або кислоти Льюїса.
Основи Льюїса реагують за допомогою електронів у HOMO, тоді як кислоти Льюїса реагують за допомогою порожнього LUMO.
Приклад: Реактивність СО з іонами металів
СО є відмінним лігандом для багатьох іонів металів. Насправді сильна спорідненість між СО і іонами гемового заліза (Fe) в гемоглобіні може пояснити механізм отруєння чадним газом. Коли СО зв'язується замість гемоглобіну, цей гемоглобін більше не може\(O_2\) переноситися до клітин тканин.\(O_2\) Зв'язування СО з гемоглобіном сильне і практично незворотне. Коли СО зв'язується з іонами металів, він робить це через атом вуглецю. Це суперечить очікуванням, заснованим на структурі Льюїса та відомій полярності зв'язку, де електронна щільність поляризується до кисню. Розподіл електронної щільності ГОМО СО може пояснити це спостереження!
Зверніться до діаграми МО для СО. Визначте HOMO і поясніть, чому CO зв'язується з іонами металів через атом вуглецю, а не через атом кисню.
- Відповідь
-
У взаємодії між СО та іоном металу СО буде діяти як основа Льюїса; таким чином, він реагуватиме за допомогою електронів у своєму HOMO. Діаграма МО для СО показана на малюнку\(\PageIndex{1}\): HOMO - це\(3\sigma\) орбітальна (також обговорюється у. Електронна щільність цього МО зосереджена навколо атома вуглецю, таким чином атом вуглецю буде кращою основою Льюїса, ніж атом О.
