5.3.3: Іонні сполуки та молекулярні орбіталі
- Page ID
- 32850
Іонні взаємодії лежать в одній крайності на спектрі зв'язку. На протилежному кінці спектра знаходяться неполярні ковалентні зв'язки (наприклад, гомоядерна діатоміка). У цих молекулах молекулярні орбіталі утворені рівноенергетичними атомними орбіталями, в результаті чого електронна щільність рівномірно розподіляється по молекулі. В середині спектра знаходяться випадки полярних ковалентних зв'язків (наприклад, гетеронуклеарної діатоміки), в яких атомні орбіталі нерівних енергій неоднаково сприяють молекулярним орбіталям, що призводить до нерівномірного розподілу електронної щільності по молекулі. У випадку полярних зв'язків електронна щільність зміщується до більш електронегативного атома, оскільки цей атом більше сприяє молекулярним орбіталям, що зв'язують найнижчу енергію. Молекулярно-орбітальні діаграми можна намалювати для іонних сполук так, ніби вони є надзвичайно полярними зв'язками, в яких електрони не тільки зміщуються в бік, але і повністю переносяться на більш електронегативний атом.
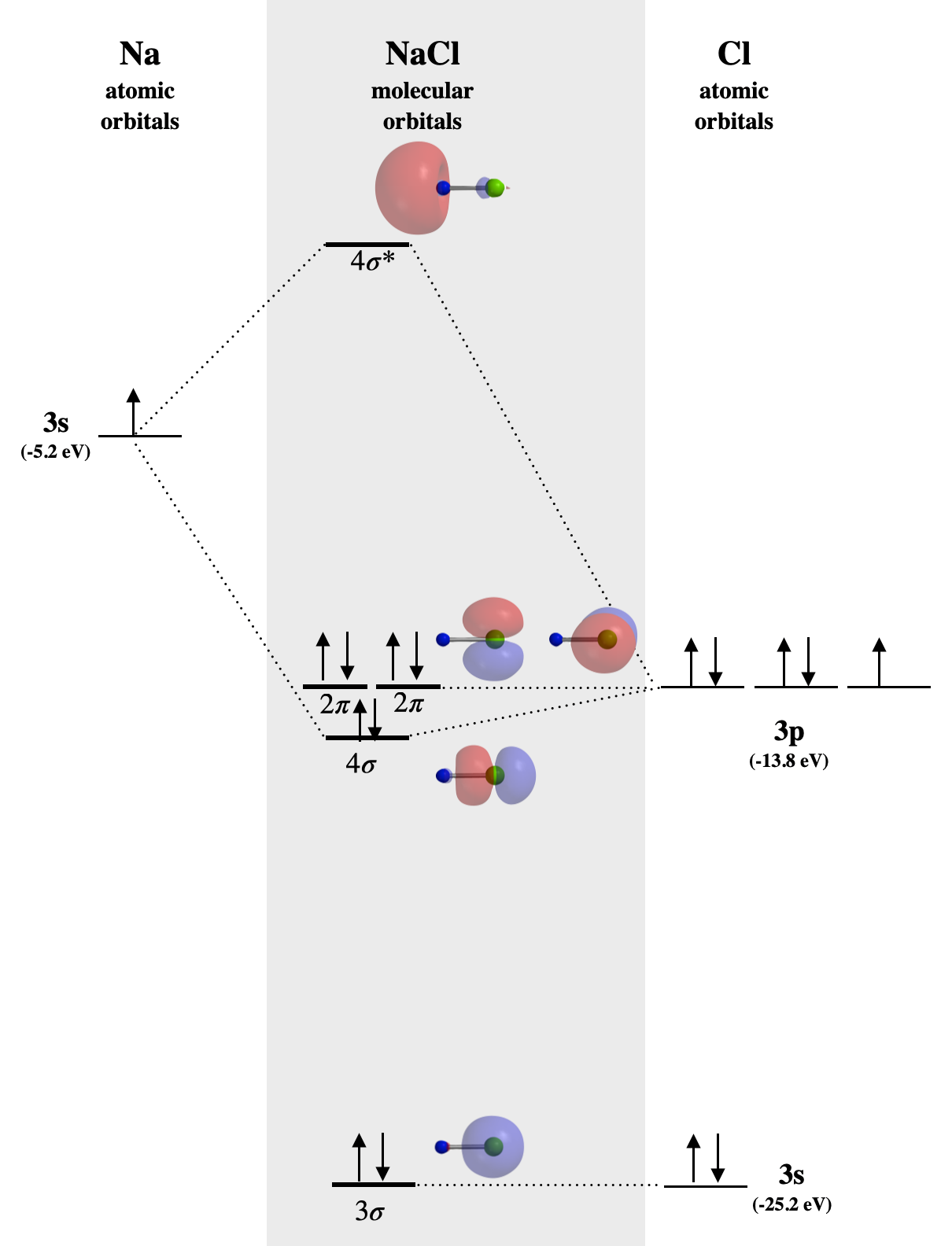
Приклад: NaCl
В\(\ce{NaCl}\)\(3s\) орбіталі натрію (-5,2 еВ) значно вища за енергією, ніж орбіталі валентності хлору. Хлор\(3s\) та\(3p_z\) орбіталі мають сумісну симетрію, але лише\(3p_z\) орбітальна (-13,8 еВ) досить близька за енергією, щоб взаємодіяти з Na\(3s\); все-таки різниця в енергії досить велика, щоб зробити зв'язок слабким. \(3s\)Орбітальна Na поєднується з Cl\(3p_z\), утворюючи молекулярні орбіталі,\(4\sigma\) позначені і на\(4\sigma^*\) малюнку\(\PageIndex{1}\). \(4\sigma\)Орбітальна слабо зв'язується, але дуже близька за енергією до\(3p_z\) орбіти Cl, і в основному має Cl-подібний характер. Зверніть увагу, що всі\(\sigma\) орбіталі дуже схожі на орбіталі\(s\) або\(p\) орбіталі, зосереджені на\(\ce{Cl}\) атомі, тоді як\(4\sigma^*\) орбітальна майже повністю зосереджена на Na. Відсутність молекулярних орбіталей, які розподіляються по обом атомам одночасно, узгоджується з відсутністю значного характеру ковалентного зв'язку в\(\ce{NaCl}\). Зв'язок тут характеризується перенесенням одного електрона від\(\ce{Na}\) до\(\ce{Cl}\) і є майже повністю електростатичним. Склеювання, яке в основному має електростатичний характер, є ненаправленим, на відміну від справжнього ковалентного зв'язку.
Намалюйте молекулярну орбітальну діаграму для\(\ce{LiF}\). Переконайтеся, що позначити всі молекулярні орбіталі належним чином, і вкажіть, чи є вони здебільшого склеюванням, несклеюванням або антібондингом. Визначте HOMO та LUMO. Намалюйте приблизні форми всіх орбіталів.
- Відповідь
-
Ми\(\ce{LiF}\) очікуємо бути іонною сполукою, оскільки різниця енергій валентних орбіталів становить щонайменше 10-14 еВ. (Див. Таблицю 5.3.1) Існують різні способи маркування молекулярних орбіталей. На малюнку нижче ми використовуємо конвенцію маркування кожного типу орбіталів числами, що починаються з орбіталей найнижчої енергії. \(1\sigma\)Орбітальна була б здебільшого F\(1s\) за характером і не показана. \(2\sigma\)Орбітальна в основному не зв'язується в природі, хоча вона має дуже невеликий внесок від\(2s\) Лі завдяки сумісній симетрії. \(3\sigma\)Орбітальна трохи зв'язується, але це здебільшого F\(2p\) за характером. Дві\(1\pi\) орбіталі повністю не склеюються. \(3\sigma^*\)Орбітальна є антібондингом.
- HOMO це\(1\pi\)
- ЛЮМО - це\(3\sigma^*\)
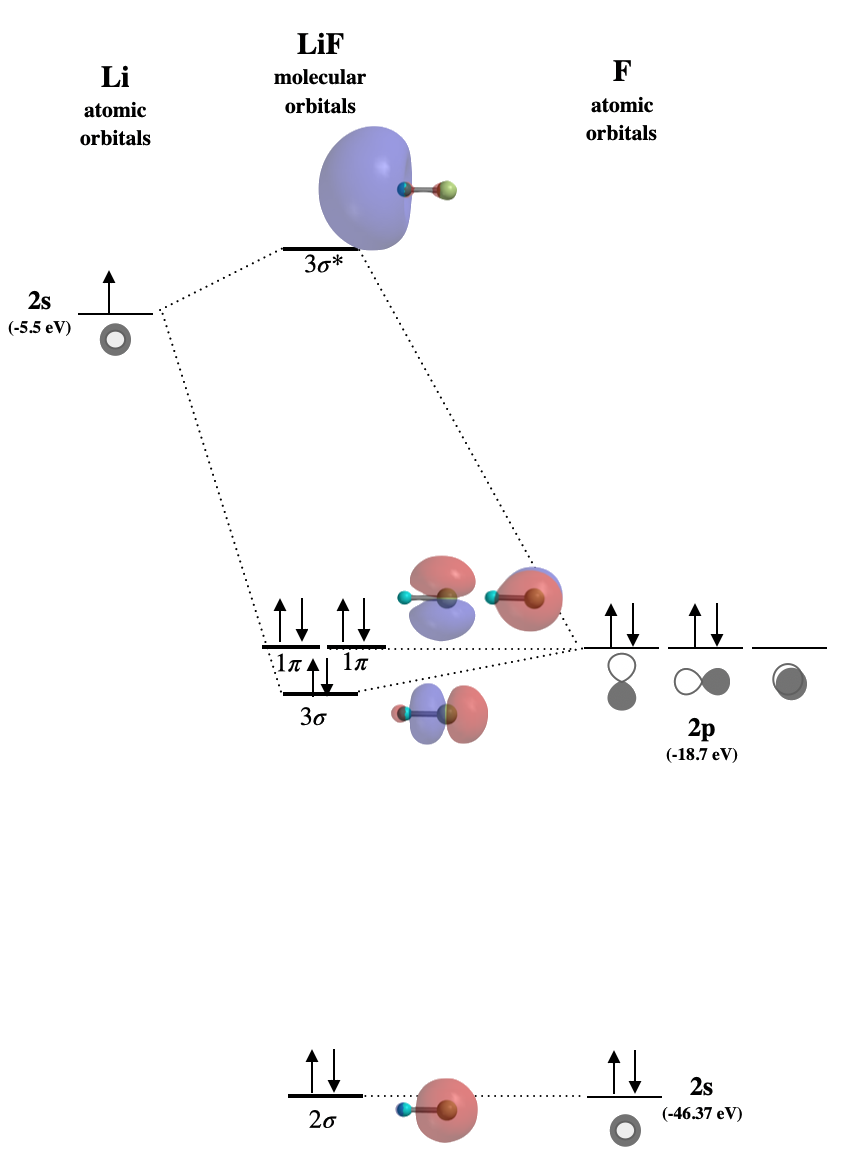
Малюнок для вправи\(\PageIndex{1}\): Молекулярна орбітальна діаграма для іонної сполуки, LiF. (CC-BY-NC-SA, Кетрін Хаас)
