3.3: Молекулярна полярність
- Page ID
- 33328
Дипольні моменти виникають, коли відбувається поділ заряду. Вони можуть виникати між двома іонами в іонному зв'язку або між атомами в ковалентному зв'язку; дипольні моменти виникають внаслідок відмінностей в електронегативності. Чим більше різниця в електронегативності, тим більше дипольний момент. Відстань між поділом заряду також є вирішальним фактором розміру дипольного моменту. Дипольний момент - це міра полярності молекули.
Вступ
Коли атоми в молекулі ділять електрони неоднаково, вони створюють те, що називається дипольним моментом. Це відбувається, коли один атом є більш електронегативним, ніж інший, що призводить до того, що атом тягне більш щільно на спільну пару електронів, або коли один атом має одиничну пару електронів і різницю точок вектора електронегативності таким же чином. Одним з найпоширеніших прикладів є молекула води, що складається з одного атома кисню та двох атомів водню. Відмінності електронегативності та одиноких електронів дають кисню частковий негативний заряд, а кожен водень - частковий позитивний заряд.
Дипольний момент
Коли два електричних заряду, протилежного знаку і рівної величини, розділені відстанню, встановлюється електричний диполь. Розмір диполя вимірюється його дипольним моментом (\(\mu\)). Момент падіння полюса вимірюється в дебайських одиницях, що дорівнює відстані між зарядами, помноженої на заряд (1 дебайський екв\(3.34 \times 10^{-30}\; C\, m\)). Дипольний момент молекули можна обчислити за рівнянням\(\ref{1}\):
\[ \vec{\mu} = \sum_i q_i \, \vec{r}_i \label{1}\]
де
- \(\vec{\mu}\)вектор дипольного моменту
- \(q_i\)це величина\(i^{th}\) заряду, і
- \(\vec{r}_i\)вектор, що представляє положення\(i^{th}\) заряду.
Дипольний момент діє в напрямку векторної величини. Приклад полярної молекули - s\(\ce{H_2O}\). Оскільки причиною єдиної пари на кисні, структура\(\ce{H_2O}\) згинається (через теорію VSEPR), що означає, що вектори, що представляють дипольний момент кожного зв'язку, не скасовують один одного. Значить, вода полярна.
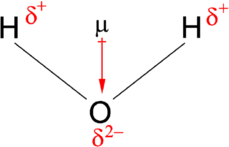
Вектор вказує від позитивного до негативного, як на молекулярний (чистий) дипольний момент, так і на окремі диполя зв'язку. Таблиця А2 показує електронегативність деяких загальних елементів. Чим більша різниця в електронегативності між двома атомами, тим більше електронегативною є зв'язок. Щоб вважатися полярним зв'язком, різниця в електронегативності повинна бути великою. Дипольний момент вказує у напрямку векторної величини кожної з електронегативностей зв'язку, доданих разом.
Виміряти дипольні моменти відносно легко: досить помістити речовину між зарядженими пластинами (рис.\(\PageIndex{2}\)); полярні молекули збільшують заряд, що зберігається на пластин, і дипольний момент можна отримати (тобто через ємність системи). Неполярний\(\ce{CCl_4}\) не відхиляється; помірно полярний ацетон відхиляється незначно; високополярна вода сильно відхиляється. Загалом, полярні молекули будуть вирівнюватися: (1) в електричному полі, (2) відносно один одного або (3) по відношенню до іонів (рис.\(\PageIndex{2}\)).
Рівняння\(\ref{1}\) може бути спрощено для простої відокремленої системи з двома зарядами, як двоатомні молекули, або при розгляді диполя зв'язку всередині молекули
\[ \mu_{diatomic} = Q \times r \label{1a}\]
Цей диполь зв'язку інтерпретується як диполь від поділу заряду на відстані\(r\) між частковими зарядами\(Q^+\) та\(Q^-\) (або більш часто вживаними термінами\(δ^+\) -\(δ^-\)); орієнтація диполя - вздовж осі зв'язку. Розглянемо просту систему з одного електрона і протона, розділених фіксованою відстанню. Коли протон і електрон знаходяться близько один до одного, дипольний момент (ступінь полярності) зменшується. Однак у міру того, як протон і електрон віддаляються, дипольний момент збільшується. У цьому випадку дипольний момент обчислюється як (через рівняння\(\ref{1a}\)):
\[\begin{align*} \mu &= Qr \nonumber \\[4pt] &= (1.60 \times 10^{-19}\, C)(1.00 \times 10^{-10} \,m) \nonumber \\[4pt] &= 1.60 \times 10^{-29} \,C \cdot m \label{2} \end{align*}\]
Дебая характеризує розмір дипольного моменту. Коли протон і електрон знаходяться на відстані 100pm один від одного, дипольний момент становить\(4.80\; D\):
\[\begin{align*} \mu &= (1.60 \times 10^{-29}\, C \cdot m) \left(\dfrac{1 \;D}{3.336 \times 10^{-30} \, C \cdot m} \right) \nonumber \\[4pt] &= 4.80\; D \label{3} \end{align*}\]
\(4.80\; D\)є ключовим еталонним значенням і являє собою чистий заряд +1 і -1, розділений на 100 пм. Якщо поділ заряду збільшено, то дипольний момент збільшується (лінійно):
- Якщо протон і електрон розділені на 120 пм:\[\mu = \dfrac{120}{100}(4.80\;D) = 5.76\, D \label{4a}\]
- Якщо протон і електрон розділені на 150 пм:\[\mu = \dfrac{150}{100}(4.80 \; D) = 7.20\, D \label{4b}\]
- Якщо протон і електрон розділені на 200 пм:\[\mu = \dfrac{200}{100}(4.80 \; D) = 9.60 \,D \label{4c}\]
Молекула води на малюнку\(\PageIndex{1}\) може бути використана для визначення напрямку та величини дипольного моменту. Від електронегативності кисню і водню різниця електронегативності становить 1,2 е для кожної з воднево-кисневих зв'язків. Далі, оскільки кисень є більш електронегативним атомом, він надає більшу тягу на спільні електрони; він також має дві одинокі пари електронів. З цього можна зробити висновок, що дипольний момент вказує між двома атомами водню до атома кисню. Використовуючи рівняння вище, дипольний момент обчислюється як 1,85 D шляхом множення відстані між атомами кисню і водню на різницю зарядів між ними, а потім знаходження компонентів кожної цієї точки в напрямку чистого дипольного моменту (кут молекули 104,5˚).
Момент зв'язку зв'язку зв'язку O-H = 1,5 D, тому чистий дипольний момент
\[\mu=2(1.5) \cos \left(\dfrac{104.5˚}{2}\right)=1.84\; D \nonumber\]
Полярність і структура молекул
Форма молекули і полярність її зв'язків визначають ЗАГАЛЬНУ ПОЛЯРНІСТЬ цієї молекули. Молекула, яка містить полярні зв'язки, може не мати загальної полярності, залежно від її форми. Просте визначення того, чи є складна молекула полярною чи ні, залежить від того, чи перекриваються її загальні центри позитивних і негативних зарядів. Якщо ці центри лежать в одній точці простору, то молекула не має загальної полярності (і неполярна). Якщо молекула повністю симетрична, то вектори дипольних моментів на кожній молекулі скасують один одного, роблячи молекулу неполярною. Молекула може бути полярною лише в тому випадку, якщо структура цієї молекули не симетрична.
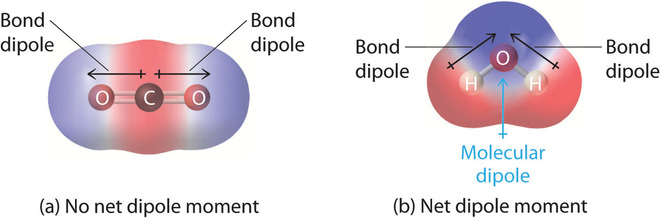
Хорошим прикладом неполярної молекули, яка містить полярні зв'язки, є вуглекислий газ (рис.\(\PageIndex{3a}\)). This is a linear molecule and each C=O bond is, in fact, polar. The central carbon will have a net positive charge, and the two outer oxygen atoms a net negative charge. However, since the molecule is linear, these two bond dipoles cancel each other out (i.e. the vector addition of the dipoles equals zero) and the overall molecule has a zero dipole moment (\(\mu=0\)).
Хоча полярний зв'язок є необхідною умовою для того, щоб молекула мала диполь, не всі молекули з полярними зв'язками виявляють диполі
Для\(AB_n\) молекулярного да, де\(A\) is the central atom and \(B\) are all the same types of atoms, there are certain molecular geometries which are symmetric. Therefore, they will have no dipole even if the bonds are polar. These geometries include linear, trigonal planar, tetrahedral, octahedral and trigonal bipyramid.
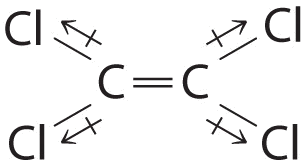
Хоча зв'язки C—Cl досить полярні, окремі диполі зв'язку скасовують один одного в цій симетричній структурі і\(\ce{Cl_2C=CCl_2}\) не мають чистого дипольного моменту.
C-Cl, ключовий полярний зв'язок, становить 178 вечора. Вимірювання виявляє 1.87 D. З цих даних можна обчислити% іонного характеру. Якщо цей зв'язок був 100% іонним (на основі протона та електрона),
\[\begin{align*} \mu &= \dfrac{178}{100}(4.80\; D) \nonumber \\[4pt] &= 8.54\; D \nonumber \end{align*} \]
Незважаючи на те, що довжина зв'язку збільшується, диполь зменшується, коли ви рухаєтеся вниз галогенної групи. Електронегативність зменшується, коли ми рухаємося вниз по групі. Таким чином, більший вплив надає електронегативність двох атомів (що впливає на заряд на кінцях диполя).
| З'єднання | Довжина облігації (Å) | Різниця електронегативності | Дипольний момент (D) |
|---|---|---|---|
| HF | 0,92 | 1.9 | 1.82 |
| HCl | 1.27 | 0.9 | 1.08 |
| HBr | 1.41 | 0.7 | 0.82 |
| ПРИВІТ | 1.61 | 0.4 | 0,44 |
Посилання
- Хаузкрофт, Кетрін Е. і Алан Г. Шарп. Неорганічна хімія. 3-е изд. Харлоу: Освіта Пірсона, 2008. Друк. (Сторінки 44-46)
- Tro, Nivaldo J. Хімія: Молекулярний підхід. Верхня річка Сідло: Освіта Пірсона, 2008. Друк. (Сторінки 379-386)
