3.4: Водневе склеювання
- Page ID
- 33317
Водневий зв'язок - це міжмолекулярна сила (МВФ), яка утворює особливий тип дипольно-дипольного тяжіння, коли атом водню, пов'язаний з сильно електронегативним атомом, існує поблизу іншого електронегативного атома з самотньою парою електронів. Між молекулами виникають міжмолекулярні сили (IMF). Інші приклади включають звичайні дипольно-дипольні взаємодії та сили дисперсії. Водневі зв'язки, як правило, сильніші, ніж звичайні дипольно-дипольні та дисперсійні сили, але слабкіші, ніж справжні ковалентні та іонні зв'язки.
Докази водневого зв'язку
Багато елементів утворюють сполуки з воднем. Якщо побудувати точки кипіння з'єднань елементів групи 14 з воднем, ви виявите, що температури кипіння збільшуються, коли ви йдете вниз по групі.
Збільшення температури кипіння відбувається тому, що молекули стають більшими з більшою кількістю електронів, і тому сили дисперсії ван дер Ваальса стають більшими. Якщо повторити цю вправу зі з'єднаннями елементів в групах 15, 16 і 17 з воднем, відбувається щось дивне.
Хоча це ж міркування стосується 4 групи Менделєєва таблиці, температура кипіння з'єднання водню з першим елементом в кожній групі аномально висока. У випадках\(NH_3\),\(H_2O\) і повинні\(HF\) бути деякі додаткові міжмолекулярні сили тяжіння, що вимагають значно більшої теплової енергії для розриву IMF. Ці відносно потужні міжмолекулярні сили описуються як водневі зв'язки.
Походження водневого зв'язку
До молекул, здатних зв'язуватися з воднем, відносяться наступні:
Зверніть увагу, що в кожній з цих молекул:
- Водень приєднується безпосередньо до високоелектронегативних атомів, внаслідок чого водень набуває високо позитивний заряд.
- Кожен з високоелектронегативних атомів досягає високого негативного заряду і має принаймні одну «активну» одиноку пару. Самотні пари на рівні 2 мають електрони, що містяться в відносно невеликому обсязі простору, що призводить до високої щільності негативного заряду. Самотні пари на більш високих рівнях є більш дифузними і, що призводить до меншої щільності заряду і меншої спорідненості до позитивного заряду.
Якщо ви не знайомі з електронегативністю, вам слід перейти за цим посиланням, перш ніж йти далі.
Розглянемо дві молекули води, що йдуть близько один до одного.
\(\delta^+\)Водень настільки сильно приваблює самотня пара, що майже так, ніби ви починаєте формувати координатний (давальний ковалентний) зв'язок. Це не заходить так далеко, але тяжіння значно сильніше, ніж звичайна дипольно-дипольна взаємодія. Водневі зв'язки мають близько десятої частини міцності середньої ковалентної зв'язку, і постійно розриваються і реформуються в рідкій воді. Якщо уподібнити ковалентний зв'язок між киснем і воднем до стабільного шлюбу, водневий зв'язок має статус «просто хороших друзів».
Вода є ідеальним прикладом водневого зв'язку. Зверніть увагу, що кожна молекула води потенційно може утворювати чотири водневі зв'язки з навколишніми молекулами води: дві з атомами водню і дві з атомами кисню. Існує точно правильна кількість\(\delta^+\) воднів і одиноких пар для кожного з них, щоб брати участь у водневому зв'язку.
Ось чому температура кипіння води вище, ніж у аміаку або фтористого водню. У випадку з аміаком кількість водневого зв'язку обмежена тим, що кожен азот має лише одну одиночну пару. У групі молекул аміаку недостатньо одиноких пар, щоб обійти, щоб задовольнити всі водні. У фтористого водню проблема полягає в нестачі водню. У воді дві водневі зв'язки і дві одинокі пари дозволяють утворювати взаємодії водневих зв'язків в решітці молекул води. Таким чином, вода вважається ідеальною системою, пов'язаною з воднем.
Більш складні приклади водневого зв'язку
Гідратація негативних іонів
Коли іонна речовина розчиняється у воді, молекули води скупчуються навколо відокремлених іонів. Цей процес називається гідратацією. Вода часто приєднується до позитивних іонів координатними (давальними ковалентними) зв'язками. Він зв'язується з негативними іонами за допомогою водневих зв'язків
Якщо вас цікавить зв'язок гідратованих позитивних іонів, ви можете перейти за цим посиланням для координатного (давального ковалентного) зв'язку.
На діаграмі показані потенційні водневі зв'язки, утворені іоном хлориду, Cl-. Хоча самотні пари в іоні хлориду знаходяться на рівні 3 і зазвичай не будуть достатньо активними для утворення водневих зв'язків, в цьому випадку вони стають більш привабливими завдяки повному негативному заряду на хлор.
Як би не був ускладнений негативний іон, завжди будуть одинокі пари, з якими атоми водню з молекул води можуть зв'язатися з воднем.
Водневе зв'язування в спиртах
Спирт - це органічна молекула, що містить групу -ОН. Будь-яка молекула, яка має атом водню, прикріплений безпосередньо до кисню або азоту, здатна зв'язуватися з воднем. Водневі зв'язки виникають і при зв'язуванні водню з фтором, але група ВЧ не з'являється в інших молекулах. Молекули з водневими зв'язками завжди матимуть вищу температуру кипіння, ніж молекули аналогічного розміру, які не мають групи -O-H або -N-H. Водневий зв'язок робить молекули «липкішими», так що для їх поділу потрібно більше тепла (енергії). Це явище може бути використано для аналізу температури кипіння різних молекул, визначеної як температура, при якій відбувається зміна фази від рідини до газу.
Етанол\(\ce{CH3CH2-O-H}\), і метоксиметан\(\ce{CH3-O-CH3}\), обидва мають однакову молекулярну формулу,\(\ce{C2H6O}\).
Вони мають однакову кількість електронів, і аналогічну довжину. Атракціони ван дер Ваальса (як сили розсіювання, так і диполь-дипольні атракціони) в кожному будуть схожі. Однак етанол має атом водню, прикріплений безпосередньо до кисню; тут кисень все ще має дві одинокі пари, як молекула води. Водень зв'язок може відбуватися між молекулами етанолу, хоча і не так ефективно, як у воді. Водневий зв'язок обмежується тим, що в кожній молекулі етанолу є тільки один водень з достатнім зарядом +.
У метоксиметані самотні пари на кисні все ще є, але водню недостатньо + для утворення водневих зв'язків. За винятком деяких досить незвичайних випадків, атом водню повинен бути приєднаний безпосередньо до самого електронегативного елементу для з'єднання водню. Точки кипіння етанолу та метоксиметану показують драматичний вплив водневого зв'язку на липкість молекул етанолу:
| етанол (з водневим зв'язком) | 78.5°C |
| метоксиметан (без водневого зв'язку) | -24.8°C |
Водневе з'єднання в етанолі підняло температуру кипіння близько 100° C. важливо розуміти, що водневий зв'язок існує на додаток до пам'яток ван дер Ваальса. Наприклад, всі наступні молекули містять однакову кількість електронів, а перші дві мають схожі довжини ланцюга. Більш висока температура кипіння бутан-1-ол обумовлена додатковим водневим зв'язком.
Порівнюючи два спирти (що містять групи -OH), обидві точки кипіння високі через додаткове водневе зв'язування; однак значення не однакові. Температура кипіння 2-метилпропан-1-ол не така висока, як бутан-1-ол, оскільки розгалуження в молекулі робить атракціони ван дер Ваальса менш ефективними, ніж у більш тривалих бутан-1-ол.
Водень зв'язку в органічних молекулах, що містять азо
Водневий зв'язок також відбувається в органічних молекулах, що містять N-H групи; згадати водневі зв'язки, що відбуваються з аміаком. Приклади варіюються від простих молекул, таких як CH 3 NH 2 (метиламін) до великих молекул, таких як білки та ДНК. Дві нитки знаменитої подвійної спіралі в ДНК утримуються водневими зв'язками між атомами водню, прикріпленими до азоту на одній нитці, і одинокими парами на іншому азоті або киснем на іншій.
Донори та акцептори
Для того, щоб відбувся водневий зв'язок, повинен бути присутнім як донор водню, так і акцептор. Донором у водневому зв'язку зазвичай є сильно електронегативний атом, такий як N, O або F, який ковалентно пов'язаний з водневим зв'язком.
Водневий акцептор - це електронегативний атом сусідньої молекули або іона, який містить одиничну пару, яка бере участь у водневому зв'язку.
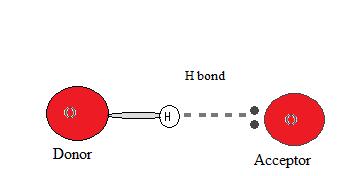
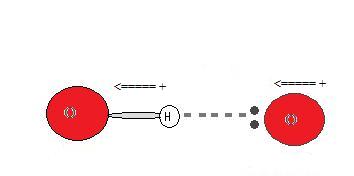
Чому виникає водневий зв'язок?
Оскільки донор водню (N, O або F) сильно електронегативний, він тягне ковалентно зв'язану електронну пару ближче до свого ядра і подалі від атома водню. Потім атом водню залишають з частковим позитивним зарядом, створюючи диполь-дипольне тяжіння між атомом водню, зв'язаним з донором, і самотньою електронною парою акцептора. Це призводить до утворення водневого зв'язку. (див. Взаємодія між молекулами з постійними диполями)
Види водневих зв'язків
Хоча водневі зв'язки добре відомі як тип МВФ, ці зв'язки також можуть відбуватися всередині однієї молекули, між двома однаковими молекулами або між двома різнорідними молекулами.
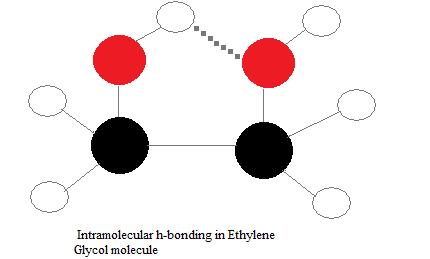
Внутрішньомолекулярні водневі зв'язки
Внутрішньомолекулярні водневі зв'язки - це ті, які відбуваються в межах однієї окремої молекули. Це відбувається, коли дві функціональні групи молекули можуть утворювати водневі зв'язки між собою. Для того щоб це сталося, обидва донора водню, акцептор водню повинні бути присутніми всередині однієї молекули, і вони повинні знаходитися в безпосередній близькості один від одного в молекулі. Наприклад, внутрішньомолекулярний водневий зв'язок відбувається в етиленгліколі (C 2 H 4 (OH) 2) між двома його гідроксильними групами завдяки молекулярній геометрії.
Міжмолекулярні водневі зв'язки
Міжмолекулярні водневі зв'язки відбуваються між окремими молекулами в речовині. Вони можуть виникати між будь-якою кількістю подібних або несхожих молекул до тих пір, поки донори водню і акцептори присутні в положеннях, де вони можуть взаємодіяти один з одним. Наприклад, міжмолекулярні водневі зв'язки можуть виникати між молекулами NH 3 поодинці, між молекулами H 2 O або між молекулами NH 3 і H 2 O.
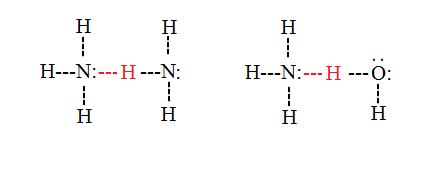
Властивості та ефекти водневих зв'язків
На точці кипіння
Коли ми розглядаємо точки кипіння молекул, ми зазвичай очікуємо, що молекули з більшими молярними масами матимуть вищі нормальні температури кипіння, ніж молекули з меншими молярними масами. Це, без урахування водневих зв'язків, обумовлено більшими силами дисперсії (див. Взаємодії між неполярними молекулами). Більші молекули мають більше місця для розподілу електронів і, таким чином, більше можливостей для миттєвого дипольного моменту. Однак, розглядаючи таблицю нижче, ми бачимо, що це не завжди так.
| З'єднання | Молярна маса | Нормальна температура кипіння |
|---|---|---|
| \(H_2O\) | 18 г/моль | 373 КМ |
| \(HF\) | 20 г/моль | 292.5 КМ |
| \(NH_3\) | 17 г/моль | 239.8 КМ |
| \(H_2S\) | 34 г/моль | 212.9 КМ |
| \(HCl\) | 36,4 г/моль | 197.9 КМ |
| \(PH_3\) | 34 г/моль | 185.2 КМ |
Ми бачимо, що H 2 O, HF та NH 3 мають більш високі температури кипіння, ніж та сама сполука, що утворюється між воднем та наступним елементом, що рухається вниз відповідною групою, вказуючи на те, що перші мають більші міжмолекулярні сили. Це пов'язано з тим, що H 2 O, HF та NH 3 демонструють водневий зв'язок, тоді як інші - ні. Крім того,\(H_2O\) має меншу молярну масу, ніж HF, але бере участь у більшій кількості водневих зв'язків на молекулу, тому її температура кипіння вища.
Про в'язкість
Той самий ефект, який спостерігається на температуру кипіння в результаті водневого зв'язку, може спостерігатися і у в'язкості деяких речовин. Речовини, здатні утворювати водневі зв'язки, як правило, мають більш високу в'язкість, ніж ті, які не утворюють водневих зв'язків. Як правило, речовини, які мають можливість множинних водневих зв'язків, виявляють ще більшу в'язкість.
Фактори, що перешкоджають водню
Електронегативність
Водневий зв'язок не може відбуватися без значних відмінностей електронегативності між воднем і атомом, з яким він пов'язаний. Таким чином, ми бачимо такі молекули, як PH 3, які не беруть участі у водневому зв'язку. PH 3 демонструє тригональну пірамідальну молекулярну геометрію, подібну до аміаку, але на відміну від NH 3 він не може зв'язатися з воднем. Це пов'язано зі схожістю в електронегативності фосфору і водню. Обидва атома мають електронегативність 2,1, і, таким чином, дипольного моменту немає. Це запобігає придбанню атомом водню часткового позитивного заряду, необхідного для зв'язку водню з самотньою електронною парою в іншій молекулі. (див. Поляризуваність)
Розмір атома
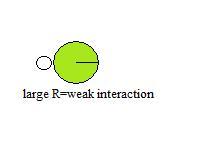
Розмір донорів і акцепторів також може впливати на здатність до водневого зв'язку. Це може пояснити порівняно низьку здатність Cl утворювати водневі зв'язки. Коли радіуси двох атомів сильно відрізняються або великі, їх ядра не можуть досягти безпосередньої близькості при взаємодії, що призводить до слабкої взаємодії.
Водень зв'язку в природі
Водневий зв'язок відіграє вирішальну роль у багатьох біологічних процесах і може враховувати багато природних явищ, таких як Незвичайні властивості води. Окрім присутності у воді, водневий зв'язок також важливий у водній транспортній системі рослин, вторинній та третинній білковій структурі та сполученні основи ДНК.
Рослини
Теорія зчеплення-адгезії транспорту в судинних рослині використовує водневий зв'язок для пояснення багатьох ключових компонентів руху води через ксилему рослини та інші судини. Усередині посудини молекули води водню зв'язуються не тільки один з одним, але і з целюлозним ланцюгом, що містить стінку рослинних клітин. Оскільки посудина відносно невелика, то тяжіння води до целюлозної стінки створює своєрідну капілярну трубку, що дозволяє здійснювати капілярну дію. Цей механізм дозволяє рослинам витягувати воду вгору в коріння. Крім того, водневий зв'язок може створити довгий ланцюг молекул води, яка може подолати силу тяжіння і подорожувати до великих висот листя.
Білки
Водневий зв'язок присутній рясно у вторинній структурі білків, а також економно в третинній конформації. Вторинна структура білка включає взаємодії (головним чином водневі зв'язки) між сусідніми поліпептидними магістралями, які містять азот-водневі зв'язані пари та атоми кисню. Оскільки і N, і O сильно електронегативні, атоми водню, пов'язані з азотом в одній поліпептидній магістралі, можуть зв'язуватися воднем з атомами кисню в іншому ланцюзі і навпаки. Хоча вони відносно слабкі, ці зв'язки забезпечують значну стабільність вторинної білкової структури, оскільки вони повторюються багато разів і працюють колективно.
У третинній білковій структурі взаємодії відбуваються в першу чергу між функціональними R групами поліпептидного ланцюга; одна така взаємодія називається гідрофобним взаємодією. Ці взаємодії відбуваються через водневий зв'язок між молекулами води навколо гідрофобу, що ще більше підсилює конформацію білка.
Посилання
- Браун та ін. Хімія: Центральна наука. 11-е изд. Верхня річка Сідло, Нью-Джерсі: Пірсон/Учень Холл, 2008.
- Чанг, Реймонд. Загальна хімія: Основні поняття. 3-е изд. Нью-Йорк: Макграу Хілл, 2003
- Петруччі та ін. Загальна хімія: принципи та сучасні програми. 9-е изд. Верхня річка Сідло, Нью-Джерсі: Пірсон/Учень Холл, 2007.