3.2: Відштовхування електронної пари валентної оболонки
- Page ID
- 33282
Вступ до ВСПР
Модель електронного відштовхування валентної оболонки (VSEPR) може передбачити структуру більшості молекул та багатоатомних іонів, в яких центральний атом є неметалом; вона також працює для деяких структур, в яких центральний атом є металом. VSEPR будується на електронних точкових структурах Льюїса (обговорюється в розділі 3.1); Тільки структури Льюїса передбачають лише зв'язок, тоді як структура Льюїса та VSEPR разом можуть передбачити геометрію кожного атома в молекулі. Основна ідея теорії VSEPR полягає в тому, що пари електронів (в зв'язках і в одиноких парах) відштовхують один одного. Пари електронів (в зв'язках і в одиночних парах) називаються «групами». Оскільки електрони відштовхуються один від одного електростатично, найбільш стійке розташування електронних груп (тобто тієї, що має найменшу енергію) - це те, що мінімізує відштовхування. Групи розташовуються навколо центрального атома таким чином, що виробляє молекулярну структуру з найменшою енергією. Іншими словами, відштовхування між групами навколо атома сприяє геометрії, в якій групи знаходяться якомога далі один від одного. Хоча ВСПР є спрощеним, оскільки не враховує тонкощів орбітальних взаємодій, що впливають на молекулярні форми, він точно прогнозує тривимірні структури великої кількості сполук.
Ми можемо використовувати модель VSEPR для прогнозування геометрії навколо атомів у багатоатомній молекулі або іоні, зосередившись на кількості електронних пар (груп) навколо центрального атома, що цікавить. Групи включають зв'язані та незв'язані електрони; одиночний зв'язок, подвійний зв'язок, потрійний зв'язок, одинока пара електронів або навіть один непарний електрон, кожен рахується як одна група. Молекулі або багатоатомному іону дано позначення A X m E n, де A - центральний атом, X - зв'язаний атом, E - a незв'язкова валентна електронна група (зазвичай одинична пара електронів), а m і n - цілі числа. Кількість груп дорівнює сумі m і n. Використовуючи цю інформацію, ми можемо описати молекулярну геометрію навколо центрального атома, тобто розташування зв'язаних атомів у молекулі або багатоатомному іоні. Геометрії, які прогнозуються з VSEPR, коли центральний атом має лише зв'язані групи (n = 0), наведені нижче в табл\(\PageIndex{1}\). Випадки, коли одинокі пари сприяють загальним групам (n\(\geq\) 1), обговорюються в наступному розділі про відштовхування одиноких пар.
|
Групи навколо центрального атома (м + п) |
Назва геометрії | Геометрія Ескіз | Прогнозований кут зв'язку | Приклад |
|---|---|---|---|---|
| 2 | лінійний | 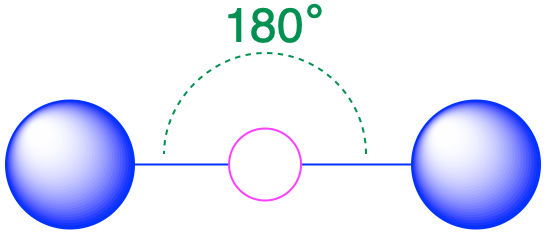 |
180° | 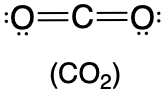 |
| 3 | тригональна площина | 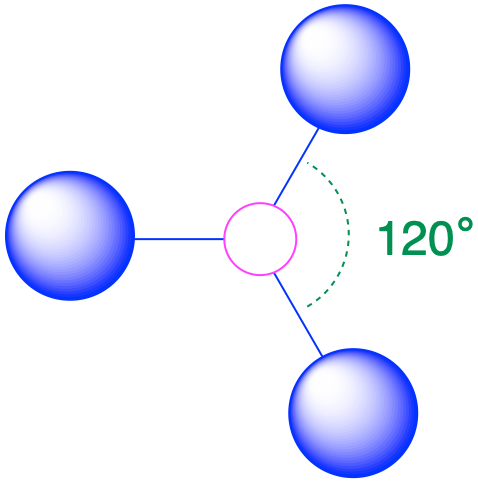 |
120° | 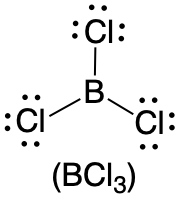 |
| 4 | тетраедр | 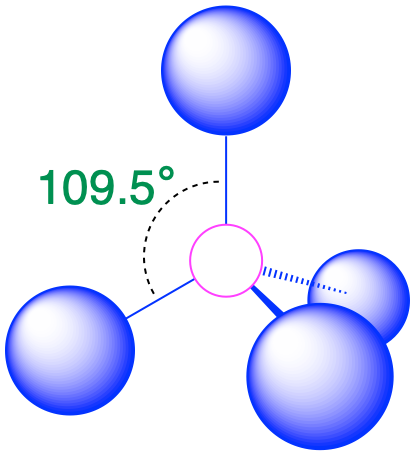 |
109.5° | 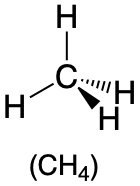 |
| 5 | тригональна біпіраміда | 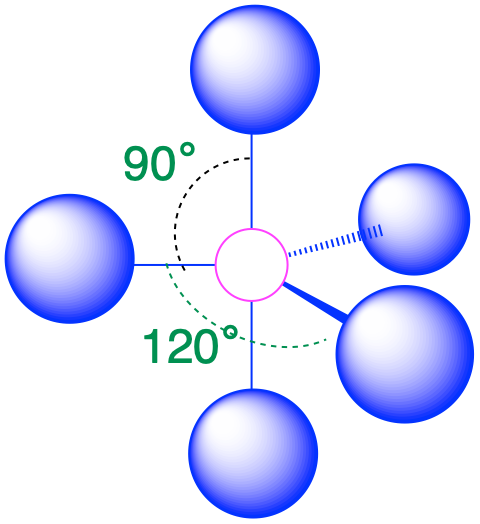 |
90° і 120° | 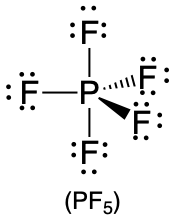 |
| 6 | октаедр | 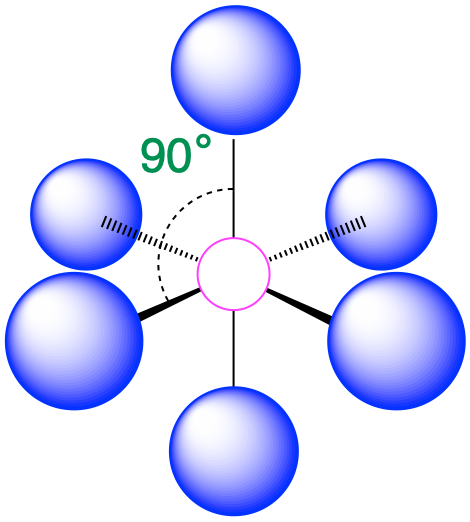 |
90° | 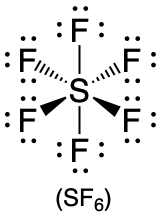 |
| 7 | п'ятикутна біпіраміда | 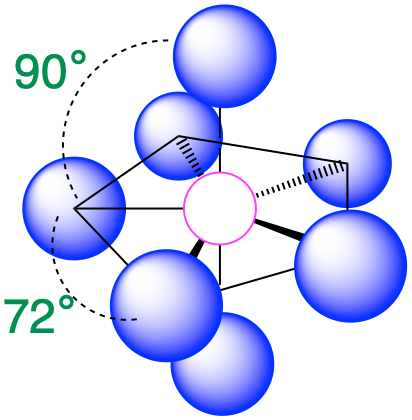 |
90° і 72° |  |
| 8 | квадратна антипризма | 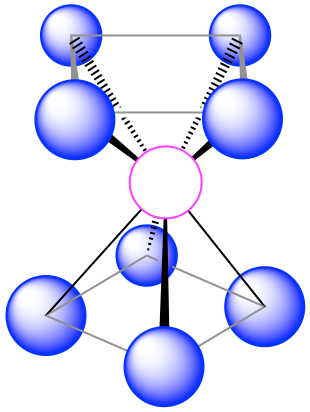 |
70.5°, 99,6° і 109.5° | 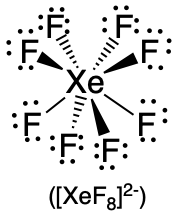 |
Практика
Ви можете виконати ці чотири кроки, щоб передбачити геометрію навколо атома за допомогою VSEPR:
- Намалюйте електронну структуру Льюїса молекули або багатоатомного іона.
- Для цікавить центрального атома призначте позначення AX m E n і загальне число груп (m + n).
- Визначте розташування електронної групи навколо центрального атома, що мінімізує відбиття.
- Опишіть молекулярну геометрію.
Скористайтеся процедурою вище, щоб виконати наведені нижче вправи
Прогнозуйте геометрію навколо центрального атома в BeH 2 і CO 2.
- Відповідь БеХ 2
-
1. Центральний атом, берилій, вносить два валентних електрона, і кожен атом водню вносить один. Електронна структура Льюїса

2. Навколо центрального атома є дві групи, і обидві групи є поодинокими зв'язками. Таким чином BeH 2 позначається як AX 2.
3. З таблиці ми бачимо\(\PageIndex{1}\), що розташування, яке мінімізує відбиття, розміщує групи на 180° один від одного.
4. З таблиці\(\PageIndex{1}\) ми бачимо, що з двома парами зв'язку молекулярна геометрія, яка мінімізує відбиття в BeH 2, є лінійною.
- Відповідь СО 2
-
1. Центральний атом, вуглець, вносить чотири валентні електрони, а кожен атом кисню вносить шість. Електронна структура Льюїса
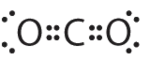
2. Атом вуглецю утворює дві подвійні зв'язки. Кожна подвійна зв'язок зараховується як одна група, тому навколо центрального атома є дві групи. Знову ж таки, обидві групи навколо центрального атома є зв'язками, тому СО 2 позначається як AX 2.
3. Як і BeH 2, розташування, яке мінімізує відбиття, розміщує групи на 180° один від одного.
4. VSEPR розпізнає лише групи навколо центрального атома (вуглецю). Таким чином, одинокі пари на атомах кисню не впливають на молекулярну геометрію. З двома зв'язаними групами на центральному атомі і без одиноких пар молекулярна геометрія СО 2 лінійна (табл.\(\PageIndex{1}\)). Структура системи\(\ce{CO2}\) наведена в табл\(\PageIndex{1}\).
Прогнозуйте геометрію навколо центрального атома в BCL 3 і CO 3 2-.
- Відповідь: BCL 3
-
1. Центральний атом, бор, вносить три валентні електрони, а кожен атом хлору вносить сім валентних електронів. Електронна структура Льюїса
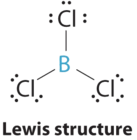
2. Навколо центрального атома є три групи, і всі вони є поодинокими зв'язками. Конструкція позначається як AX 3.
3. Щоб мінімізувати відбиття, групи розміщуються на відстані 120° один від одного (табл.\(\PageIndex{1}\)).
4. З таблиці\(\PageIndex{1}\) ми бачимо, що з трьома парами зв'язку навколо центрального атома молекулярна геометрія BCl 3 тригональна плоска.
- Відповідь СО 3 2
-
1. Центральний атом, вуглець, має чотири валентні електрони, а кожен атом кисню має шість валентних електронів. Електронна структура Льюїса однієї з трьох резонансних форм представлена у вигляді
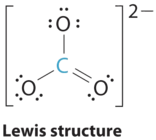
2. Структура СО 3 2− є резонансним гібридом. Він має три однакові зв'язки, кожна з яких має порядок зв'язку\(1 \frac{1}{3}\). Всі електронні групи є зв'язками. При трьох групах зв'язку навколо центрального атома структура позначається як AX 3.
3. Ми мінімізуємо відбиття, розміщуючи три групи на 120° один від одного (табл.\(\PageIndex{1}\)).
4. З таблиці видно\(\PageIndex{1}\), що молекулярна геометрія CO 3 2− тригональна плоска з кутами зв'язку 120°.
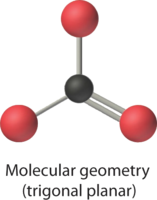
У нашому наступному прикладі ми вперше стикаємося з впливом одиноких пар і множинних зв'язків на молекулярну геометрію.
Прогнозуйте геометрію навколо центрального атома в CH 4, pCl 5 і SF 6.
- Відповідь: CH 4
-
1. Центральний атом, вуглець, вносить чотири валентні електрони, і кожен атом водню має один валентний електрон, тому повна електронна структура Льюїса
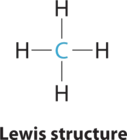
2. Навколо центрального атома є чотири групи електронів. Всі електронні групи є сполучними парами, тому структура позначається як AX 4.
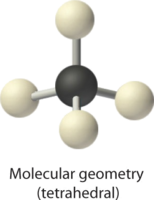
3. Як показано в таблиці\(\PageIndex{1}\), відбиття мінімізуються шляхом розміщення груп в кутах тетраедра з кутами зв'язку 109,5°.
4. При чотирьох сполучних парах молекулярна геометрія метану чотиригранна (табл.\(\PageIndex{1}\)).
- Відповідь: pCl 5
-
1. Фосфор має п'ять валентних електронів, а кожен хлор має сім валентних електронів, тому електронна структура Льюїса pCl 5 становить
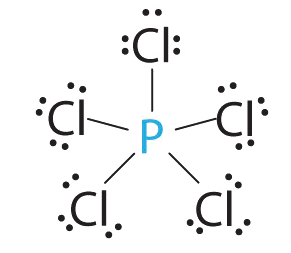
2. Навколо фосфору, центрального атома, існує п'ять груп зв'язку. Всі групи електронів є зв'язками, тому структура позначається як AX 5.
3. Структура, яка мінімізує відбиття, - це тригональна біпіраміда, яка складається з двох тригональних пірамід, які поділяють основу (табл.\(\PageIndex{1}\)).
4. Молекулярна геометрія pCl 5 тригональна біпірамідна, як показано нижче. Молекула має три атоми в площині в екваторіальних положеннях і два атоми вище і нижче площини в осьових положеннях. Три екваторіальні позиції відокремлені на 120° один від одного, а два осьові положення знаходяться на 90° до екваторіальної площини. Осьові та екваторіальні положення хімічно не еквівалентні.
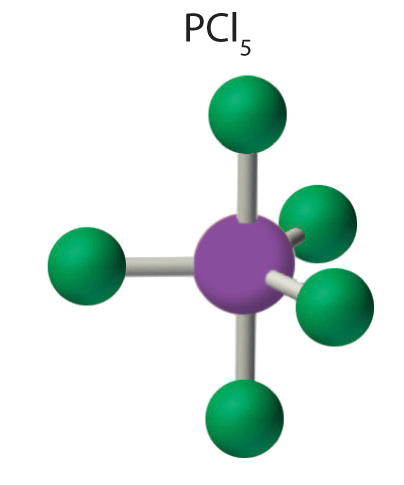
- Відповідь SF 6
-
1. Центральний атом, сірка, вносить шість валентних електронів, і кожен атом фтору має сім валентних електронів, тому електронна структура Льюїса
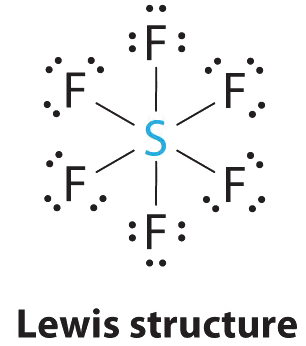
При розширеній валентності цей вид є винятком з правила октета.
2. Навколо центрального атома є шість електронних груп, кожна з яких є сполучною парою. Ми бачимо з малюнка\(\PageIndex{2}\), що геометрія, яка мінімізує відбиття, є восьмигранною.
3. Маючи лише склеювальні пари, SF 6 позначається як AX 6. Всі позиції хімічно еквівалентні, тому всі електронні взаємодії рівнозначні.
4. Ядер шість, тому молекулярна геометрія SF 6 - октаедрична.

