3.2.2: Кілька облігацій
- Page ID
- 33304
У попередніх розділах ми бачили, як передбачити приблизну геометрію навколо атома за допомогою теорії VSEPR, і ми дізналися, що самотні пари електронів трохи спотворюють кути зв'язку з «батьківською» геометрією. На цій сторінці розглядається вплив множинних (подвійних і потрійних) зв'язків між зв'язаними атомами.
Подвійні і потрійні зв'язки більш відразливі, ніж одиночні.
Теорія VSEPR передбачає, що подвійні і потрійні зв'язки мають сильніші сили відштовхування, ніж поодинокі зв'язки. Як і самотні пари електронів, множинні зв'язки займають більше місця навколо центрального атома, ніж один зв'язок. Результатом є те, що кути зв'язку трохи спотворюються порівняно з батьківською геометрією. Оскільки множинний зв'язок має більш високу електронну щільність, ніж один зв'язок, її електрони займають більше місця, ніж електрони одного зв'язку. Подвійні та потрійні зв'язки спотворюють кути зв'язків таким чином, як роблять самотні пари. Завдяки більш сильному відштовхуванню подвійні та потрійні зв'язки займають позиції, подібні до одиничних пар у групах з 5 і 6 електронними групами.
СН 2 О
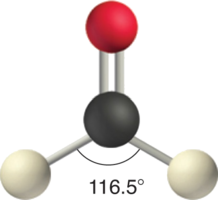
У такій молекулі, як CH 2 O (AX 3), структура якої показана нижче, подвійний зв'язок відштовхує поодинокі зв'язки сильніше, ніж поодинокі зв'язки відштовхують один одного. Це спричиняє відхилення від ідеальної геометрії (кут зв'язку Н—С—Н 116,5°, а не 120°).
2-метибутен
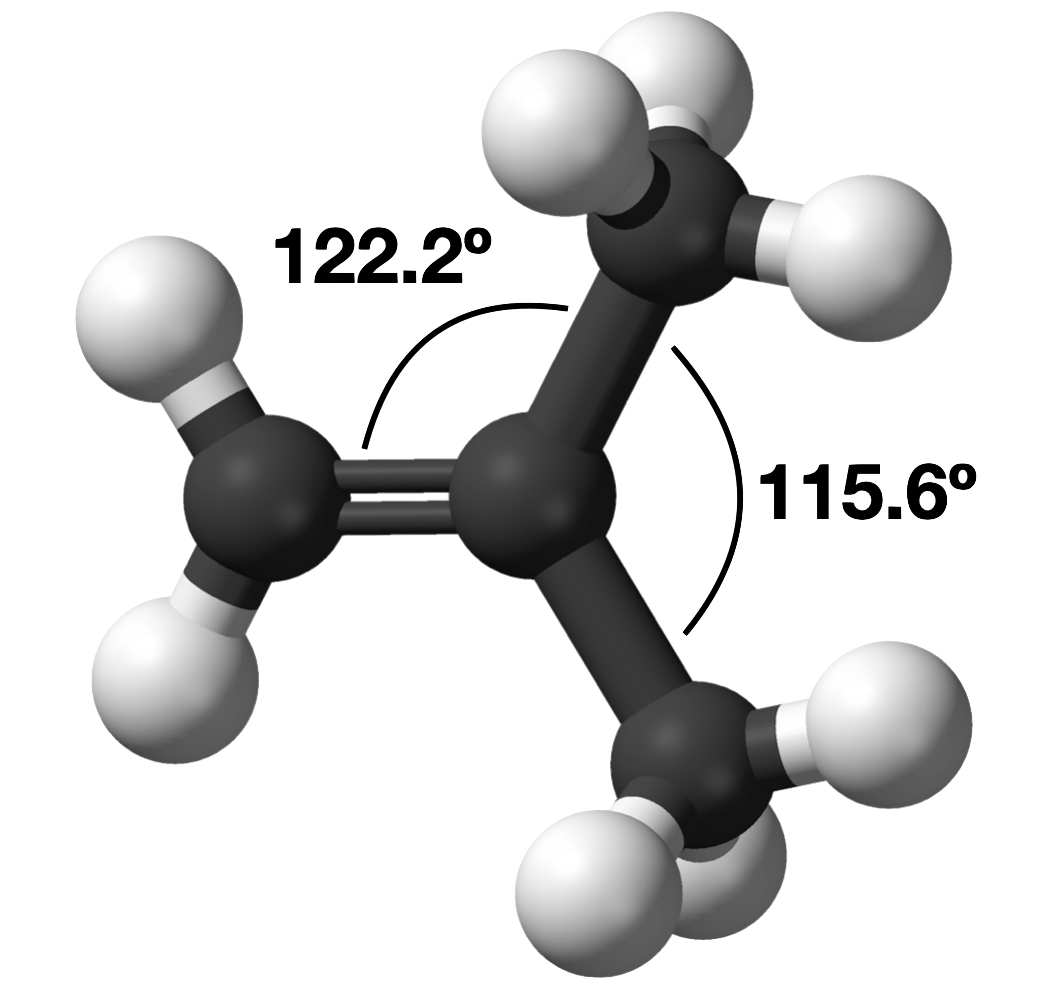
У молекулі CH 2 C (CH 3) 2 кут метил-С-метильного зв'язку становить 115,6°, що менше, ніж кут зв'язку 120°, який можна було б очікувати від батьківської геометрії. З іншого боку, кут зв'язку ацетил-С - метил більше 120°, з фактичним кутом зв'язку 122,2°.
Атоми як з одинокими парами, так і з множинними
Загалом, ми очікуємо, що самотня пара має трохи більшу силу відштовхування, ніж багаторазовий зв'язок, і що множинний зв'язок має трохи більшу силу відштовхування, ніж один зв'язок. Порядок очікуваної сили відштовхування становить:
\[\text{lone pair} > \text{double or triple bond} > \text{single bond} \nonumber \]
ІО 2 Ф 2
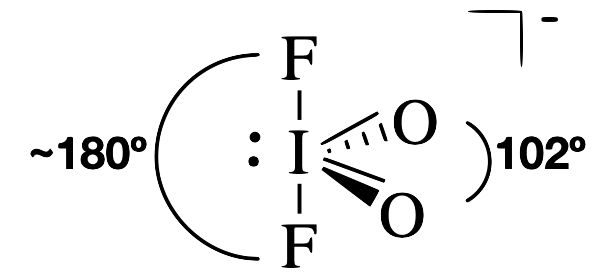
З п'ятьма електронними групами молекула IO 2 F 2 має приблизно тригональну біпірамідну електронну (батьківську) геометрію. Центральний атом йоду має єдиний зв'язок з кожним з атомів фтору, подвійний зв'язок з кожним киснем і одиночну пару. Самотня пара і подвійні зв'язки займуть більше місця навколо йоду, ніж кожна з одиночних зв'язків. Таким чином, ми очікуємо, що одинока пара і подвійні зв'язки займуть екваторіальні позиції навколо центрального йоду. Кут зв'язку O=I=O дорівнює 102° (набагато менший, ніж кут 120°, очікуваний від батьківської геометрії). Цей різко менший кут є результатом посиленого відштовхування між самотньою парою і подвійним зв'язком.
Езокол 2
З чотирма електронними групами молекула SeoCl 2 має чотири електронні групи і приблизно тетраедричну електронну (батьківську) геометрію. Він має як самотню пару, так і подвійну зв'язок на центральному атомі селену. Два атоми хлору поодиноко пов'язані з селеном, тоді як кисень подвійний. Самотня пара є найбільш відразливою, за нею йдуть подвійні зв'язки кисню, а потім хлорні зв'язки. Це дає кут зв'язку Cl—Se—Cl 97° та кут зв'язку Cl—Se—O 106°; обидва кути менші за кути 109,5°, очікувані для ідеальної чотиригранної геометрії.

Практика
Використовуйте теорію VSEPR для прогнозування геометрії та малювання структур наступного.
- Ексоф 4
- НІ 2
- СоКЛ 2
- ОФ 3
- Відповідь на
-
Ця молекула має шість електронних груп навколо центрального атома Xe (стеричне число 6) і, таким чином, має приблизно восьмигранну електронну (батьківську) геометрію. Існує подвійний зв'язок до O і одинока пара, обидві з яких є більш сильно відштовхуючими, ніж одиночні зв'язки до F. Подвійна зв'язок і одинока пара будуть прямо протилежні один одному, позначені як осьові позиції. В результаті виходить квадратна пірамідальна молекулярна геометрія. Теорія VSEPR прогнозує кути зв'язку F—Xe—F 90°. Як правило, одинокі пари трохи більш відразливі, ніж кілька зв'язків, і тому ми можемо очікувати, що кути зв'язку O—Xe—F становитимуть <90°; однак у цьому випадку фактичний кут зв'язку O—Xe—F спостерігається як 91° (ви не могли передбачити останнє).
F4.png)
- Відповідь б
-
Ця молекула має три групи електронів навколо центрального атома: одну одиночну пару і дві подвійні зв'язки з атомами кисню. Це призводить до приблизно тригональної планарної електронної (батьківської геометрії). Ми очікуємо, що самотня пара буде трохи більш відразливою, ніж подвійні зв'язки, і тому ми очікуємо, що кут зв'язку O—N—O буде трохи менше 120°. Фактичний кут O—N—O дорівнює 115°.
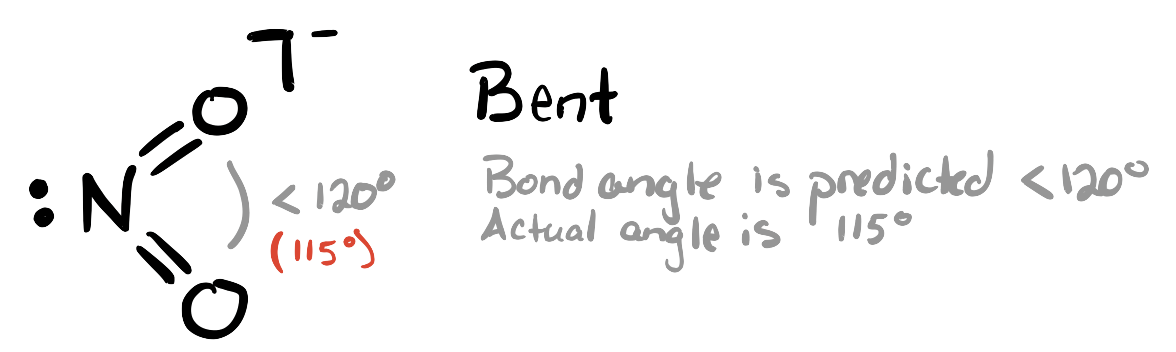
- Відповідь c
-
Ця молекула має чотири електронні групи (стеричне число 4) з приблизно чотиригранною електронною (батьківською) геометрією. Кожен подвійний пов'язаний кисень займе більше місця навколо центрального S, ніж одиночні зв'язані атоми Cl. Ми повинні очікувати, що подвійні зв'язки будуть відштовхувати один одного сильніше, ніж вони відштовхують кожну окрему зв'язок, причому найменш відразлива взаємодія буде між двома одиночними зв'язками. Очікується, що кут зв'язку для Cl—S—Cl становитиме <109,5° відповідно до теорії VSEPR (однак насправді це 111°). Ми очікуємо, що кут зв'язку для O—S—O буде більшим за кут для Cl———Cl та для Cl———O. Прогнозується, що кут зв'язку O—S—O становити>109,5° (а фактичний кут зв'язку 120°). Молекулярна геометрія являє собою спотворений тетраедр.

- Відповідь d
-
Ця молекула має п'ять електронних груп (стеричне число 5) з приблизно тригональної біпірамідної електронної (батьківської) геометрією. Існує одна одинока пара, подвійний зв'язок з O, і три одиночних зв'язку з атомами F навколо центрального атома I. Самотня пара і подвійний зв'язок є найбільш відразливими і повинні займати менш переповнені екваторіальні позиції, а не більш переповнені осьові позиції. Це призводить до молекулярної геометрії гойдалок. Оскільки більш відразлива одинока пара і найсильніша екваторіальна сила відштовхування знаходяться між подвійним зв'язком і самотньою парою, слід очікувати, що кут зв'язку F екваторіальний —I - O буде меншим, ніж кут 120°, очікуваний для батьківської геометрії (він насправді набагато менше, при 98°). Через відштовхування між осьовими атомами F і як самотньою парою, так і подвійним зв'язком, слід очікувати, що кути зв'язку F - S - F будуть стиснуті. F осьовий —I—F осьовий насправді 168°.

Посилання
- Місслер, Г.; Фішер, П.Й.; Тарр, Д. Неорганічна хімія. Нью-Джерсі: Прентіс-Холл. с. 55
