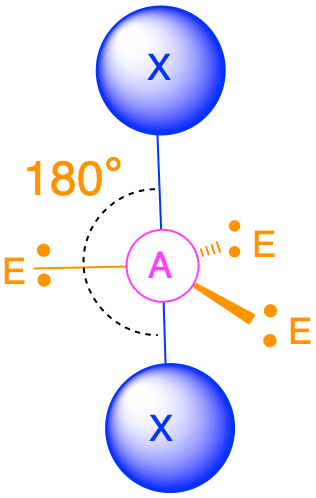
3.2.1: Відштовхування самотньої пари
- Page ID
- 33294
У попередньому розділі ми бачили, як використовувати VSEPR для прогнозування геометрії навколо центрального атома на основі кількості груп, прикріплених до центрального атома. Однак наша попередня дискусія обмежувалася простими випадками, коли всі групи були зв'язаними групами (тобто в позначенні A X m E n, n, n) = 0). Коли всі групи є зв'язками, геометрії можна передбачити, використовуючи інформацію в таблиці 3.2.1 попереднього розділу. Зараз ми розглянемо випадки, коли одна або кілька з цих груп є одинокими парами.
Самотні пари мають сильніші сили відштовхування, ніж зв'язані групи.
Коли одна або кілька груп є самотньою парою електронів (незв'язаних електронів), експериментально спостережувана геометрія навколо атома дещо відрізняється, ніж у випадку, коли всі групи є зв'язками. Фактичні кути зв'язку схожі, але не зовсім однакові, як ті, що прогнозуються на основі загальної кількості груп («батьківська» геометрія). Коли існує суміш групових типів (одиничні пари (E) та зв'язані групи (X)), слід враховувати три різних типи кутів: кути зв'язку між двома зв'язаними атомами (кути X-X), кути між зв'язаним атомом та самотньою парою ( X- E кути), і кути між двома одинокими парами (E-E кути). Емпіричні дані показують наступну тенденцію в ступені зв'язків кутів навколо атомів з сумішшю групових типів:
Тенденція в кутах зв'язку:
Е-Е> Х- Е > Х-Х
Використовуючи емпіричні докази як орієнтир, ми можемо передбачити, що одинокі пари відштовхують інші електронні групи сильніше, ніж зв'язані пари. Молекулярна геометрія молекул з одинокими парами електронів краще прогнозується, якщо врахувати, що електронне відштовхування, створене одинокими парами, сильніше, ніж відштовхування від зв'язаних груп. Складно передбачити точний кут зв'язку на основі цього принципу, але ми можемо передбачити приблизні кути, як описано і підсумовано нижче в табл\(\PageIndex{1}\).
| Електронні групи (m + n) | |||||
|---|---|---|---|---|---|
|
2 (стеричне число = 2) |
3 (стеричне число = 3) |
4 (стеричне число = 4) |
5 (стеричне число = 5) |
6 (стеричне число = 6) |
|
|
Батьківська геометрія (0 одиноких пар) А Х м |
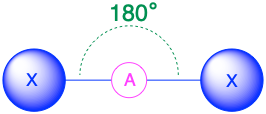
A X 2, лінійний 180° |
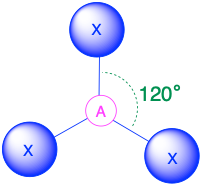
A X 3, триг. площині 120° |
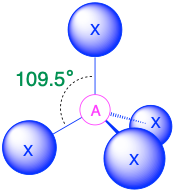
A X 4, тетраедр 109.5° |
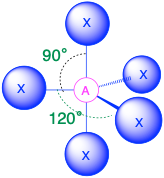
A X 5, триг. біпіраміда 90°, 120° |
A X 6, восьмигранник 90° |
|
1 самотня пара А Х м Е 1 |
А Х 2 Е 1, зігнутий <120° |
А Х 3 Е 1, триг. піраміда <109.5° |
A X 4 E 1, пила пила <90°, <120° |
А Х 5 Е 1, квадратна піраміда 90°, <90° |
|
|
2 самотні пари А Х м Е 2 |
А Х 2 Е 2, зігнутий <109.5° |
А Х 3 Е 2, Т-подібна форма <90° |
А Х 4 Е 2, квадратна площина 90° |
||
|
3 самотні пари А Х м Е 3 |
A X 2 E 3, лінійний 180° |
||||
Таблиця\(\PageIndex{1}\) узагальнює геометрії та кути зв'язку, передбачені для найближчих сусідніх зв'язаних груп на центральних атомах із сумішшю одиноких пар та зв'язаних груп. Таблиця не охоплює всі можливі ситуації; вона включає лише випадки, коли є дві зв'язані групи, в яких кут X-X вимірюється між найближчими сусідами. Більш докладний опис деяких обраних випадків наведено нижче.
Дві групи електронів (m + n = 2)
(Сферичне число = 2) У випадку, якщо навколо центрального атома є лише дві електронні групи, ці групи будуть лежати на 180° одна від одної. Це призводить до лінійної молекулярної геометрії з кутами зв'язку 180°.
Три групи електронів (m + n = 3)
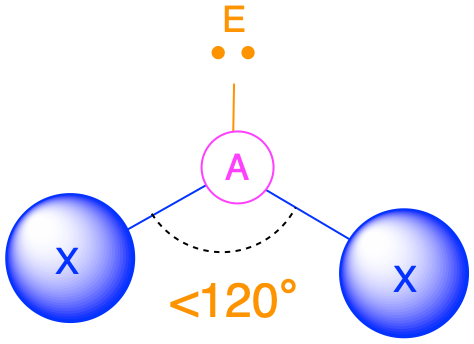
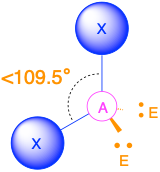
(Сферичне число = 3) У випадку, якщо навколо центрального атома є три електронні групи, ці групи будуть лежати приблизно на 120° одна від одної в просторі. Це призводить до електронної геометрії, яка приблизно тригональна плоска. Існує дві різні молекулярні геометрії, які можливі в цій категорії:
- Коли всі електронні групи є зв'язками (m = 3 або AX 3), молекулярна геометрія являє собою тригональну площину з кутами зв'язку 120°.
- Коли є одна одинока пара (m = 2, n = 1 або AX 2 E 1), молекулярна геометрія згинається з кутом зв'язку, який трохи менше 120°.
1. Центральний атом, сірка, має 6 валентних електронів, як і кожен атом кисню. З 18 валентними електронами електронна структура Льюїса показана нижче.
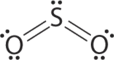
2. Навколо центрального атома є три групи електронів: дві подвійні зв'язки і одна одинока пара. Спочатку ми розміщуємо групи в тригональному плоскому розташуванні, щоб мінімізувати відбиття (табл.\(\PageIndex{1}\)).
3. При двох сполучних парах і одній одинокій парі структура позначається як AX 2 E. Це позначення має в цілому три електронні пари, дві Х і одну Е. Одинока пара займає більше місця навколо центрального атома, ніж сполучна пара (навіть подвійні зв'язки!). Склеювальні пари і одиночні пари відштовхуються один від одного електростатично в порядку BP—BP < LP—BP < LP—LP. У SO 2 ми маємо одну взаємодію BP-BP та дві взаємодії LP—BP.
4. Молекулярна геометрія описується тільки положеннями ядер, а не положеннями одиноких пар. Таким чином, з двома ядрами і однією самотньою парою форма вигнута, або V-подібна, що може розглядатися як тригональне плоске розташування з відсутньою вершиною. Очікується, що кут зв'язку O-S-O буде менше 120° через додатковий простір, зайнятий самотньою парою.
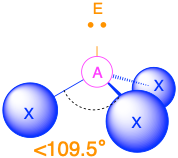
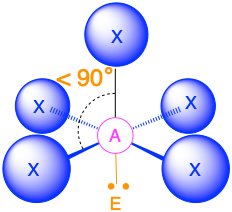
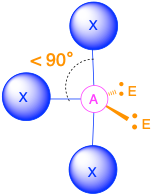
Чотири групи електронів (m + n = 4)
(Сферичне число = 4) У випадку, якщо навколо центрального атома є чотири електронні групи, ці групи будуть лежати приблизно на 109,5° одна від одної в просторі. Це призводить до електронної геометрії, яка приблизно чотиригранна. Існує три різні молекулярні геометрії, які можливі в цій категорії:
- Коли всі електронні групи є зв'язками (m = 4 або AX 4), молекулярна геометрія являє собою тетраедр з кутами зв'язку 109,5°.
- Коли існує одна одинока пара (m = 3, n = 1 або AX 3 E 1), молекулярна геометрія являє собою тригональну піраміду з кутами зв'язку трохи менше 109,5°.
- Коли є дві одинокі пари (m = 2, n = 2 або AX 2 E 2), молекулярна геометрія згинається з кутами зв'язку трохи менше 109,5°.
Одне з обмежень структур Льюїса полягає в тому, що вони зображують молекули та іони лише в двох вимірах. З чотирма електронними групами ми повинні навчитися показувати молекули та іони у трьох вимірах.
1. У аміаку центральний атом, азот, має п'ять валентних електронів, і кожен водень дарує один валентний електрон, створюючи електронну структуру Льюїса
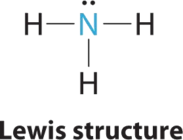
2. Навколо азоту є чотири групи електронів, три пари зв'язку та одна одинока пара. Відбиття зводяться до мінімуму, направляючи кожен атом водню і одиничну пару до кутів тетраедра.
3. З трьома парами зв'язку та однією самотньою парою структура позначається як AX 3 E. Це позначення має загалом чотири електронні пари, три X і одну E. Ми очікуємо, що взаємодії LP - BP призведе до того, що кути зв'язкових пар значно відхиляться від кутів ідеального тетраедра.
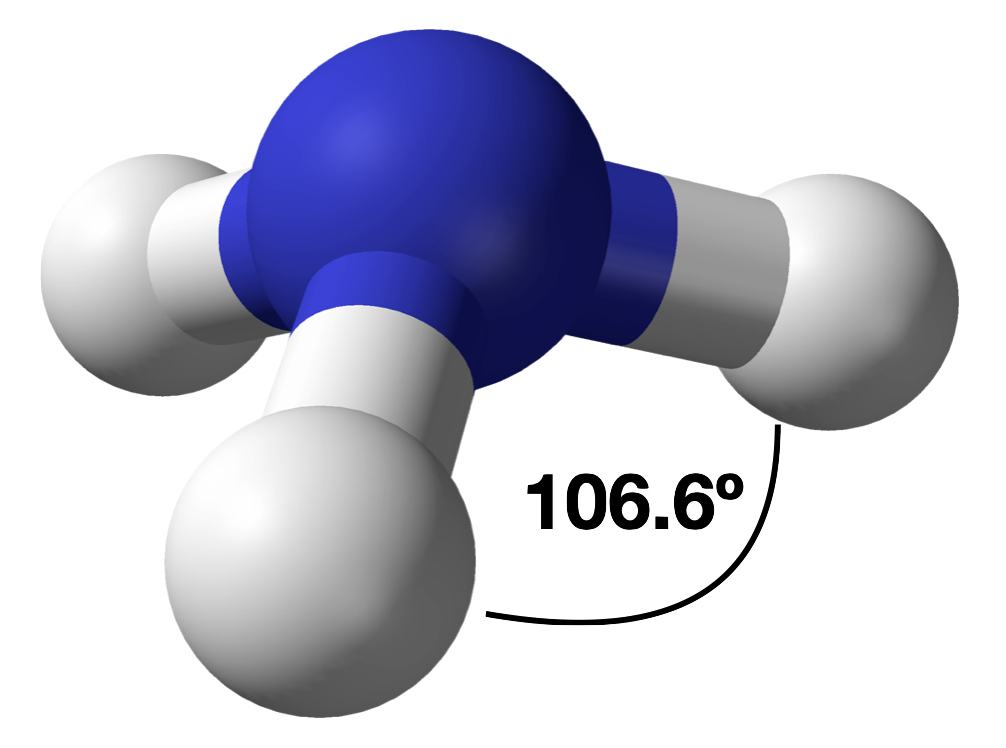
Різниця в просторі, зайнятому самотньою парою електронів і сполучною парою
Як і у випадку з SO 2, ця композитна модель розподілу електронів та негативного електростатичного потенціалу в аміаку показує, що одинока пара електронів займає більшу область простору навколо атома азоту, ніж зв'язуюча пара електронів, яка ділиться з атомом водню.
4. Є три ядра і одна одинока пара, тому молекулярна геометрія тригональна пірамідальна. По суті, це тетраедр з відсутньою вершиною. Однак кути зв'язку H—N—H менше ідеального кута 109,5° через відштовхування LP—BP. Кути зв'язку в аміаку складають 106,6°.
AX 2 E 2 Молекули: Приклад H 2 O
1. Кисень має шість валентних електронів, а кожен водень має один валентний електрон, створюючи електронну структуру Льюїса.
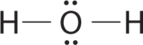
2. Навколо центрального атома кисню є чотири групи, дві пари зв'язку та дві одинокі пари. Відбиття зводяться до мінімуму, направляючи сполучні пари і самотні пари до кутів тетраедра.
3. З двома парами зв'язку і двома одинокими парами структура позначається як AX 2 E 2 із загальною кількістю чотирьох електронних пар. Через взаємодії LP—LP, LP—BP та BP-BP ми очікуємо значного відхилення від ідеалізованих чотиригранних кутів.
4. З двома атомами водню і двома одинокими парами електронів структура має значні одиночні парні взаємодії. Є два ядра навколо центрального атома, тому молекулярна форма вигнута, або V-подібна, з кутом H—O—H, який навіть менше, ніж кути H—N—H в NH 3, як ми очікували через наявність двох одиноких пар електронів на центральному атомі, а не однієї. Ця молекулярна форма по суті є тетраедр з двома відсутніми вершинами.

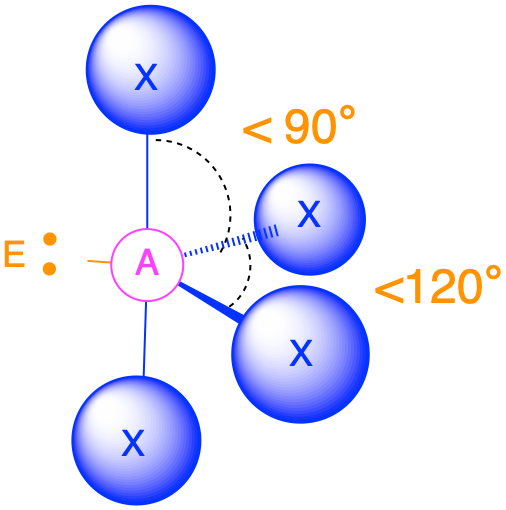
П'ять груп електронів (m + n = 5)
|
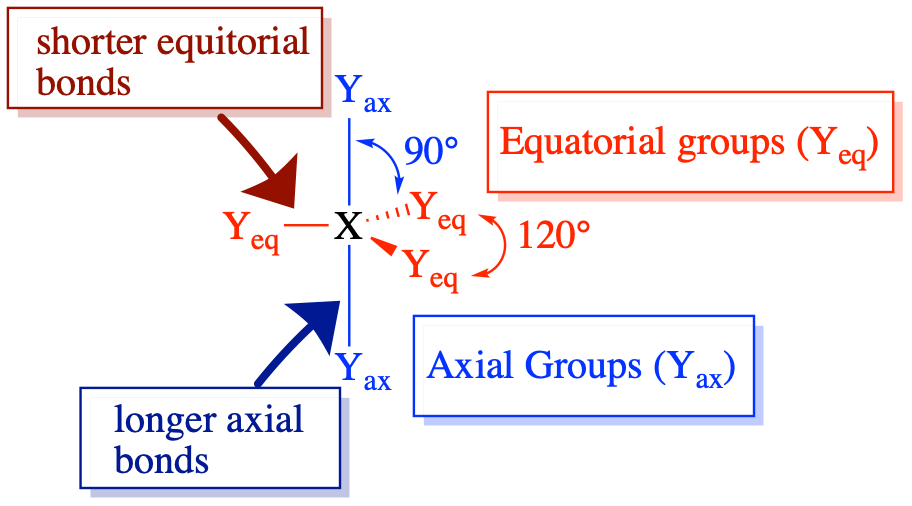
(Сферичне число = 5) У випадку, якщо навколо центрального атома є п'ять електронних груп, навколо центрального атома існує два різних типи положень: екваторіальні положення та осьові положення. Три екваторіальні ліганди знаходяться на 120° один від одного і знаходяться на 90° від кожного з двох осьових лігандів. Осьові положення мають три суміжні групи, орієнтовані на 90° в просторі. Осьові групи, таким чином, більш переповнені, ніж екваторіальні позиції, лише дві суміжні групи під 90°. Скупченість осьових положень призводить до незначних відмінностей у відстанях зв'язку; переповнені осьові групи мають довші зв'язки, ніж менш переповнені екваторіальні Самотні пари електронів, як правило, вважають за краще займати екваторіальні позиції, а не осьові позиції. Обґрунтування цієї переваги, згідно з теорією VSEPR, полягає в тому, що одинокі електронні пари є більш відразливими, ніж зв'язкові електронні пари, і, таким чином, самотні пари віддають перевагу менш переповненим екваторіальним положенням.
Розташування п'яти груп навколо центрального атома призводить до тригональної біпірамідної електронної геометрії. Існує чотири різні молекулярні геометрії, які можливі в цій категорії, залежно від кількості зв'язаних груп та одиноких пар електронів:
- Коли всі електронні групи є зв'язками (m = 5 або AX 5), молекулярна геометрія являє собою тригональну біпіраміду з кутами зв'язку 120° і 90° між сусідніми лігандами.
- Коли є одна одинока пара (m = 4, n = 1 або AX 4 E 1), одинока пара займає одну з екваторіальних позицій. Молекулярна геометрія називається пилкою з кутами зв'язку трохи менше 120° і трохи менше 90°.
- Коли є дві одинокі пари (m = 3, n = 2 або AX 3 E 2), кожна одинока пара займає одну з трьох екваторіальних позицій. Молекулярна геометрія має Т-подібну форму з кутами зв'язку трохи менше 120° і трохи менше 90°.
- Коли є три одинокі пари (m = 1, n = 3 або AX 3 E 2), одинокі пари займають три екваторіальні позиції. Молекулярна геометрія лінійна з кутами зв'язку 180°.
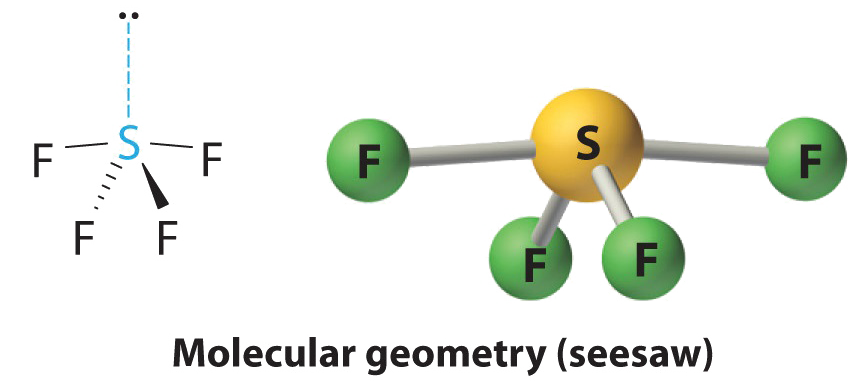
AX 4 E Молекули: SF 4
1. Атом сірки має шість валентних електронів, а кожен фтор має сім валентних електронів, тому електронна структура Льюїса

При розширеній валентності цей вид є винятком з правила октета.
2. Навколо сірки існує п'ять груп, чотири склеювальні пари та одна одинока пара. З п'ятьма електронними групами найнижчим енергетичним розташуванням є тригональна біпіраміда.
3. Ми позначаємо SF 4 як AX 4 E; він має загалом п'ять електронних пар. Однак, оскільки осьові та екваторіальні положення не є хімічно еквівалентними, де ми розміщуємо самотню пару? Якщо поставити одиноку пару в осьовому положенні, ми маємо три відбиття LP - BP при 90°. Якщо ми розмістимо його в екваторіальному положенні, ми маємо два відбиття 90° LP—BP при 90°. При меншій кількості відбитків LP—BP 90° ми можемо передбачити, що структура з самотньою парою електронів в екваторіальному положенні є більш стабільною, ніж структура з одинокою парою в осьовому положенні. Ми також очікуємо відхилення від ідеальної геометрії, оскільки одинока пара електронів займає більше місця, ніж сполучна пара.
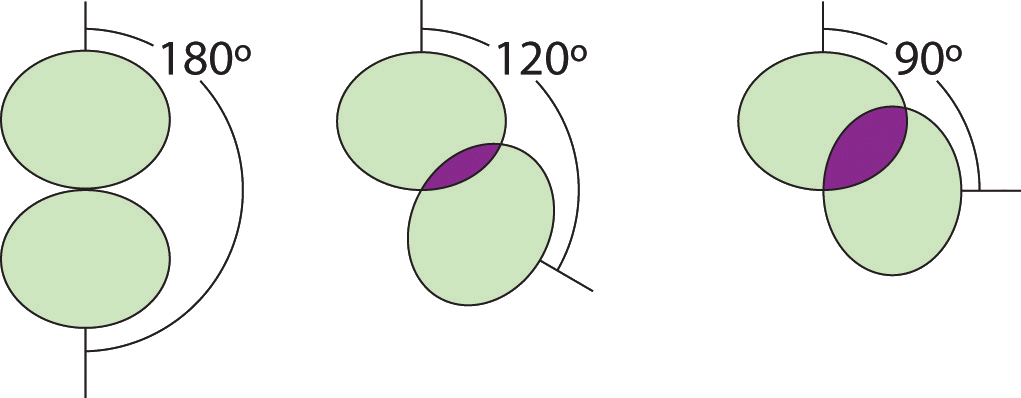
Ілюстрація площі, розділеної двома парами електронів проти кута між ними
При 90° дві електронні пари поділяють відносно велику область простору, що призводить до сильних відразливих взаємодій електрон-електрон.
4. З чотирма ядрами і однією самотньою парою електронів молекулярна структура заснована на тригональній біпіраміді з відсутньою екваторіальною вершиною; вона описується як гойдалка. Осьовий кут F ——F становить 173°, а не 180° через одиничну пару електронів в екваторіальній площині.
AX 3 Е 2 Молекули: BrF 3
1. Атом брому має сім валентних електронів, а кожен фтор має сім валентних електронів, тому електронна структура Льюїса
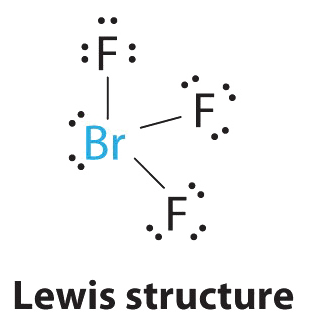
Знову ж таки, у нас є з'єднання, яке є винятком з правила октету.
2. Навколо центрального атома є п'ять груп, три пари зв'язку і дві одинокі пари. Ми знову направляємо групи до вершин тригональної біпіраміди.
3. При трьох парах зв'язку і двох одиноких парах структурне позначення - AX 3 E 2 загальною кількістю п'яти електронних пар. Оскільки осьові та екваторіальні позиції не є рівнозначними, ми повинні вирішити, як організувати групи, щоб мінімізувати відбиття. Якщо ми розмістимо обидві одинокі пари в осьових положеннях, ми маємо шість відштовхувань LP—BP при 90°. Якщо обидва знаходяться в екваторіальних позиціях, ми маємо чотири відбиття LP—BP на 90°. Якщо одна одинока пара осьова, а інша екваторіальна, ми маємо одне відштовхування LP-LP при 90° та три відбиття LP—BP при 90°:

Структура (c) може бути усунена, оскільки вона має взаємодію LP-LP при 90°. Структура (b), з меншою кількістю відштовхувань LP—BP при 90°, ніж (а), нижча за енергією. Однак ми прогнозуємо відхилення в кутах зв'язку через наявність двох одиноких пар електронів.
4. Три ядра в BrF 3 визначають його молекулярну структуру, яка описується як Т-подібна. Це, по суті, тригональна біпіраміда, в якій відсутні дві екваторіальні вершини. Осьовий кут F - Br—F становить 172°, менше 180° через відштовхування LP-BP.
Оскільки одинокі пари займають більше місця навколо центрального атома, ніж зв'язкові пари, електростатичні відбиття важливіші для одиноких пар, ніж для склеювальних пар.
AX 2 E 3 Молекули: I 3 −
1. Кожен атом йоду вносить сім електронів і негативний заряд один, тому електронна структура Льюїса
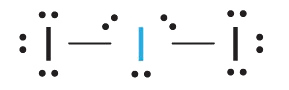
2. Існує п'ять електронних груп щодо центрального атома в I 3 −, дві пари зв'язку та три одинокі пари. Щоб мінімізувати відбиття, групи спрямовуються в кути тригональної біпіраміди.
3. З двома парами зв'язку та трьома одинокими парами I 3 − має загалом п'ять електронних пар і позначається як AX 2 E 3. Тепер ми повинні вирішити, як розташувати одинокі пари електронів у тригональній біпіраміді таким чином, щоб мінімізувати відбиття. Розміщення їх в екваторіальних положеннях усуває 90° LP—LP відбиття і мінімізує кількість відбитків LP—BP 90°.
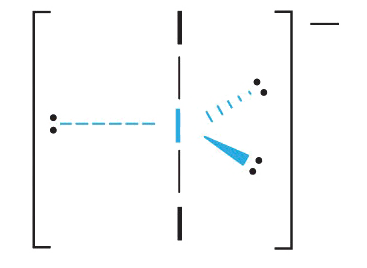
Три одинокі пари електронів мають еквівалентну взаємодію з трьома атомами йоду, тому ми не очікуємо відхилень у кутах зв'язку.
4. З трьома ядрами і трьома одинокими парами електронів молекулярна геометрія I 3 − лінійна. Це можна охарактеризувати як тригональну біпіраміду з відсутніми трьома екваторіальними вершинами. Іон має кут I—I—I 180°, як і очікувалося.
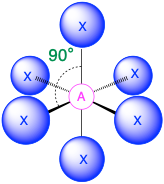
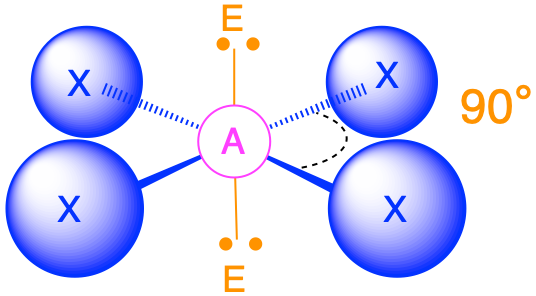
Шість груп електронів (m + n = 6)
(Сферичне число = 6) У випадку, якщо навколо центрального атома є шість електронних груп, найближчі групи будуть лежати приблизно на 90° одна від одної в просторі. Це призводить до електронної геометрії, яка приблизно октаедрична. У цій категорії є три відповідні молекулярні геометрії:
- Коли всі електронні групи є зв'язками (m = 6 або AX 6), молекулярна геометрія являє собою октаедр з кутами зв'язку 90° між сусідніми зв'язками.
- Коли є одна одинока пара (m = 5, n = 1 або AX 5 E 1), ми тепер розрізняємо осьові та еквіторні положення; одинока пара вважається в одному з осьових положень, тоді як зв'язок прямо протилежний одинокій парі є осьовим зв'язком. Молекулярна геометрія являє собою квадратну піраміду з кутами зв'язку 90° між сусідніми екваторіальними зв'язками і трохи менше 90° між осьовим зв'язком і екваторіальними групами
- Коли є дві одинокі пари (m = 4, n = 2 або AX 4 E 2), одинокі пари протилежні один одному і кожна займає осьове положення. Молекулярна геометрія - квадратна плоска з кутами зв'язку 90°.
AX 5 E Молекули: BrF 5
1. Центральний атом, бром, має сім валентних електронів, як і кожен фтор, тому електронна структура Льюїса
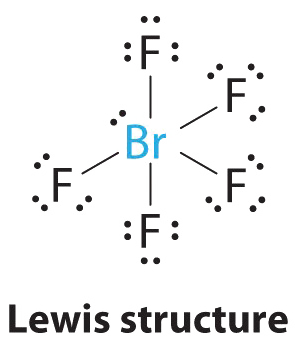
При розширеній валентності цей вид є винятком з правила октета.
2. Навколо Br існує шість електронних груп, п'ять пар зв'язку та одна одинока пара. Розміщення п'яти атомів F навколо Br при мінімізації відштовхувань BP-BP та LP—BP дає наступну структуру:
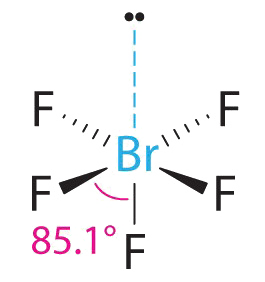
3. З п'ятьма парами зв'язку та однією самотньою парою BrF 5 позначається як AX 5 E; він має загалом шість електронних пар. Структура BrF 5 має чотири атоми фтору в площині в екваторіальному положенні і один атом фтору і одиничну пару електронів в осьових положеннях. Ми очікуємо, що всі F осьові —Br—F екваторіальні кути будуть менше 90° через одиничну пару електронів, яка займає більше місця, ніж зв'язкові електронні пари.
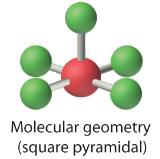
4. З п'ятьма ядрами, що оточують центральний атом, молекулярна структура заснована на октаедрі з відсутньою вершиною. Ця молекулярна структура є квадратною пірамідальною. F осьові —B—F екваторіальні кути становлять 85.1°, менше 90° через відбиття LP—BP.
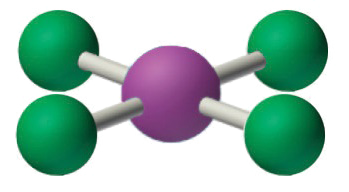
AX 4 E 2 Молекули: iCl 4 −
1. Центральний атом, йод, вносить сім електронів. Кожен хлор вносить сім, і є один негативний заряд. Електронна структура Льюїса є
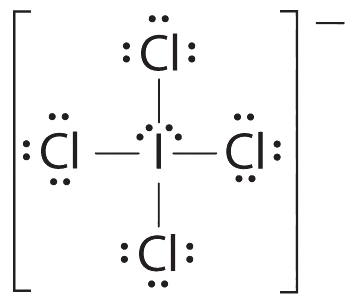
2. Навколо центрального атома є шість електронних груп, чотири пари зв'язку та дві одинокі пари. Структура, яка мінімізує відбиття LP—LP, LP—BP та BP-BP, є
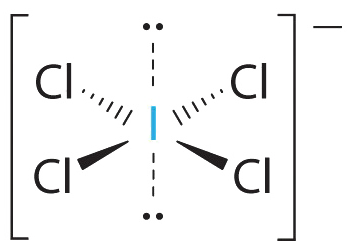
3. iCl 4 − позначається як AX 4 E 2 і має загалом шість електронних пар. Хоча існують одинокі пари електронів, з чотирма електронними парами зв'язку в екваторіальній площині та одинокими парами електронів в осьових положеннях, всі відбиття LP—BP однакові. Тому ми не очікуємо відхилення в кутах зв'язку Cl—I—Cl.
4. З п'ятьма ядрами іон ICl4 − утворює молекулярну структуру, яка є квадратною плоскою, октаедр з відсутніми двома протилежними вершинами.
Резюме
Розташування зв'язаних атомів у молекулі або багатоатомному іоні має вирішальне значення для розуміння хімії молекули, але електронні структури Льюїса не дають інформації про молекулярну геометрію. Модель відштовхування електрон-пари валентної оболонки (VSEPR) дозволяє передбачити, яка з можливих структур насправді спостерігається в більшості випадків. VSEPR заснований на припущенні, що пари електронів займають простір, а найбільш низькоенергетична структура - це та, яка мінімізує відбиття між парами електронів. У моделі VSEPR молекулі або багатоатомному іону дається позначення AX m E n, де A - центральний атом, X - зв'язаний атом, Е - незв'язкова валентна електронна група (зазвичай одинична пара електронів), а m і n - цілих чисел. Кожна група навколо центрального атома позначається як сполучна пара (ВР) або одинична (незв'язуюча) пара (ЛП). З взаємодії BP і LP ми можемо передбачити як відносне положення атомів, так і кути між зв'язками, звані кутами зв'язку. З цього ми можемо описати молекулярну геометрію. Модель VSEPR може бути використана для прогнозування форм багатьох молекул і багатоатомних іонів, але вона не дає інформації про довжину зв'язків і наявність множинних зв'язків. Комбінація VSEPR та моделі зв'язку, наприклад, електронних структур Льюїса, необхідна для розуміння наявності множинних зв'язків.
Зв'язок між кількістю електронних груп навколо центрального атома, кількістю одиноких пар електронів і молекулярною геометрією зведена в табл\(\PageIndex{1}\).
Приклади вправ
Використовуючи модель VSEPR, передбачити молекулярну геометрію кожної молекули або іона.
- PF 5 (пентафторид фосфору, каталізатор, який використовується в певних органічних реакціях)
- H 3 O + (іон водню)
Дано: два хімічних виду
Запитано: молекулярна геометрія
Стратегія:
- Намалюйте електронну структуру Льюїса молекули або багатоатомного іона.
- Визначте розташування електронної групи навколо центрального атома, що мінімізує відбиття.
- Призначте позначення AX m E n; потім ідентифікуйте взаємодії LP-LP, LP—BP або BP-BP та прогнозуйте відхилення в кутах зв'язку.
- Опишіть молекулярну геометрію.
Рішення:
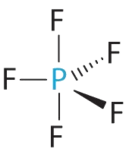
- A Центральний атом, P, має п'ять валентних електронів, і кожен фтор має сім валентних електронів, тому структура Льюїса PF 5 дорівнює
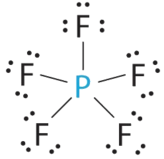
B Існує п'ять груп зв'язку про фосфор. Структура, яка мінімізує відбиття, - це тригональна біпіраміда.
C Всі групи електронів є сполучними парами, тому ПФ 5 позначається як AX 5. Зверніть увагу, що це дає загалом п'ять електронних пар. Не маючи самотніх парних відбитків, ми не очікуємо, що будь-які кути зв'язку відхиляться від ідеалу.
D Молекула PF 5 має п'ять ядер і не одиничні пари електронів, тому її молекулярна геометрія тригональна біпірамідна.
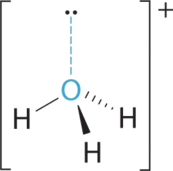
- A Центральний атом, O, має шість валентних електронів, і кожен атом Н вносить один валентний електрон. Віднімання одного електрона для позитивного заряду дає в цілому вісім валентних електронів, тому електронна структура Льюїса
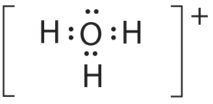
B Навколо кисню є чотири групи електронів, три пари зв'язку та одна одинока пара. Як і NH 3, відбиття мінімізуються шляхом направлення кожного атома водню та самотньої пари до кутів тетраедра.
C З трьома парами зв'язку та однією самотньою парою структура позначається як AX 3 E і має в цілому чотири електронні пари (три X і одну E). Ми очікуємо, що взаємодії LP-BP призведуть до того, що кути пари зв'язків значно відхиляться від кутів ідеального тетраедра.
D Є три ядра і одна одинока пара, тому молекулярна геометрія тригональна пірамідальна, по суті, тетраедр відсутній вершина. Однак кути зв'язку H—O—H менше ідеального кута 109.5° через відбиття LP—BP:
Використовуючи модель VSEPR, передбачити молекулярну геометрію кожної молекули або іона.
- xEO 3
- ПФ 6 −
- НІ 2 +
- Відповідь на
-
трикутна пірамідальна
- Відповідь б
-
восьмигранний
- Відповідь c
-
лінійний
Передбачте молекулярну геометрію кожної молекули.
- xEF 2
- SnCl 2
Дано: дві хімічні сполуки
Запитано: молекулярна геометрія
Стратегія:
Використовуйте стратегію, наведену в прикладі\(\PageIndex{1}\).
Рішення:
- Ксенон вносить вісім електронів і кожен фтор сім валентних електронів, тому електронна структура Льюїса

B Навколо центрального атома є п'ять електронних груп, дві пари зв'язку та три одинокі пари. Відбиття мінімізуються розміщенням груп у кутах трикутної біпіраміди.
C Від B, xEF 2 позначається як AX 2 E 3 і має в цілому п'ять електронних пар (дві X і три E). За допомогою трьох одиноких пар навколо центрального атома ми можемо організувати два атоми F трьома можливими способами: обидва атоми F можуть бути осьовими, один може бути осьовим і одним екваторіальним, або обидва можуть бути екваторіальними:
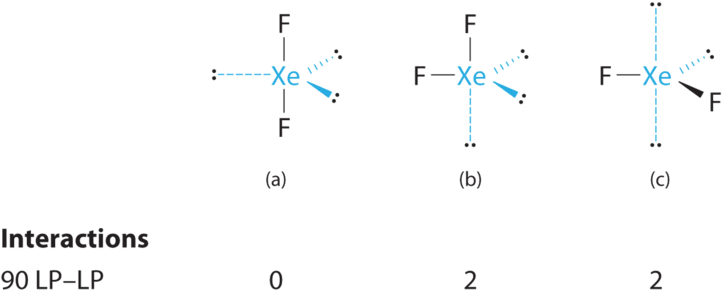
Структура з найменшою енергією - це та, яка мінімізує відбиття LP-LP. Обидва (b) і (c) мають дві взаємодії LP—LP 90°, тоді як структура (а) не має жодної. Таким чином, обидва атоми F знаходяться в осьових положеннях, як і два атоми йоду навколо центрального йоду в I 3 -. Усі взаємодії LP—BP еквівалентні, тому ми не очікуємо відхилення від ідеального 180° у куті зв'язку F—Xe—F.
D З двома ядрами близько центрального атома молекулярна геометрія xEF 2 лінійна. Це тригональна біпіраміда з трьома відсутніми екваторіальними вершинами.
- A Атом олова дарує 4 валентні електрони, а кожен атом хлору дарує 7 валентних електронів. З 18 валентними електронами електронна структура Льюїса становить
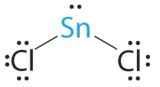
B Навколо центрального атома є три електронні групи, дві групи зв'язку та одна одинока пара електронів. Щоб мінімізувати відбиття, три групи спочатку розміщуються під кутом 120° один від одного.
C Від B ми позначаємо SnCl 2 як AX 2 E. Вона має загалом три електронні пари, дві X і одну E. Оскільки одинока пара електронів займає більше місця, ніж пари зв'язку, ми очікуємо зменшення кута зв'язку Cl—Sn—Cl через збільшення відбиття LP-BP.
D З двома ядрами навколо центрального атома і однією самотньою парою електронів молекулярна геометрія SnCl 2 вигнута, як SO 2, але з кутом зв'язку Cl—Sn—Cl 95°. Молекулярну геометрію можна описати як тригональне площинне розташування з відсутньою однією вершиною.
Передбачте молекулярну геометрію кожної молекули.
- ТАК 3
- ДеФ 4
- Відповідь на
-
тригональний планарний
- Відповідь б
-
квадратний плоский