3.2.3: Електронегативність та ефекти атомних розмірів
- Page ID
- 33293
Вступ
Ми бачили в попередніх розділах, як одинокі пари електронів і множинні зв'язки спотворюють кути зв'язку між нецентральними атомами (лігандами) навколо центрального атома. У цьому розділі описано, як електронегативність і розмір ліганду також впливають на кути зв'язку та молекулярну геометрію. Електронегативність, як правило, корелює з атомним розміром, що знижується будь-якої групи періодичної таблиці. Є деякі випадки, коли кути зв'язку можна передбачити за цими кореляціями. Однак розмір та електронегативність також можуть працювати як конкуруючі фактори при визначенні кутів зв'язку.
Визначення електронегативності
Лінус Паулінг ввів першу шкалу електронегативності в 1932 році для того, щоб пояснити додаткову стабільність молекул з полярними зв'язками. [1] Електронегативність атома, представлена грецькою літерою\(χ\) (chi), може бути визначена як тенденція атома притягувати електрони до себе в хімічному зв'язку. За шкалою Паулінга різниця електронегативності між двома атомами A і B була визначена в терміні енергій дисоціації E d зв'язків A-A, B-B і A-B:
\[\chi_{A} - \chi_{B} = \sqrt{E_{d}(AB) - [E_{d}(AA) + E_{d}(BB)]/2} \nonumber \]
де енергії виражаються в електронвольтах. Шкала електронегативності Паулінга коливається від фтору (найбільш електронегативний = 4,0) до Францію (найменший електронегативний = 0,7). [2,3] Полярність зв'язків і призначення формальних зарядів прогнозується різницями електронегативності.
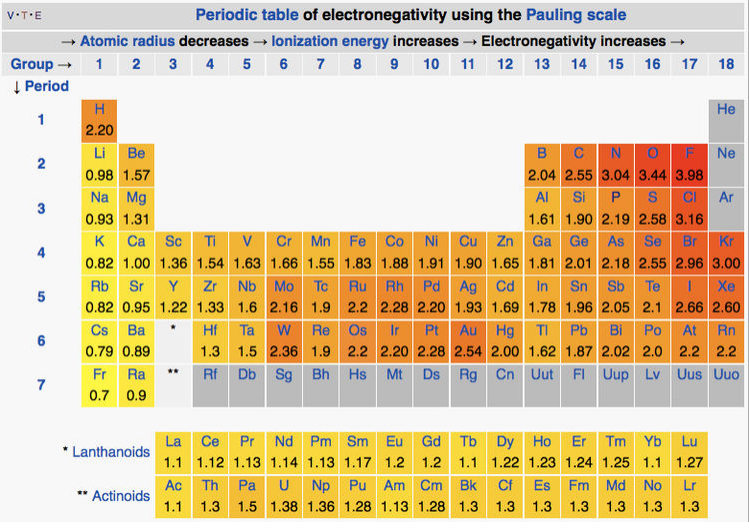
Хоча безпосередньо має відношення до міцності хімічних зв'язків, визначення Полінга електронегативності має істотне обмеження: для обчислення кожного значення потрібні дані з декількох сполук, в яких пов'язані конкретні атоми. Це означає, що шкала не може бути успішно застосована до будь-яких ситуацій. Для подолання цього обмеження були розроблені альтернативні шкали електронегативності на основі різних термохімічних вимірювань або розрахунків. Ці інші шкали наведені в таблиці нижче. Більш ретельні описи того, як обчислюються значення в кожній шкалі, описано на сторінці «Електронегативність» у Вікіпедії (клік), а коротка історія шкал електронегативності узагальнена у посиланні 4.
| Розробник масштабу | Рік вперше описаний | Характеристики |
|---|---|---|
| Лінус Полінг [1] | 1932 | На основі енергій зв'язку |
| Роберт Маллікен [5,6] | 1934 | На основі валентних електронних властивостей атомів (спорідненість електронів та енергія іонізації) |
| Луї Оллред та Євген Рохоу [7] | 1958 | На основі електростатичної сили (ефективного ядерного заряду) |
| Роберт Сандерсон [8] | 1983 | На основі атомної електронної щільності |
| Ральф Пірсон [9] | 1985 | Відноситься до Теорія на основі твердих м'яких кислот |
| Ліланд Аллен, Джозеф Манн, Террі Лі Мік [10,11,12] | 1989, 2000 |
Середні енергії іонізації електронів валентної оболонки, енергії конфігурації (СЕ)\[\mathrm{CE}=\frac{n \varepsilon_{s}+m \varepsilon_{p}}{n+m} \nonumber \]\(n = \text{number of s electrons}\) |
Основна перевага цієї шкали, розробленої Манном, Міком і Алленом [12], полягає в тому, що вона заснована на енергії конфігурації (СЕ), середніх енергій іонізації валентних електронів в наземному стані вільних атомів. Шкала, заснована на енергіях іонізації, може бути розрахована більш безпосередньо для будь-якого елемента. Однак критика всіх шкал електронегативності, включаючи цю, полягає в тому, що всі вони ґрунтуються на припущеннях, які в деяких випадках виходять з ладу.
Існує взаємозв'язок між електронегативністю та розміром атомів, оскільки обидва пов'язані з енергією іонізації. Як і енергія іонізації, існує загальна тенденція у періодичній таблиці як для електронегативності, так і для атомного розміру; загалом менші атоми у верхній правій частині періодичної таблиці мають більші значення електронегативності та менший атомний розмір. Нижче ми побачимо, що як електронегативність, так і атомний розмір впливають на кути зв'язку та абсолютну молекулярну геометрію навколо центрального атома. У деяких випадках розміри та електронегативність впливають вирівнюються; в деяких випадках ці ефекти конкурують.
Електронегативність і розмір впливу кутів зв'язку
Почнемо з вивчення кутів зв'язку декількох тригональних пірамідних молекул. Молекули, показані на\(\PageIndex{2}\) малюнку, мають три однакові «кулонні групи» на центральному атомі (рис.\(\PageIndex{2}\)). Підвісні атоми або підвісні групи - це атоми, або групи атомів, які пов'язані безпосередньо з центральним атомом. Молекули, показані тут, розташовані відповідно до розмірів центрального і підвісного атомів. Центральні атоми збільшуються в розмірах, спускаючись по цій фігурі, а підвісні атоми збільшуються в розмірах, переходячи зліва направо. Кути зв'язку та довжини зв'язків позначені в кожному випадку.
Які тенденції можна виділити?
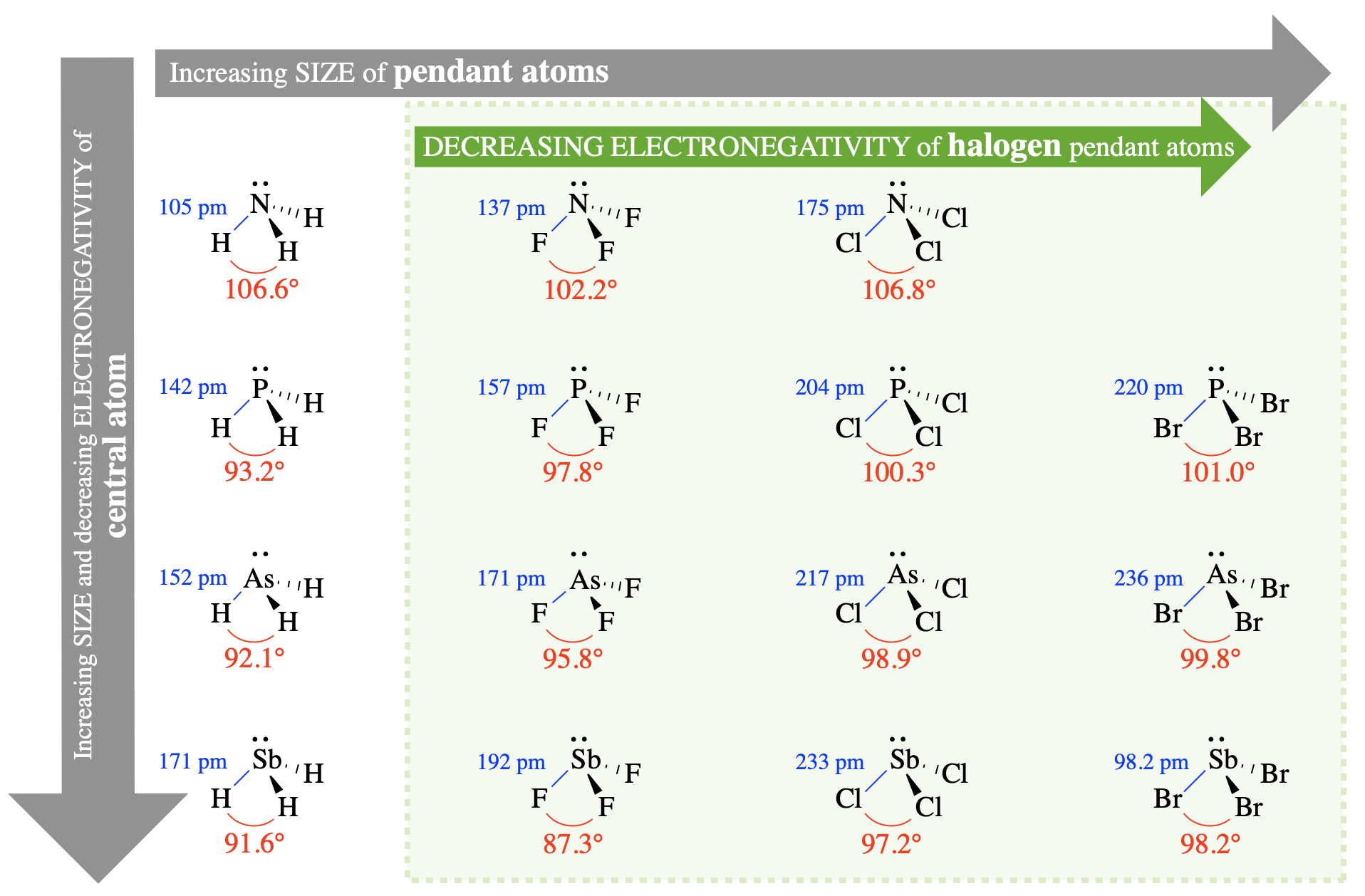
Тенденції розміру
Спочатку давайте розглянемо, як розмір центральної та підвісної груп може впливати на кут зв'язку. У теорії VSEPR розмір атомів (або груп атомів) впливатиме на кути зв'язку через зміни стеричних взаємодій між підвісними групами.
Розмір центрального атома
Вивчіть взаємозв'язок між розміром центрального атома і кутами зв'язку на малюнку\(\PageIndex{2}\) (спускаємося вниз будь-яким стовпчиком на малюнку). Наприклад, порівняйте NH 3, PH 3, AsH 3 та SbH 3 з кутами зв'язку 106,6°, 93,2°, 92,1° та 91,6° відповідно. У цьому ряду розмір центрального атома збільшується від N до Sb, тоді як розмір кулонного атома (водню) залишається постійним. Зі збільшенням розміру центрального атома кути зв'язку зменшуються; таким чином, ми спостерігаємо негативну залежність між розміром центрального атома і кутом зв'язку в цих молекулах. Цей зв'язок пояснюється стериками. Оскільки центральний атом збільшується в розмірах, довжини зв'язку також збільшуються, а підвісні атоми знаходяться далі один від одного в просторі. У теорії VSEPR це зменшить стеричні взаємодії між кулонними групами. Оскільки одинока пара на цих молекулах є більш відразливою, ніж зв'язані групи, зменшення стеричних взаємодій між зв'язаними групами призводить до зменшення кутів зв'язку.
Розмір підвісних атомів (або груп)
Вивчіть співвідношення між розміром атомів галогенного кулона та кутом зв'язку на малюнку\(\PageIndex{2}\) (перейдіть через будь-який рядок у затіненій області). Наприклад, порівняйте PF 3, pCl 3 та PBr 3 з кутами зв'язку 97,8°, 100,3° та 101,0° відповідно. У цій серії розмір кулонного атома збільшується від F до Br, тоді як центральний атом залишається постійним (фосфор). Зі збільшенням розміру підвісних атомів кут зв'язку збільшується; таким чином, ми спостерігаємо пряму залежність між розміром підвісної групи і кутом зв'язку в цих молекулах. Знову ж таки, ми можемо пояснити це за допомогою стериків. Зі збільшенням розміру кулонних атомів стерики між кулонними групами збільшуватимуться (незважаючи на невеликі зміни довжини зв'язку). Збільшення стеричних взаємодій між підвісними групами віддасть перевагу більшим кутам зв'язку між групами.
Однак ця тенденція зазнає невдачі, якщо розглядати молекули з воднем як кулонні атоми. Зверніть увагу, наприклад, що H є найменшим кулонним атомом. Якщо розглядати тенденцію, описану вище, слід припустити, що XH 3 (де X - змінний атом) мав би найменший кут зв'язку в рядах XH 3, XF 3, xCl 3 і xBr 3. Однак це не стосується NH 3, NF 3 та NCl 3, з кутами зв'язку 106,6°, 102,2° та 106,8° відповідно. Щоб пояснити варіацію цих кутів зв'язку, нам потрібно розглянути електронегативність.
Тенденції електронегативності
Тепер давайте розглянемо, як електронегативність впливає на кути зв'язку навколо центрального атома. У теорії VSEPR електронегативність атомів/груп впливатиме на кути зв'язку через зміни розподілу електронних пар навколо центрального атома (і, таким чином, зміни вираженості відштовхування електронної пари). Це дійсно зводиться до полярності зв'язку, викликаної різницею в електронегативності між центральним атомом і кулонними групами (полярність зв'язку в контексті теорії валентних зв'язків). У полярному зв'язку тим більше електронегативний атом потягне електронну щільність до себе. Коли кулонний атом є більш електронегативним, він буде тягнути зв'язану електронну пару до себе і подалі від центрального атома; це зменшить відштовхування електронної пари між зв'язаними електронними парами на центральному атомі. Зменшення відштовхування електронної пари на центральному атомі має зменшити кути зв'язку між групами (рис.\(\PageIndex{3}\)).
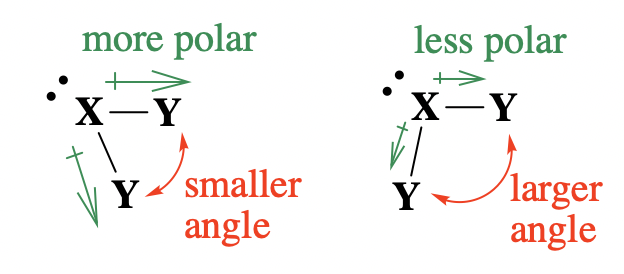
Електронегативність - альтернативне пояснення тенденцій, які ми вже розглянули вище на малюнку\(\PageIndex{2}\). Наприклад, коли ми порівнюємо атоми галогенних підвісок (затінена область на малюнку\(\PageIndex{2}\)), електронегативність кулонних груп зменшується, полярність зв'язків зменшується, а кути зв'язку збільшуються, йдуть зліва направо і від F до Br. Оскільки на центральному атомі залишається більша щільність електронів, відштовхування електронів між пов'язаними парами збільшується і кути зв'язку збільшуються.
Аргумент електронегативності також може бути використаний для пояснення того факту, що NH 3 (106,6°) має більший кут зв'язку, ніж NF 3 (102,2°). Цей конкретний випадок ілюструє, як електронегативність та розмір можуть бути конкуруючими факторами. Хоча відмінності електронегативності, здається, домінують у випадку NH 3 (106,6°) порівняно з NF 3 (102,2°), відмінності розмірів все ще домінують у випадках інших прикладів XH 3 та XF 3 на малюнку\(\PageIndex{2}\)).
Прогнозуйте геометрію і приблизні кути зв'язку. Потім помістіть молекули в кожному ряду в порядку найменшого до найбільшого кута зв'язку. Захистіть свою відповідь.
- Кут зв'язку X-S-X в OSF 2, SOCl 2, OsBr 2
- Н 2 О, Н 2 С, Н 2 Сб, Н 2 Вт
- Н 2 О, ОФ 2, ОФ 2
- Відповідь (а)
-
Геометрія та прогнозовані кути зв'язку: Це молекули зі стеричним числом 4. Вони можуть бути записані як дві різні резонансні структури, і резонансний гібрид мав би подвійний характер зв'язку між S і O.
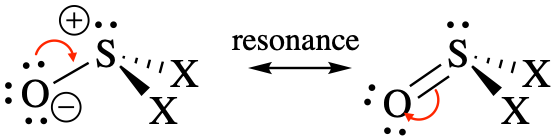
Ми очікуємо тригональної пірамідальної геометрії з усіма кутами зв'язку <109.5°, оскільки одинока пара є більш відразливою, ніж зв'язки. Оскільки подвійний зв'язок є більш відразливим, ніж одиночні зв'язки, ми також повинні очікувати, що кути зв'язку O-S-X будуть більшими, ніж кути зв'язку X-S-X.
Тенденція: Це серія молекул, яка змінюється в ідентичності кулонних атомів; варіація знаходиться в межах галогенів. Розмір галогенів збільшується, а електронегативність зменшується в порядку F, Cl, Br. Як розмір, так і електронегативність привели б нас до висновку, що кути зв'язку X-S-X збільшуватимуться в порядку OSF 2 < OsCl 2 < OsBr 2
Пояснення: (1) Підвищення електронегативності кулонного атома (F > Cl > Br) збільшує полярність зв'язку і зменшує електронну щільність зв'язаної пари на центральному атомі. Це зменшує e-e відбиття сусідніх зв'язаних електронних пар на S, дозволяючи галогенам стати ближче. Більш електронегативні підвісні атоми можуть мати менші кути зв'язку. (2) Збільшення розміру підвісних атомів (F < Cl < Br) збільшує стеричні відбиття і збільшує кут зв'язку. Обидва пояснення призводять до однієї і тієї ж прогнозованої тенденції.
Фактичні виміряні кути зв'язку X-S-X є OSF 2 (92,3°) /OScL 2 (96,2°) /OsBr 2 (98,2°). Тенденція в цих кутах зв'язку узгоджується з прогнозом.
- Відповідь (б)
-
Геометрія та прогнозовані кути зв'язку: Це молекули зі стеричним числом 4, зігнутою молекулярною геометрією, з прогнозованими кутами зв'язку <109,5°, оскільки дві одинокі пари є більш відразливими, ніж зв'язки. Навколо кожного центрального атома є дві одиночні пари та дві одиночні зв'язки до Н.
Тенденція: Це серія молекул, яка змінюється в ідентичності центрального атома. Центральний атом збільшується в порядку O < S < Se < Te, де Te є найбільшим елементом, а O - найменшим. Аргументи, засновані на розмірі, змусять нас передбачити, що підвісні групи H 2 Te будуть менш стерично переповнені і, таким чином, матимуть менший кут зв'язку, ніж підвісні групи H 2 O. Електронегативність зменшується в порядку O > S > S> Se > Te, де O є найбільш електронегативним елементом і Те найменше. Таким чином, ми очікуємо, що зв'язкові електропари будуть ближче до центрального атома на O, ніж вони були б на Te; ми повинні очікувати, що H 2 Te матиме найменші відбиття електронної пари і, таким чином, найменший кут зв'язку в цій серії, тоді як H 2 O матиме найсильніші відбиття електронної пари і найбільші кути скріплення.
Обидва аргументи призводять до того ж висновку, що порядок збільшення кута зв'язку дорівнює H 2 Te < H 2 Se < H 2 S < H 2 O.
Фактичні виміряні кути зв'язку є H 2 Te (90,2°) /H 2 Se (90,6°) /H 2 S (92,1°) /H 2 O (104,5). Тенденція в цих кутах зв'язку узгоджується з прогнозом.
- Відповідь (c)
-
Геометрія та прогнозовані кути зв'язку: Це молекули зі стеричним числом 4, зігнутою молекулярною геометрією, з прогнозованими кутами зв'язку <109,5°, оскільки дві одинокі пари є більш відразливими, ніж зв'язки. Навколо кожного центрального атома є дві одиночні пари та дві одиночні зв'язки до Н. (Це аналогічно випадку в (b)).
Тенденція: Це серія молекул, яка змінюється в ідентичності кулонних атомів; дві молекули мають галогени, а інша - атоми водню. Це випадок, коли розмір і електронегативність будуть суперечливими факторами, оскільки тенденції електронегативності не відображають тенденцію в розмірі.
- Розмір: Розмір підвісних атомів збільшується в порядку H < F < Cl, де H найменший, а Cl найбільший. Прогнозування кутів зв'язку на основі одного лише розміру призведе до прогнозованого порядку збільшення кута зв'язку H 2 O < OF 2 < OCl 2.
- Електронегативність: електронегативність зменшується в порядку F > Cl > H, де F має найбільшу електронегативність, а H - найменшу. Оскільки ми очікуємо, що найбільш електронегативні підвісні атоми матимуть найменші кути зв'язку, прогнозування, засноване лише на електронегативності, призведе до прогнозованого порядку збільшення кута зв'язку OF 2 < OCl 2 < H 2 O.
Наведені вище пункти ілюструють, як два різні аргументи призведуть до різних прогнозів щодо тенденції в куті зв'язку. Це ускладнює прогнозування фактичного порядку збільшення кута зв'язку. Однак ми бачили вище на прикладі NH 3 проти NF 3, що електронегативність важливіша за розмір; але у випадку NH 3 проти NCl 3 важливіший розмір кулонного атома. Якщо застосувати цей урок до поточної задачі, ми можемо передбачити порядок OF 2 < H 2 O < OCl 2, і насправді це більш нюансоване прогнозування, засноване на подібному випадку, відповідає фактичному порядку для виміряних кутів зв'язку: OF 2 (103.3°) < H 2 O (104. 5°) < Охолодження (110.9°).
Група: Електронегативність
Ви, напевно, чули терміни «група пожертвування електронів» та «група виведення електронів» з вашої курсової роботи з органічної хімії. Наприклад, кислота трифтороцтова кислота (TFA) є більш кислою, ніж оцтова кислота через ефекти виведення електронів групи CF 3 в порівнянні з СН 3. CF 3 - це група відведення електронів, тоді як CH 3 - група, що дорує електрони. Іншими словами, СФ 3 є більш електронегативним, ніж СН 3.
Здатність відведення електронів (електронегативність) груп можна оцінити і порівняти, так само, як і з атомами. Хоча немає жодної шкали, яка б використовувалася для групової електронегативності, і опубліковані значення навіть для одних і тих же груп широко різняться, існують достовірні тенденції всередині подібних груп. Ті ж розміри та фактори електронегативності, розглянуті вище, які впливають на кути зв'язку для підвісних атомів, також можуть бути використані для раціоналізації спотворених кутів зв'язку для підвісних груп навколо центрального атома.
Розглянемо відносні електронегативності і розміри підвісних атомів/груп в наступних прикладах. Чи є тенденція в кутах зв'язку, що ви очікуєте від відносної групи електронегативності та відносних розмірів? Що, якщо такий є, є більш домінуючим фактором при визначенні тенденції?
- N (CH 3) 3 має кут зв'язку C-N-C 110,9°, тоді як N (CF 3) 3 має кут зв'язку 117,9°.
- Кути зв'язку X-S-X у молекулах форми SO 2 (X) 2 становлять: SO 2 (OH) 2 101,3°; SO 2 (CF 3) 2 102,0°; SO 2 (CH 3) 2 102,6°.
- Відповідь (а)
-
Додайте сюди тексти. Не видаляйте цей текст спочатку.
- Відповідь (б)
-
Додайте сюди тексти. Не видаляйте цей текст спочатку.
Особливий випадок електронегативності та розміру в стеричному числі 5 (тригональна піраміда)
Молекули зі стеричним числом 5 цікаві тим, що володіють двома різними типами положень (екваторіальним і осьовим). Ці позиції мають унікальні кути зв'язку та довжини зв'язку. Підвісні атоми/групи мають різні переваги щодо осьового та екваторіального положення, які дещо залежать від їх електронегативності.
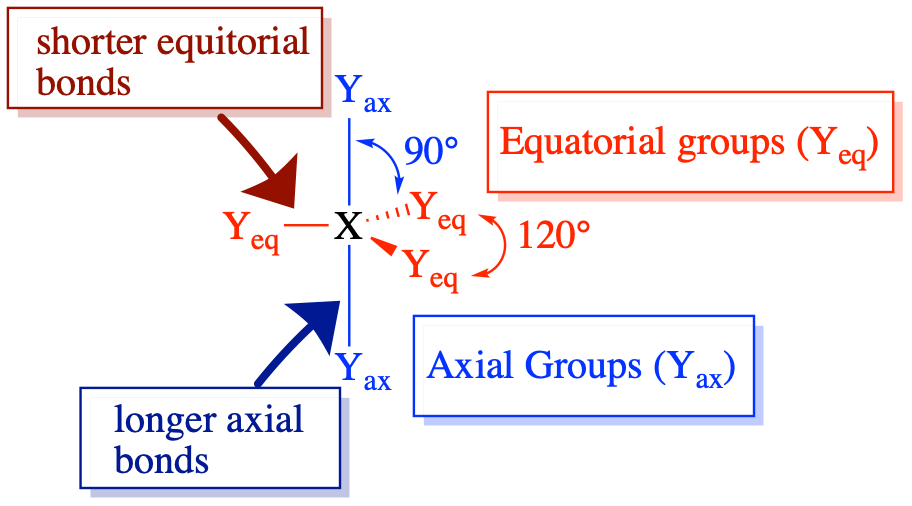
У попередньому розділі ми обговорювали перевагу одиноких пар та множинних зв'язків для екваторіальних позицій у тригональних біпірамідних молекулах. Теорія VSEPR раціоналізує це, припускаючи, що одинокі пари та множинні зв'язки є більш відразливими, ніж електронні пари в одиночних зв'язках. Екваторіальні позиції менш переповнені (лише двоє найближчих сусідів на 90° та два далі сусіди на 120°) порівняно з осьовими позиціями (з трьома найближчими сусідами під 90°), тому більш відразливі групи віддають перевагу менш переповненим екваторіальним позиціям.
Підвісні групи, які є більш електронегативними, призводять до слабшого відштовхування електронної пари навколо центрального атома, тоді як групи, які є менш електронегативними, призводять до більш сильного відштовхування електронної пари навколо центрального атома (як описано вище). Результат для стеричного числа 5: пари зв'язку з менш електронегативними елементами більш відразливі і взагалі віддають перевагу екваторіальним позиціям. Тим не менш, самотні пари та кілька зв'язків є більш відразливими, ніж одиночні, і демонструють сильнішу перевагу екваторіальним позиціям.
Приклади і нюанси
Нижче наведені деякі приклади молекул, які демонструють екваторіальну перевагу менш електронегативних груп. Прогнозувати (намалювати) їх структури.
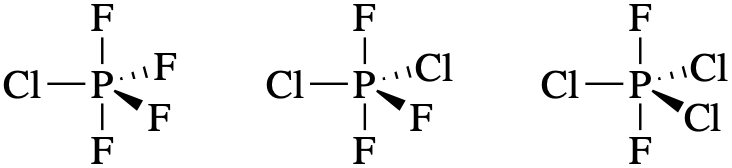
- ПФ 4 Кл, ПФ 3 Сл 2 і ПФ 2 Сл 3
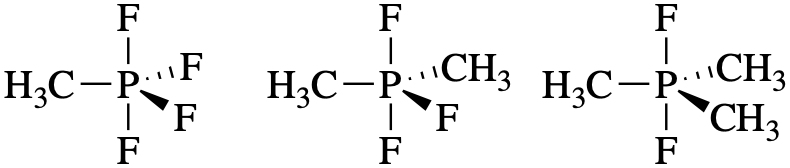
- ПФ 4 (СН 3) ПФ 3 (СН 3) 2, і ПФ 2 (СН 3) 3
- Відповідь (а)
-
Cl менш електронегативний, ніж F; таким чином, ми очікуємо, що Cl матиме сильнішу перевагу екваторіальним позиціям.
- Відповідь (б)
-
CH 3, електронна донорська група, менш електронегативна, ніж F. Ми очікуємо, що CH 3 матиме сильнішу перевагу екваторіальним позиціям.
У наведеній вище вправі структури можна пояснити електронегативністю кулонних груп; менш електронегативні групи віддають перевагу екваторіальним положенням. Є й інші подібні молекули, для яких пояснення (або прогнози) складні. Наприклад, ряд молекул нижче, здається, має абсолютно випадкове розміщення груп F і CF 3. Ці структури неможливо було передбачити на основі теорії VSEPR. Здається, що в цьому випадку краще більш симетричні розташування підвісних груп.
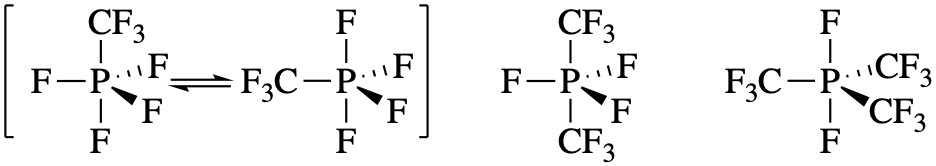
Посилання та ресурси
- Полінг, Л. (1932). «Природа хімічного зв'язку. IV. Енергія одиночних зв'язків і відносна електронегативність атомів». Дж. Ам. Хім. Соц. 54 (9): 3570—3582. Код: 10.1021/я01348а011.
- Хаускрофт, Кетрін Е. та ін. «Неорганічна хімія» 3-е видання. Пірсон Освіта обмежена 2008. Глава 2.5 «Значення електронегативності» с. 42-44
- Міжнародний союз чистої та прикладної хімії. «Електронегативність». золота книга.iupac.org/e01990.html.
- Пірсон, Р.Г. Хім. Рез. 1990, 23, 1, 1—2. https://doi.org/10.1021/ar00169a001
- Маллікен, Р.С. (1934). «Нова шкала електроафінності; разом з даними про валентні стани та потенціали іонізації валентності та електронні спорідненості». Дж. Хем. Фіз. 2 (11): 782-793. дої:10.1063/1,1749394.
- Маллікен, Р.С. (1935). «Електронні структури молекул XI. Електроафінність, молекулярні орбіталі та дипольні моменти». Дж. Хем. Фіз. 3 (9): 573-585. дої:10.1063/1,1749731.
- Оллред, А.Л.; Рохов, Е.Г. (1958). «Шкала електронегативності на основі електростатичної сили». Журнал неорганічної та ядерної хімії. 5 (4): 264-268. дої:10.1016/0022-1902 (58) 80003-2
- Сандерсон, Р.Т. (1983). «Електронегативність і енергія зв'язку». Журнал Американського хімічного товариства. 105 (8): 2259-2261. дої:10.1021/я00346а026
- Пірсон, Р.Г. (1985). «Абсолютна електронегативність і абсолютна твердість кислот і основ Льюїса». Дж. Ам. Хім. Соц. 107 (24): 6801. дої:10.1021/я00310а009.
- Аллен, Ліланд К. (1989). «Електронегативність - це середня одноелектронна енергія електронів валентної оболонки в наземних вільних атомах». Журнал Американського хімічного товариства. 111 (25): 9003—9014. дої:10.1021/ja00207a003.
- Манн, Джозеф Б.; Лагідний, Террі Л.; Аллен, Ліланд К. (2000). «Конфігурація енергій основних елементів групи». Журнал Американського хімічного товариства. 122 (12): 2780—2783. дої:10.1021/ja992866e.
- Манн, Джозеф Б.; Лагідний, Террі Л.; Найт, Євген Т.; Капітані, Джозеф Ф.; Аллен, Ліланд К. (2000). «Конфігурація енергій елементів d-блоку». Журнал Американського хімічного товариства. 122 (21): 5132-5137. дої:10.1021/ja9928677
Подяка
- Matthew Salem (UC Davis) (Pauling Electronegativity)
- Introduction to Inorganic Chemistry Wikibook (https://chem.libretexts.org/Bookshel..._Bond_Strength)
- Template:ContribHaas
