14.4: Гідроліз сольових розчинів
- Page ID
- 22806
- Передбачте, чи буде розчин солі кислим, основним або нейтральним
- Обчисліть концентрації різних видів у розчині солі
- Опишіть процес, який викликає кислі розчини певних іонів металів
Як ми бачили в розділі про хімічні реакції, при змішуванні кислоти і основи вони проходять реакцію нейтралізації. Слово «нейтралізація», здається, означає, що стехіометрично еквівалентний розчин кислоти та основи був би нейтральним. Це іноді вірно, але солі, які утворюються в цих реакціях, можуть мати кислі або основні властивості свої, як ми зараз побачимо.
Кислотно-лужної нейтралізації
Розчин є нейтральним, коли містить однакові концентрації іонів гідронію та гідроксиду. При змішуванні розчинів кислоти і основи відбувається реакція кислотно-лужної нейтралізації. Однак, навіть якщо ми змішуємо стехіометрично еквівалентні кількості, ми можемо виявити, що отриманий розчин не є нейтральним. Він може містити або надлишок іонів гідронію, або надлишок гідроксидних іонів, оскільки природа утвореної солі визначає, чи є розчин кислим, нейтральним або основним. Наступні чотири ситуації ілюструють, як розчини з різними значеннями рН можуть виникнути після реакції нейтралізації з використанням стехіометрично еквівалентних величин:
- Сильна кислота та сильна основа, такі як HCl (aq) та NaOH (aq), реагуватимуть на утворення нейтрального розчину, оскільки вироблені партнери кон'югату мають незначну міцність:\[\ce{HCl}(aq)+\ce{NaOH}(aq)⇌\ce{NaCl}(aq)+\ce{H2O}(l) \nonumber \]
- Сильна кислота і слабке підставу виходять слабокислий розчин не через залученої сильної кислоти, а через кон'югатной кислоти слабкої основи.
- Слабка кислота і міцна основа дають слабоосновний розчин. Розчин слабкої кислоти вступає в реакцію з розчином міцної основи з утворенням кон'югатної основи слабкої кислоти і кон'югатної кислоти міцної основи. Кон'югатна кислота міцної основи є більш слабкою кислотою, ніж вода і не впливає на кислотність отриманого розчину. Однак кон'югатна основа слабкої кислоти є слабкою основою і трохи іонізується у воді. Це збільшує кількість гідроксид-іона в розчині, що утворюється в реакції, і робить його трохи основним.
- Слабка кислота плюс слабка основа може дати або кислий, основний, або нейтральний розчин. Це найскладніший з чотирьох типів реакцій. Коли кон'югатна кислота і сполучена основа мають нерівну міцність, розчин може бути як кислим, так і основним, в залежності від відносної сили двох кон'югатів. Іноді слабка кислота і слабка основа матимуть однакову міцність, тому їх відповідна кон'югатна основа та кислота матимуть однакову міцність, а розчин буде нейтральним. Щоб передбачити, чи буде певна комбінація кислотною, базовою або нейтральною, необхідно порівняти табличні значення K кон'югатів.
антациди шлунка
Наші шлунки містять розчин приблизно 0,03 М HCl, який допомагає нам перетравлювати їжу, яку ми їмо. Відчуття печіння, пов'язане з печією, є результатом того, що кислота шлунка просочується через м'язовий клапан у верхній частині шлунка в нижню течію стравоходу. Підкладка стравоходу не захищена від корозійного впливу шлункової кислоти так, як оболонка шлунка, і результати можуть бути дуже болючими. Коли у нас печія, почувається краще, якщо ми зменшуємо надлишок кислоти в стравоході, приймаючи антацид. Як ви вже здогадалися, антациди - це основи. Одним з найбільш поширених антацидів є карбонат кальцію, CaCo 3. Реакція,
\[CaCO_3(s)+2HCl(aq)⇌CaCl_2(aq)+H_2O(l)+CO_2(g) \nonumber \]
не тільки нейтралізує шлункову кислоту, вона також виробляє СО 2 (г), що може призвести до ситної відрижки.
Молоко магнезії являє собою суспензію слаборозчинної основи гідроксиду магнію, Mg (ОН) 2. Працює відповідно до реакції:
\[Mg(OH)_2(s)⇌Mg^{2+}(aq)+2OH^-(aq) \nonumber \]
Гідроксидні іони, що утворюються в цій рівновазі, потім продовжують реагувати з іонами гідронію з шлункової кислоти, так що:
\[H_3O^+ + OH^- ⇌ 2H_2O(l) \nonumber \]
Ця реакція не виробляє вуглекислий газ, але магнійсодержащие антациди можуть надавати послаблюючу дію. Кілька антацидів мають в якості діючої речовини гідроксид алюмінію, Al (OH) 3. Гідроксид алюмінію, як правило, викликає запор, а деякі антациди використовують гідроксид алюмінію спільно з гідроксидом магнію, щоб збалансувати побічні ефекти двох речовин.
Кулінарні аспекти хімії
Кулінарія - це, по суті, синтетична хімія, яка буває безпечною для їжі. Існує ряд прикладів кислотно-лужної хімії в кулінарному світі. Одним із прикладів є використання харчової соди або бікарбонату натрію у випічці. NaHCO 3 є базовим. Коли він вступає в реакцію з такою кислотою, як лимонний сік, сколотина або сметана в клярі, утворюються бульбашки вуглекислого газу від розкладання отриманої вугільної кислоти, і тісто «піднімається вгору». Розпушувач - це комбінація бікарбонату натрію та однієї або декількох кислих солей, які реагують при контакті двох хімічних речовин з водою в клярі.
Багато хто любить класти на варену рибу лимонний сік або оцет, обидва з яких є кислотами (рис.\(\PageIndex{1}\)). Виявляється, риби мають в своїх системах летючі аміни (основи), які нейтралізуються кислотами з отриманням нелетких солей амонію. Це зменшує запах риби, а також додає «кислий» смак, який ми, здається, насолоджуємося.
Маринування - це метод, який використовується для консервування овочів з використанням природного кислого середовища. Овоч, такий як огірок, поміщають в герметичну банку, занурену в розсольний розчин. Розчин розсолу сприяє зростанню корисних бактерій і пригнічує ріст шкідливих бактерій. Корисні бактерії харчуються крохмалем в огірку і виробляють молочну кислоту як продукт життєдіяльності в процесі, який називається ферментацією. Молочна кислота з часом підвищує кислотність розсолу до рівня, який вбиває будь-які шкідливі бактерії, які вимагають основного середовища. Без шкідливих бактерій, які споживають огірки, вони здатні прослужити набагато довше, ніж якби вони були незахищеними. Побічний продукт процесу маринування змінює смак овочів за допомогою кислоти, роблячи їх кислим смаком.
Солі слабких основ і сильних кислот
Коли ми нейтралізуємо слабку основу сильною кислотою, продукт являє собою сіль, що містить кон'югатную кислоту слабкої основи. Ця кон'югатна кислота є слабкою кислотою. Наприклад, хлорид амонію, NH 4 Cl, являє собою сіль, утворену в результаті реакції слабкої основи аміаку з сильною кислотою HCl:
\[\ce{NH3}(aq)+\ce{HCl}(aq)⟶\ce{NH4Cl}(aq) \nonumber \]
Розчин цієї солі містить іони амонію і іони хлориду. Хлоридний іон не впливає на кислотність розчину, оскільки HCl є сильною кислотою. Хлорид є дуже слабкою основою і не прийме протон до вимірюваної міри. Однак іон амонію, кон'югатна кислота аміаку, вступає в реакцію з водою і збільшує концентрацію іонів гідронію:
\[\ce{NH4+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{NH3}(aq) \nonumber \]
Рівняння рівноваги для цієї реакції - це просто постійна іонізації. К а, для кислоти\(\ce{NH4+}\):
\[\ce{\dfrac{[H3O+][NH3]}{[NH4+]}}=K_\ce{a} \nonumber \]
Значення K a для іона амонію ми не знайдемо в таблиці Е1. Однак визначити K a for\(\ce{NH4+}\) зі значення константи іонізації води K w, і K b - константу іонізації її сполученого підстави NH 3, використовуючи таку залежність:
\[K_\ce{w}=K_\ce{a}×K_\ce{b} \nonumber \]
Це співвідношення стосується будь-якої основи та її кон'югатної кислоти або для будь-якої кислоти та її кон'югатної основи.
Анілін - це амін, який використовується для виготовлення барвників. Його виділяють у вигляді аніліну гідрохлориду\(\ce{[C6H5NH3+]Cl}\), солі, отриманої в результаті реакції слабкої основи аніліну і соляної кислоти. Який рН 0,233 М розчину аніліну гідрохлориду?
\[\ce{C6H5NH3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{C6H5NH2}(aq) \nonumber \]
Рішення
Новий крок у цьому прикладі полягає у визначенні K a для\(\ce{C6H5NH3+}\) іона. \(\ce{C6H5NH3+}\)Іон - це кон'югатна кислота слабкої основи. Значення K a для цієї кислоти не вказано в таблиці Е1, але ми можемо визначити його за значенням K b для аніліну, C 6 H 5 NH 2, яке наведено як 4,6 × 10 −10:
\[\mathrm{\mathit{K}_a(for\:C_6H_5NH_3^+)×\mathit{K}_b(for\:C_6H_5NH_2)=\mathit{K}_w=1.0×10^{−14}} \nonumber \]
\[\mathrm{\mathit{K}_a(for\:C_6H_5NH_3^+)=\dfrac{\mathit{K}_w}{\mathit{K}_b(for\:C_6H_5NH_2)}=\dfrac{1.0×10^{−14}}{4.6×10^{−10}}=2.3×10^{−5}} \nonumber \]
Тепер маємо постійну іонізації і початкову концентрацію слабкої кислоти, інформацію, необхідну для визначення рівноважної концентрації Н 3 О +, і рН:
За допомогою цих кроків ми знаходимо [H 3 O +] = 2,3 × 10 −3 М і рН = 2,64
- Проведіть розрахунки і покажіть, що концентрація іонів гідронію для 0,233- М розчину\(\ce{C6H5NH3+}\) становить 2,3 × 10 −3, а рН дорівнює 2,64.
- Що таке концентрація іонів гідронію в 0,100- М розчині аміачної селітри, NH 4 NO 3, солі, що складається з іонів\(\ce{NH4+}\) і\(\ce{NO3-}\). Використовуйте дані таблиці Е1 для визначення K b для іона амонію. Яка кислота сильніша\(\ce{C6H5NH3+}\) або\(\ce{NH4+}\)?
- Відповідь на
-
\(K_a\ce{(for\:NH4+)}=5.6×10^{−10}\), [Н 3 О +] = 7,5 × 10−6 М
- Відповідь б
-
\(\ce{C6H5NH3+}\)є сильнішою кислотою (а) (б).
Солі слабких кислот і сильних основ
Коли ми нейтралізуємо слабку кислоту з міцною основою, ми отримуємо сіль, яка містить кон'югатну основу слабкої кислоти. Ця сполучена основа зазвичай є слабкою основою. Наприклад, ацетат натрію, NaCH 3 CO 2, являє собою сіль, утворену в результаті реакції слабкої кислоти оцтової кислоти з сильною основою гідроксиду натрію:
\[\ce{CH3CO2H}(aq)+\ce{NaOH}(aq)⟶\ce{NaCH3CO2}(aq)+\ce{H2O}(aq) \nonumber \]
Розчин цієї солі містить іони натрію і ацетатні іони. Іон натрію не впливає на кислотність розчину. Однак ацетат-іон, кон'югатна основа оцтової кислоти, вступає в реакцію з водою і збільшує концентрацію гідроксид-іона:
\[\ce{CH3CO2-}(aq)+\ce{H2O}(l)⇌\ce{CH3CO2H}(aq)+\ce{OH-}(aq) \nonumber \]
Рівняння рівноваги для цієї реакції - постійна іонізації, K b, для основи\(\ce{CH3CO2-}\). Значення K b можна обчислити за значенням постійної іонізації води, K w, і K a, константи іонізації кон'югатної кислоти аніона за допомогою рівняння:
\[_\ce{w}=K_\ce{a}×K_\ce{b} \nonumber \]
Для ацетатного іона та його кон'югатної кислоти ми маємо:
\[\mathrm{\mathit{K}_b(for\:\ce{CH_3CO_2^-})=\dfrac{\mathit{K}_w}{\mathit{K}_a(for\:CH_3CO_2H)}=\dfrac{1.0×10^{−14}}{1.8×10^{−5}}=5.6×10^{−10}} \nonumber \]
Деякі довідники не повідомляють про значення K b. Вони лише повідомляють про константи іонізації для кислот. Якщо ми хочемо визначити значення K b за допомогою одного з цих посібників, ми повинні шукати значення K a для сполученої кислоти і перетворити його на значення K b.
Визначте концентрацію оцтової кислоти в розчині з\(\ce{[CH3CO2- ]}=0.050\:M\) і [ОН −] = 2,5 × 10 −6 М при рівновазі. Реакція така:
\[\ce{CH3CO2-}(aq)+\ce{H2O}(l)⇌\ce{CH3CO2H}(aq)+\ce{OH-}(aq) \nonumber \]
Рішення
Нам дають дві з трьох рівноважних концентрацій і просять знайти відсутню концентрацію. Якщо ми зможемо знайти постійну рівноваги для реакції, процес простий.
Ацетатний іон поводиться як основа в цій реакції; гідроксидні іони є продуктом. Визначаємо К б наступним чином:
\[\mathrm{\mathit{K}_b(for\:\ce{CH_3CO_2^-})=\dfrac{\mathit{K}_w}{\mathit{K}_a(for\:CH_3CO_2H)}=\dfrac{1.0×10^{−14}}{1.8×10^{−5}}=5.6×10^{−10}} \nonumber \]
Тепер знайдіть відсутню концентрацію:
\[K_\ce{b}=\ce{\dfrac{[CH3CO2H][OH- ]}{[CH3CO2- ]}}=5.6×10^{−10} \nonumber \]
\[=\dfrac{[\ce{CH3CO2H}](2.5×10^{−6})}{(0.050)}=5.6×10^{−10} \nonumber \]
Вирішуючи це рівняння, отримаємо [СН 3 СО 2 Н] = 1,1 × 10 −5 М.
Який рН 0,083- М розчину СН −? Використовуйте 4,9 × 10 −10 як K a для HCN. Підказка: Ймовірно, нам потрібно буде перетворити pH на pH або знайти [H 3 O +] за допомогою [OH −] на завершальних етапах цієї задачі.
- Відповідь
-
11.16
Рівновага в розчині солі слабкої кислоти та слабкої основи
У розчині солі, утвореної реакцією слабкої кислоти і слабкої основи, для прогнозування рН ми повинні знати як К а слабкої кислоти, так і K b слабкої основи. Якщо K a> K b, розчин кислий, а якщо K b > K a, розчин є основним.
Визначте, чи є водні розчини наступних солей кислими, основними або нейтральними:
- Кбр
- НаХСО 3
- NH 4 Кл
- Na 2 ГПО 4
- НЧ 4 Ф
Рішення
Розглянемо кожен з іонів окремо з точки зору його впливу на рН розчину, як показано тут:
- Катіон K + та Br − аніон є обома глядачами, оскільки вони є катіоном сильної основи (КОН) та аніон сильної кислоти (HBr) відповідно. Розчин нейтральний.
- Катіон Na + є глядачем, і не вплине\(\ce{HCO3-}\) на рН розчину; аніон амфіпротичний. K a\(\ce{HCO3-}\) становить 4,7 × 10 −11, тому K b його сполученої основи є\(\dfrac{1.0×10^{−14}}{4.7×10^{−11}}=2.1×10^{−4}\). Починаючи з K b >> K a, рішення є основним.
- \(\ce{NH4+}\)Іон є кислим, а іон Cl − є глядачем. Розчин буде кислим.
- Іон Na + є глядачем і не вплине на рН розчину, в той час як\(\ce{HPO4^{2-}}\) іон амфіпротичний. K a\(\ce{HPO_4^{2-}}\) дорівнює 4,2 × 10 −13, а його K b дорівнює\(\dfrac{1.0×10^{−14}}{4.2×10^{−13}}=2.4×10^{−2}\). Оскільки K b >> K a, рішення є основним.
- \(\ce{NH4+}\)Іон вказаний як кислий, а F − іон вказаний як основа, тому ми повинні безпосередньо порівняти K a та K b двох іонів. K a\(\ce{NH4+}\) дорівнює 5,6 × 10 −10, що здається дуже малим, але K b F − дорівнює 1,4 × 10 −11, тому розчин є кислим, оскільки K a> K b.
Визначте, чи є водні розчини наступних солей кислими, основними або нейтральними:
- К 2 СО 3
- CaCl 2
- КХ 2 ПО 4
- (Н 4) 2 СО 3
- Лабр 3
- Відповідь на
-
основні
- Відповідь б
-
нейтральний
- Відповідь c
-
кислотні
- Відповідь d
-
основні
- Відповідь e
-
кислотні
Іонізація гідратованих іонів металів
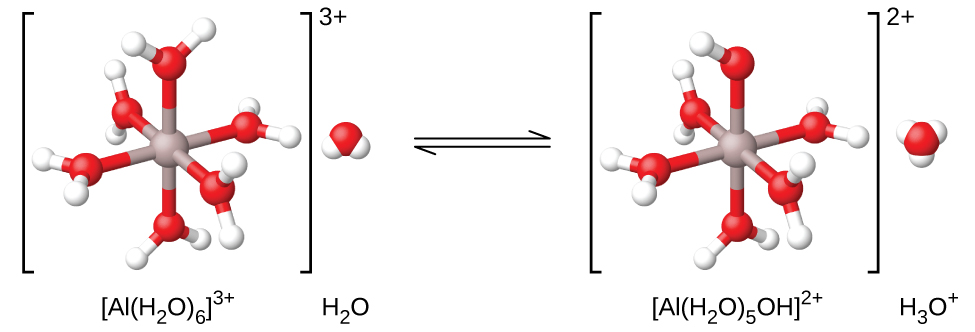
Якщо виміряти рН розчинів різних іонів металів, ми виявимо, що ці іони діють як слабкі кислоти, перебуваючи в розчині. Прикладом є іон алюмінію. Коли нітрат алюмінію розчиняється у воді, іон алюмінію реагує з водою, даючи гідратований іон алюмінію\(\ce{Al(H2O)6^3+}\), розчинений у великій воді. Це означає, що іон алюмінію має найсильнішу взаємодію з шістьма найближчими молекулами води (так звана перша сольватаційна оболонка), хоча він взаємодіє і з іншими молекулами води, що оточують цей\(\ce{Al(H2O)6^3+}\) кластер:
\[\ce{Al(NO3)3}(s)+\ce{6H2O}(l)⟶\ce{Al(H2O)6^3+}(aq)+\ce{3NO3-}(aq) \nonumber \]
Ми часто бачимо формулу цього іона просто як «Al 3 + (aq)», не вказуючи явно шести молекул води, які є найближчими до іона алюмінію, і просто описуючи іон як розчинений у воді (гідратований). Це аналогічно спрощенню формули іона гідронію, Н 3 О + до Н +. Однак в цьому випадку гідратований іон алюмінію є слабкою кислотою (рис.\(\PageIndex{2}\)) і дарує протон молекулі води. Таким чином, гідратація стає важливою, і ми можемо використовувати формули, які показують ступінь гідратації:
\[\ce{Al(H2O)6^3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)5(OH)^2+}(aq) \hspace{20px} K_\ce{a}=1.4×10^{−5} \nonumber \]
Як і у випадку з іншими поліпротовими кислотами, гідратований іон алюмінію іонізується поетапно, як показано:
\[\ce{Al(H2O)6^3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)5(OH)^2+}(aq) \nonumber \]
\[\ce{Al(H2O)5(OH)^2+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)4(OH)2+}(aq) \nonumber \]
\[\ce{Al(H2O)4(OH)2+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)3(OH)3}(aq) \nonumber \]
Зауважте, що деякі з цих видів алюмінію проявляють амфіпротну поведінку, оскільки вони діють як кислоти, коли вони з'являються на лівій стороні виразів рівноваги та як основи, коли вони з'являються з правого боку.
Однак іонізація катіона, що несе більше одного заряду, зазвичай не велика за межами першої стадії. Додатковими прикладами першого етапу іонізації іонів гідратованих металів є:
\[\ce{Fe(H2O)6^3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Fe(H2O)5(OH)^2+}(aq) \hspace{20px} K_\ce{a}=2.74 \nonumber \]
\[\ce{Cu(H2O)6^2+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Cu(H2O)5(OH)+}(aq) \hspace{20px} K_\ce{a}=~6.3 \nonumber \]
\[\ce{Zn(H2O)4^2+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Zn(H2O)3(OH)+}(aq) \hspace{20px} K_\ce{a}=9.6 \nonumber \]
Обчисліть рН 0,10- М розчину хлориду алюмінію, який розчиняється повністю, щоб дати гідратований іон алюмінію\(\ce{[Al(H2O)6]^3+}\) в розчині.
Рішення
Незважаючи на незвичайний зовнішній вигляд кислоти, це типова проблема іонізації кислоти.
- Визначте напрямок змін. Рівняння для реакції і K a є:
\(\ce{Al(H2O)6^3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)5(OH)^2+}(aq) \hspace{20px} K_\ce{a}=1.4×10^{−5}\)
Реакція зміщується вправо, щоб досягти рівноваги. - Визначте х і рівноважні концентрації. Використовуйте таблицю
:

Вирішити для x і рівноважних концентрацій. Підстановка виразів для рівноважних концентрацій в рівняння для константи іонізації дає:
- \[K_\ce{a}=\ce{\dfrac{[H3O+][Al(H2O)5(OH)^2+]}{[Al(H2O)6^3+]}} \nonumber \]
\(=\dfrac{(x)(x)}{0.10−x}=1.4 \times 10^{−5}\)
Solving this equation gives:
\[x=1.2×10^{−3}\:M \nonumber \]
From this we find:
\[\ce{[H3O+]}=0+x=1.2×10^{−3}\:M \nonumber \]
\[\mathrm{pH=−log[H_3O^+]=2.92(an\: acidic\: solution)} \nonumber \]
Check the work. The arithmetic checks; when 1.2 × 10−3 M is substituted for x, the result = Ka.
What is \(\ce{[Al(H2O)5(OH)^2+]}\) in a 0.15-M solution of Al(NO3)3 that contains enough of the strong acid HNO3 to bring [H3O+] to 0.10 M?
- Answer
-
2.1 × 10−5 M
The constants for the different stages of ionization are not known for many metal ions, so we cannot calculate the extent of their ionization. However, practically all hydrated metal ions other than those of the alkali metals ionize to give acidic solutions. Ionization increases as the charge of the metal ion increases or as the size of the metal ion decreases.
Summary
The characteristic properties of aqueous solutions of Brønsted-Lowry acids are due to the presence of hydronium ions; those of aqueous solutions of Brønsted-Lowry bases are due to the presence of hydroxide ions. The neutralization that occurs when aqueous solutions of acids and bases are combined results from the reaction of the hydronium and hydroxide ions to form water. Some salts formed in neutralization reactions may make the product solutions slightly acidic or slightly basic. Solutions that contain salts or hydrated metal ions have a pH that is determined by the extent of the hydrolysis of the ions in the solution. The pH of the solutions may be calculated using familiar equilibrium techniques, or it may be qualitatively determined to be acidic, basic, or neutral depending on the relative Ka and Kb of the ions involved.
