12.6: Механізми реакції
- Page ID
- 22587
↑
- Відрізнити чисті реакції від елементарних реакцій (етапів)
- Визначте молекулярність елементарних реакцій
- Напишіть збалансоване хімічне рівняння для процесу з урахуванням його механізму реакції
- Вивести закон швидкості, що відповідає заданому механізму реакції
Збалансоване рівняння хімічної реакції вказує на те, що реагує і що виробляється, але воно нічого не виявляє про те, як насправді відбувається реакція. Механізм реакції (або шлях реакції) - це процес, або шлях, за допомогою якого відбувається реакція. Хімічна реакція часто відбувається поетапно, хоча вона не завжди може бути очевидною для спостерігача. Наприклад, розкладання озону відбувається за механізмом з двома етапами:
\ [\ ce {O3} (г) ⟶\ ce {O2} (г) +\ ce {O}\
\ ce {O} +\ ce {O3} (г) ⟶\ ce {2O2} (г)\ етикетка {12.7.1}\]
Ми називаємо кожен крок механізму реакції елементарною реакцією. Елементарні реакції відбуваються саме так, як вони написані і не можуть бути розбиті на більш прості кроки. Елементарні реакції складаються в загальну реакцію, яка для розкладання становить:
\[\ce{2O3}(g)⟶\ce{3O2}(g) \label{12.7.2} \]
Зверніть увагу, що атом кисню, вироблений на першому кроці цього механізму, споживається на другому етапі і тому не з'являється як продукт у загальній реакції. Види, які виробляються в один прийом і споживаються на наступному етапі, називаються проміжними продуктами.
У той час як загальне рівняння реакції для розкладання озону вказує на те, що дві молекули озону реагують, щоб дати три молекули кисню, механізм реакції не передбачає зіткнення і реакцію двох молекул озону. Швидше за все, це включає молекулу озону, що розкладається на молекулу кисню та проміжний атом кисню; атом кисню потім реагує з другою молекулою озону, щоб дати дві молекули кисню. Ці дві елементарні реакції відбуваються саме так, як вони показані в механізмі реакції.
Одномолекулярні елементарні реакції
Молекулярність елементарної реакції - це кількість видів реагентів (атомів, молекул або іонів). Наприклад, одномолекулярна реакція передбачає перестановку одного виду реагентів для отримання однієї або декількох молекул продукту:
\[A⟶\ce{products} \label{12.7.2b} \]
Рівняння швидкості для одномолекулярної реакції дорівнює:
\[\ce{rate}=k[A] \label{12.7.3} \]
Одномолекулярна реакція може бути однією з декількох елементарних реакцій в складному механізмі. Наприклад, реакція:
\[\ce{O3 ⟶ O2 + O} \label{12.7.4} \]
ілюструє одномолекулярну елементарну реакцію, яка виникає як одна частина двоступеневого механізму реакції. Однак деякі одномолекулярні реакції можуть мати лише єдину реакцію в механізмі реакції. (Іншими словами, елементарна реакція також може бути загальною реакцією в деяких випадках.) Наприклад, газофазне розкладання циклобутану, С 4 Н 8, до етилену, С 2 Н 4, відбувається за допомогою одномолекулярного одноступінчастого механізму:
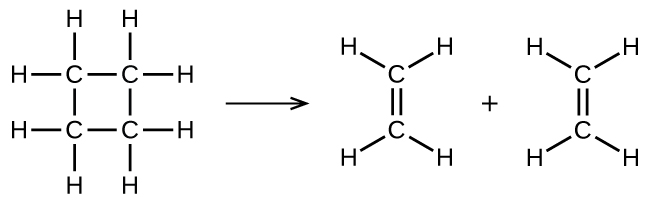
Для того, щоб ці одномолекулярні реакції відбувалися, все, що потрібно, - це поділ частин одиночних молекул реагентів на продукти.
Хімічні зв'язки не просто розпадаються під час хімічних реакцій. Енергія потрібна для розриву хімічних зв'язків. Енергія активації для розкладання С 4 Н 8, наприклад, становить 261 кДж на моль. Це означає, що потрібно 261 кілоджоуль, щоб спотворити один моль цих молекул на активовані комплекси, які розкладаються на продукти:
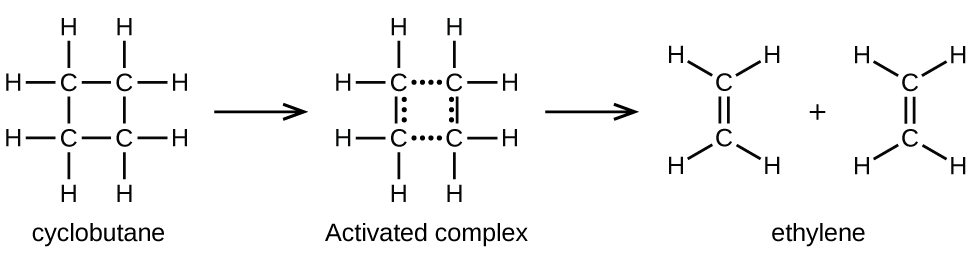
У зразку С 4 Н 8 кілька швидко рухаються молекул С 4 Н 8 стикаються з іншими швидко рухаються молекулами і набирають додаткову енергію. Коли молекули С 4 Н 8 набирають достатню кількість енергії, вони можуть трансформуватися в активований комплекс, і може відбуватися утворення молекул етилену. Фактично, особливо енергійне зіткнення збиває молекулу C 4 H 8 в геометрію активованого комплексу. Однак лише мала частка молекул газу рухається з досить високими швидкостями з досить великими кінетичними енергіями для цього. Отже, в будь-який момент лише кілька молекул набирають достатньо енергії від зіткнень, щоб реагувати.
Швидкість розкладання С 4 Н 8 прямо пропорційна його концентрації. Подвоєння концентрації С 4 Н 8 в пробі дає вдвічі більше молекул на літр. Хоча частка молекул з достатньою кількістю енергії для реакції залишається колишньою, загальна кількість таких молекул в два рази більше. Отже, в два рази більше С 4 Н 8 на літр, а швидкість реакції в два рази швидше:
\[\ce{rate}=−\dfrac{Δ[\ce{C4H8}]}{Δt}=k[\ce{C4H8}] \label{12.7.5} \]
Подібний зв'язок стосується будь-якої одномолекулярної елементарної реакції; швидкість реакції прямо пропорційна концентрації реагенту, і реакція проявляє поведінку першого порядку. Константа пропорційності - це константа швидкості для конкретної одномолекулярної реакції.
Бімолекулярні елементарні реакції
Зіткнення і поєднання двох молекул або атомів для утворення активованого комплексу в елементарній реакції називається бімолекулярної реакцією. Існує два типи бімолекулярних елементарних реакцій:
\[A+B⟶\ce{products} \label{12.7.6} \]
і
\[2A⟶\ce{products} \label{12.7.7} \]
Для першого типу, у якого дві молекули реагентів різні, закон швидкості є першим порядком у А та першим порядком у B:
\[\ce{rate}=k[A][B] \label{12.7.8} \]
Для другого типу, при якому дві однакові молекули стикаються і реагують, закон швидкості другого порядку в А:
\[\ce{rate}=k[A][A]=k[A]^2 \label{12.7.9} \]
Деякі хімічні реакції мають механізми, які складаються з однієї бімолекулярної елементарної реакції. Одним із прикладів є реакція діоксиду азоту з чадним газом:
\[\ce{NO2}(g)+\ce{CO}(g)⟶\ce{NO}(g)+\ce{CO2}(g) \label{12.7.10} \]
(Див. Малюнок\(\PageIndex{1}\))

Бімолекулярні елементарні реакції також можуть бути залучені як етапи багатоступеневого механізму реакції. Реакція атомарного кисню з озоном - один із прикладів:
\[\ce{O}(g)+\ce{O3}(g)⟶\ce{2O2}(g) \label{12.7.12} \]
Термолекулярні елементарні реакції
Елементарна термомолекулярна реакція передбачає одночасне зіткнення трьох атомів, молекул або іонів. Термолекулярні елементарні реакції є рідкістю, оскільки ймовірність зіткнення трьох частинок одночасно становить менше однієї тисячної частинки ймовірності зіткнення двох частинок. Існує, однак, кілька встановлених термімолекулярних елементарних реакцій. Реакція оксиду азоту з киснем, схоже, включає в себе термомолекулярні етапи:
\ [\ ce {2NO + O2 ⟶ 2NO2}\
\ ce {швидкість} = k [\ ce {НІ}] ^2 [\ ce {O2}]\ етикетка {12.7.13}\]
Так само реакція оксиду азоту з хлором, як видається, передбачає термомолекулярні етапи:
\ [\ ce {2NO + Cl2 ⟶ 2nOCl}
\\ ce {швидкість} = k [\ ce {НІ}] ^2 [\ ce {Cl2}]\ етикетка {12.7.14}\]
Пов'язані механізми реакції на норму законів
Часто трапляється так, що один крок у багатоступінчастому механізмі реакції значно повільніший, ніж інші. Оскільки реакція не може протікати швидше, ніж її найповільніший крок, цей крок обмежить швидкість, з якою відбувається загальна реакція. Найповільніший крок тому називається кроком, що обмежує швидкість (або крок визначення швидкості) на малюнку реакції\(\PageIndex{2}\).

Як описано раніше, закони швидкості можуть бути отримані безпосередньо з хімічних рівнянь для елементарних реакцій. Це не так, однак, для звичайних хімічних реакцій. Найбільш часто зустрічаються збалансовані рівняння являють собою загальну зміну для якоїсь хімічної системи, і дуже часто це результат деяких багатоступінчастих механізмів реакції. У кожному випадку ми повинні визначити загальний закон ставки з експериментальних даних і вивести механізм із закону ставки (а іноді і з інших даних). Реакція NO 2 і CO дає наочний приклад:
\[\ce{NO2}(g)+\ce{CO}(g)⟶\ce{CO2}(g)+\ce{NO}(g) \nonumber \]
Для температур вище 225° C було встановлено, що закон норми:
\[\ce{rate}=k[\ce{NO2}][\ce{CO}] \nonumber \]
Реакція першого порядку щодо NO 2 та першого порядку щодо CO. Це узгоджується з одноступінчастим бімолекулярним механізмом і не виключено, що це механізм цієї реакції при високих температурах.
При температурі нижче 225° C реакція описується законом швидкості, який є другим порядком по відношенню до NO 2:
\[\ce{rate}=k[\ce{NO2}]^2 \nonumber \]
Це узгоджується з механізмом, який включає наступні дві елементарні реакції, перша з яких повільніша і, отже, є кроком визначення швидкості:
\ [\ ce {NO2} (г) +\ ce {NO2} (г) ⟶\ ce {NO3} (г) +\ ce {НІ} (г)\:\ ce {(повільний)}\
\ ce {NO3} (г) +\ ce {CO} (г) ⟶\ ce {NO2} (г) +\ ce {CO2} (г)\:\ ce {швидко)}\ nonumber\]
Крок визначення швидкості дає закон швидкості, що показує залежність другого порядку від концентрації NO 2, а сума двох рівнянь дає чисту загальну реакцію.
Загалом, коли крок визначення швидкості (повільніший) є першим кроком механізму, закон ставки для загальної реакції такий же, як і закон ставки для цього кроку. Однак, коли кроку визначення швидкості передує крок, що включає реакцію рівноваги, закон швидкості для загальної реакції може бути важче вивести.
Елементарна реакція знаходиться в рівновазі, коли вона протікає як в прямому, так і в зворотному напрямках з однаковою швидкістю. Розглянемо димеризацію NO до N 2 O 2, причому k 1 використовується для представлення константи швидкості прямої реакції і k -1, що використовується для представлення константи швидкості зворотної реакції:
\[\ce{NO + NO ⇌ N2O2} \nonumber \]
\[\ce{rate_{forward}=rate_{reverse}} \nonumber \]
\[k_1[\ce{NO}]^2=k_{−1}[\ce{N2O2}] \nonumber \]
Якщо N 2 O 2 був проміжним у механізмі, цей вираз можна було б переставити, щоб представляти концентрацію N 2 O 2 у загальному вираженні закону швидкості за допомогою алгебраїчної маніпуляції:
\[\mathrm{\left(\dfrac{k_1[NO]^2}{k_{−1}}\right)=[N_2O_2]} \nonumber \]
Однак знову ж таки, проміжні продукти не можуть бути перераховані як частина загального вираження закону ставки, хоча вони можуть бути включені в індивідуальну елементарну реакцію механізму. Приклад\(\PageIndex{1}\) проілюструє, як вивести загальні закони ставок з механізмів, що включають рівноважні кроки, що передують кроку визначення швидкості.
Механізм нітрилхлорид (NO 2 Cl) розкладається на діоксид азоту (NO 2) та газ хлору (Cl 2) відповідно до наступного механізму:
- \(\ce{2NO2Cl}(g)⇌\ce{ClO2}(g)+\ce{N2O}(g)+\ce{ClO}(g)\)(швидкий, k 1 представляє константу швидкості для прямої реакції, а k −1 - константу швидкості для зворотної реакції)
- \(\ce{N2O}(g)+\ce{ClO2}(g)⇌\ce{NO2}(g)+\ce{NOCl}(g)\)(швидка, k 2 для прямої реакції, k −2 для зворотної реакції)
- \(\ce{NOCl + ClO ⟶ NO2 + Cl2}\)(повільний, k 3 постійна швидкість для прямої реакції)
Визначте загальну реакцію, напишіть вираз закону швидкості для кожної елементарної реакції, визначте будь-які проміжні продукти та визначте загальний вираз закону швидкості.
Рішення
Для загальної реакції просто підсумуйте три кроки, скасуйте проміжні продукти та об'єднайте як формули:
\[\ce{2NO2Cl}(g)⟶\ce{2NO2}(g)+\ce{Cl2}(g) \nonumber \]
Далі пишемо вираз закону швидкості для кожної елементарної реакції. Пам'ятайте, що для елементарних реакцій, які є частиною механізму, вираз закону швидкості може бути виведено безпосередньо зі стехіометрії:
\ [\ почати {вирівнювати*}
k_1\ ce {[No2Cl] 2} &=k_ {−1}\ ce {[ClO2] [N2O] [ClO]}\\
k_2\ ce {[N2O] [ClO2]} &=k_ {−2}\ ce {[NO2] [NoCl]}\
\ ce {швидкість} =k_ {−2} _3\ ce {[NoCl] [ClO]}
\ кінець {вирівнювати*}\ nonumber\]
Третій крок, який є повільним кроком, - крок визначення швидкості. Тому загальний вираз закону ставки можна записати як Rate = k 3 [NoCl] [ClO]. Однак і NoCl, і ClO є проміжними продуктами. Алгебраїчні вирази повинні використовуватися для представлення [NoCl] та [ClO] таким чином, щоб жодні проміжні продукти не залишалися в загальному вираженні закону ставки.
- Використовуючи елементарну реакцію 1,\(\ce{[ClO]}=\dfrac{k_1\ce{[NO2Cl]^2}}{k_{−1}\ce{[ClO2][N2O]}}\).
- Використовуючи елементарну реакцію 2,\(\ce{[NOCl]}=\dfrac{k_2\ce{[N2O][ClO2]}}{k_{−2}\ce{[NO2]}}\).
Тепер підставляємо ці алгебраїчні вирази в загальний вираз закону швидкості та спрощуємо:
\ [\ почати {вирівнювати*}
\ ce {швидкість} &=k_3\ ліворуч (\ dfrac {k_2\ ce {[N2O] [ClO2]}} {k_ {−2}\ ce {[NO2]}}\ праворуч)\ ліворуч (\ dfrac {k_1\ ce {[No2Cl] ^2}} {k_ {1}\ ce {[ClO2] [N2O]}}\ праворуч)
\\ ce {швидкість} &=\ dfrac {k_3k_2k_1\ ce {[No2Cl] ^2}} {k_ {−2} k_ {−1}\ ce {[NO2]}}
\ кінець {align*}\ nonumber\]
Зверніть увагу, що цей закон норми показує зворотну залежність від концентрації одного з видів продукту, узгоджену з наявністю рівноважного кроку в механізмі реакції.
Атомний хлор в атмосфері реагує з озоном в наступних парі елементарних реакцій:
\(\ce{Cl}+\ce{O3}(g)⟶\ce{ClO}(g)+\ce{O2}(g)\hspace{20px}(\textrm{rate constant }k_1)\)
Визначте загальну реакцію, напишіть вираз закону швидкості для кожної елементарної реакції, визначте будь-які проміжні продукти та визначте загальний вираз закону швидкості.
- Відповідь
-
- загальна реакція:\(\ce{O3}(g)+\ce{O}⟶\ce{2O2}(g)\)
- швидкість 1 = k 1 [O 3] [Cl]; швидкість 2 = k 2 [ClO] [O]
- проміжний: ClO (г)
- загальна норма = k 2 k 1 [O 3] [Cl] [O]
Резюме
Послідовність окремих етапів, або елементарних реакцій, за допомогою яких реагенти перетворюються в продукти в процесі реакції, називається механізмом реакції. Загальна швидкість реакції визначається швидкістю найповільнішого кроку, званого кроком визначення швидкості. Одномолекулярні елементарні реакції мають закони швидкості першого порядку, тоді як бімолекулярні елементарні реакції мають закони швидкості другого порядку. Порівнюючи закони швидкості, отримані від механізму реакції, з тими, які визначаються експериментально, механізм може вважатися або неправильним, або правдоподібним.
Виноски
- Це питання взято з хімії Advanced Placement іспиту і використовується з дозволу Освітньої служби тестування.
Глосарій
- бімолекулярна реакція
- елементарна реакція, що включає зіткнення та поєднання двох видів реагентів
- елементарна реакція
- реакція, яка відбувається саме так, як зображено в її хімічному рівнянні
- проміжні
- молекула або іон виробляється на одному етапі реакційного механізму і споживається в іншому
- молекулярність
- кількість видів реагентів (атомів, молекул або іонів), що беруть участь в елементарній реакції
- крок визначення швидкості
- (Крім того, крок обмеження швидкості) найповільніша елементарна реакція в реакційному механізмі; визначає швидкість загальної реакції
- механізм реакції
- поетапна послідовність елементарних реакцій, за допомогою яких відбувається хімічна зміна
- термомолекулярна реакція
- елементарна реакція, що включає одночасне зіткнення та поєднання трьох видів реагентів
- одномолекулярна реакція
- елементарна реакція, що передбачає перестановку одного виду реагентів для отримання однієї або декількох молекул продукту
