12.1: Швидкість хімічних реакцій
- Page ID
- 22564
- Визначте швидкість хімічної реакції
- Вивести вирази швидкості з збалансованого рівняння для заданої хімічної реакції
- Розрахувати швидкість реакції на основі експериментальних даних
Ставка - це міра того, як якась властивість змінюється з часом. Швидкість - це звична норма, яка виражає відстань, пройдену об'єктом за заданий проміжок часу. Заробітна плата - це ставка, яка представляє суму грошей, зароблених людиною, що працює за заданий проміжок часу. Так само швидкість хімічної реакції - це міра того, скільки реагенту споживається або скільки продукту виробляється реакцією за задану кількість часу.
Швидкість реакції - це зміна кількості реагенту або продукту за одиницю часу. Тому швидкості реакції визначаються шляхом вимірювання часової залежності деякої властивості, яка може бути пов'язана з кількістю реагентів або продуктів. Швидкості реакцій, які споживають або виробляють газоподібні речовини, наприклад, зручно визначаються шляхом вимірювання змін об'єму або тиску. Для реакцій, пов'язаних з одним або кількома кольоровими речовинами, показники можуть контролюватися за допомогою вимірювань поглинання світла. Для реакцій, що включають водні електроліти, швидкості можуть бути виміряні за допомогою змін провідності розчину.
Для реагентів і продуктів в розчині їх відносні кількості (концентрації) зручно використовувати для цілей вираження швидкості реакції. Якщо виміряти концентрацію перекису водню, H 2 O 2, у водному розчині, то виявимо, що вона повільно змінюється з плином часу в міру розкладання Н 2 О 2, згідно з рівнянням:
\[\ce{2H2O2}(aq)⟶\ce{2H2O}(l)+\ce{O2}(g) \nonumber \]
Швидкість, з якою розкладається перекис водню, може бути виражена в перерахунку на швидкість зміни її концентрації, як показано тут:
\ [\ begin {align*}
\ ce {швидкість\: з\: розкладання\: з\: H_2O_2}
&=\ mathrm {−\ dfrac {зміна\: в\: концентрація\: з\: реагент} {час\: інтервал}}\\ [4pt]
&= =\ dfrac {[\ ce {H2O2}] _ {t__2}} − [\ ce {H2O2}] _ {t_1}} {t_2−t_1}\\ [4pt]
&=−\ dfrac {Δ [\ ce {H2O2}]} {Δt}
\ end {вирівнювати*}\ nonumber\]
Це математичне уявлення про зміну видової концентрації з плином часу є вираженням швидкості реакції. У дужках вказуються молярні концентрації, а символ дельта (Δ) вказує на «зміну». Таким чином,\([\ce{H2O2}]_{t_1}\) представляє молярну концентрацію пероксиду водню в певний час t 1; аналогічно,\([\ce{H2O2}]_{t_2}\) являє собою молярну концентрацію пероксиду водню в більш пізній час t 2; і Δ [H 2 O 2] являє собою зміну молярна концентрація пероксиду водню протягом часового інтервалу Δ t (тобто t 2 − t 1). Оскільки концентрація реагенту зменшується в міру протікання реакції, Δ [H 2 O 2] є негативною величиною; ми ставимо негативний знак перед виразом, оскільки швидкість реакції за умовністю є позитивними величинами. На малюнку\(\PageIndex{1}\) наведено приклад даних, зібраних під час розкладання H 2 O 2.
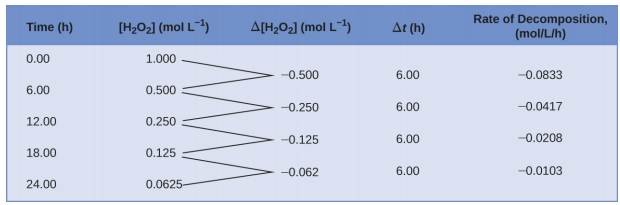
Для отримання табличних результатів для цього розкладання вимірювали концентрацію пероксиду водню кожні 6 годин протягом доби при постійній температурі 40 °С, розраховували швидкості реакції для кожного часового інтервалу шляхом ділення зміни концентрації на відповідний часовий приріст, як показано тут за перший 6-годинний період:
\[\dfrac{−Δ[\ce{H2O2}]}{Δt}=\mathrm{\dfrac{−(0.500\: mol/L−1.000\: mol/L)}{(6.00\: h−0.00\: h)}=0.0833\: mol\:L^{−1}\:h^{−1}} \nonumber \]
Зверніть увагу, що швидкість реакції змінюється з часом, зменшуючись у міру протікання реакції. Результати за останній 6-годинний період дають швидкість реакції:
\[\dfrac{−Δ[\ce{H2O2}]}{Δt}=\mathrm{\dfrac{−(0.0625\:mol/L−0.125\:mol/L)}{(24.00\:h−18.00\:h)}=0.0104\:mol\:L^{−1}\:h^{−1}} \nonumber \]
Така поведінка вказує на те, що реакція постійно сповільнюється з часом. Використання концентрацій на початку і кінці часового періоду, протягом якого швидкість реакції змінюється, призводить до обчислення середньої швидкості реакції за цей часовий проміжок. У будь-який конкретний час швидкість, з якою протікає реакція, відома як її миттєва швидкість. Миттєва швидкість реакції в «нульовий час», коли реакція починається, є її початковою швидкістю. Розглянемо аналогію автомобіля, що уповільнює рух, коли він наближається до знаку зупинки. Початкова швидкість транспортного засобу - аналогічна початку хімічної реакції - буде показанням спідометра в той момент, коли водій починає натискати на гальма (t 0). Через кілька хвилин миттєва швидкість у певний момент - назвіть її t 1 - була б дещо повільнішою, про що вказує свідчення спідометра в той момент часу. З плином часу миттєва швидкість буде продовжувати падати, поки не досягне нуля, коли автомобіль (або реакція) зупиниться. На відміну від миттєвої швидкості, середня швидкість автомобіля не вказується спідометром; але її можна розрахувати як відношення пройденої відстані до часу, необхідного для доведення транспортного засобу до повної зупинки (Δ t). Як і уповільнюючий автомобіль, середня швидкість хімічної реакції буде падати десь між початковою та кінцевою показниками.
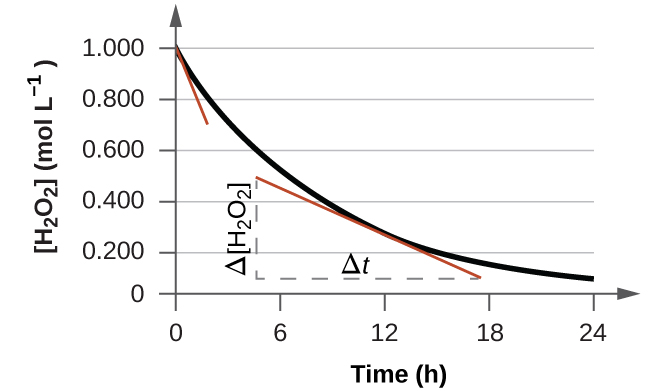
Миттєву швидкість реакції можна визначити одним з двох способів. Якщо експериментальні умови дозволяють вимірювати зміни концентрації протягом дуже коротких часових інтервалів, то середні показники, обчислені, як описано раніше, забезпечують досить хороші наближення миттєвих швидкостей. Крім того, може бути використана графічна процедура, яка, по суті, дає результати, які були б отримані, якби були можливі вимірювання короткого часового інтервалу. Якщо побудувати концентрацію пероксиду водню від часу, то миттєва швидкість розкладання Н 2 О 2 в будь-який момент t задається нахилом прямої, яка дотична до кривої в той час (рис.\(\PageIndex{2}\)). Ми можемо використовувати обчислення для оцінки нахилів таких дотичних ліній, але процедура для цього виходить за рамки цієї глави.
Лікарі часто використовують одноразові тест-смужки для вимірювання кількості різних речовин в сечі пацієнта (рис.\(\PageIndex{2}\)). Ці тест-смужки містять різні хімічні реагенти, вбудовані в невеликі прокладки в різних місцях уздовж смужки, які зазнають зміни кольору при впливі достатньої концентрації специфічних речовин. Інструкції щодо використання тест-смужок часто підкреслюють, що правильний час читання має вирішальне значення для досягнення оптимальних результатів. Цей акцент на часі читання говорить про те, що кінетичні аспекти хімічних реакцій, що відбуваються на тест-смужці, є важливими міркуваннями.
Тест на глюкозу в сечі спирається на двоетапний процес, представлений хімічними рівняннями, показаними тут:
\[\ce{C6H12O6 + O2}\underset{\large\textrm{catalyst}}{\xrightarrow{\hspace{45px}}}\ce{C6H10O6 + H2O2} \label{eq1} \]
\[\ce{2H2O2 + 2I-}\underset{\large\textrm{catalyst}}{\xrightarrow{\hspace{45px}}}\ce{I2 + 2H2O + O2} \label{eq2} \]
Рівняння\(\ref{eq1}\) зображує окислення глюкози в сечі з отриманням глюколактону і перекису водню. Пероксид водню, що утворюється згодом, окислює безбарвний йодидний іон з отриманням коричневого йоду (рівняння\(\ref{eq2}\)), який може бути візуально виявлений. Деякі смужки включають додаткову речовину, яка вступає в реакцію з йодом для отримання більш чіткої зміни кольору.
Дві тестові реакції, показані вище, за своєю суттю дуже повільні, але їх швидкість збільшується спеціальними ферментами, вбудованими в прокладку для тест-смужки. Це приклад каталізу, тема, розглянута далі в цьому розділі. Типова тест-смужка глюкози для використання з сечею вимагає приблизно 30 секунд для завершення коліроутворюючих реакцій. Занадто раннє читання результату може призвести до висновку, що концентрація глюкози в зразку сечі нижча, ніж є насправді (помилково негативний результат). Занадто довге очікування оцінки зміни кольору може призвести до помилкового позитиву через більш повільне (не каталізоване) окислення йодидного іона іншими речовинами, що містяться в сечі.

Відносні швидкості реакції
Швидкість реакції може виражатися в терміні зміни кількості будь-якого реагенту або продукту, а може бути просто виведена зі стехіометрії реакції. Розглянемо реакцію, представлену наступним рівнянням:
\[\ce{2NH3}(g)⟶\ce{N2}(g)+\ce{3H2}(g) \nonumber \]
Стехіометричні фактори, отримані з цього рівняння, можуть бути використані для співвідношення швидкості реакції таким же чином, як вони використовуються для відповідних кількостей реагентів і продуктів. Співвідношення між швидкостями реакції, вираженими в перерахунку на вироблення азоту і витратою аміаку, наприклад, становить:
\[\mathrm{−\dfrac{Δmol\: NH_3}{Δ\mathit t}×\dfrac{1\: mol\: N_2}{2\: mol\: NH_3}=\dfrac{Δmol\:N_2}{Δ\mathit t}} \nonumber \]
Ми можемо виразити це простіше, не показуючи одиниць стехіометричного фактора:
\[−\dfrac{1}{2}\dfrac{\mathrm{Δmol\:NH_3}}{Δt}=\dfrac{\mathrm{Δmol\:N_2}}{Δt} \nonumber \]
Зверніть увагу, що негативний знак був доданий для обліку протилежних ознак двох змін кількості (кількість реагенту зменшується, а кількість продукту збільшується). Якщо реагенти і продукти присутні в одному розчині, молярні кількості можуть бути замінені концентраціями:
\[−\dfrac{1}{2}\dfrac{Δ[\ce{NH3}]}{Δt}=\dfrac{Δ[\ce{N2}]}{Δt} \nonumber \]
Аналогічно швидкість утворення Н 2 в три рази перевищує швидкість утворення N 2, оскільки за час, необхідний для утворення одного моля N 2, утворюються три молі Н 2:
\[\dfrac{1}{3}\dfrac{Δ[\ce{H2}]}{Δt}=\dfrac{Δ[\ce{N2}]}{Δt} \nonumber \]
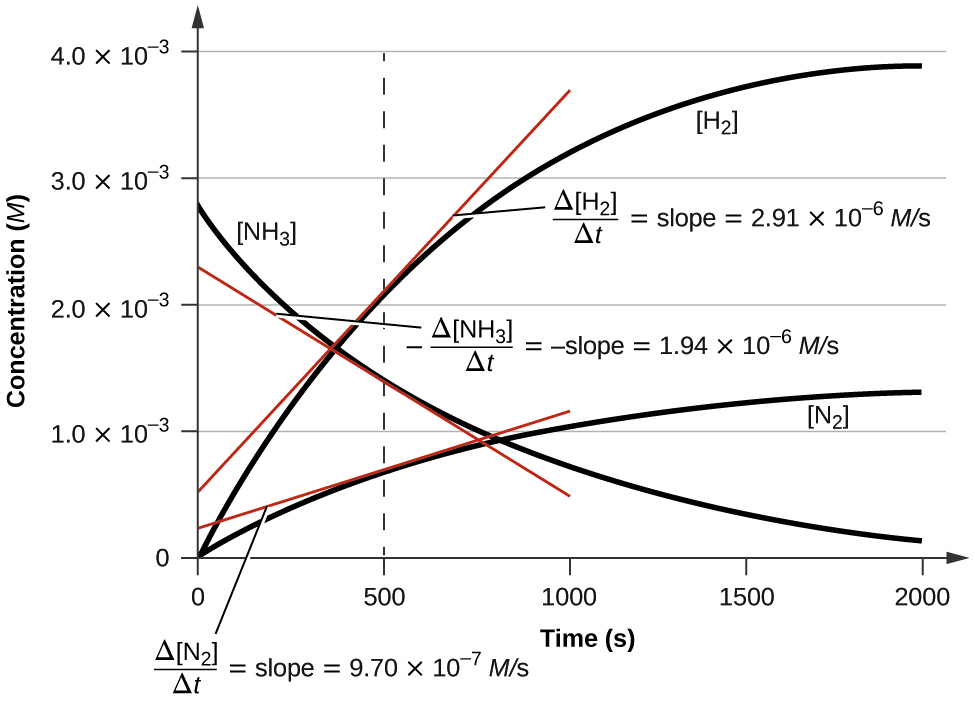
Малюнок\(\PageIndex{3}\) ілюструє зміну концентрацій з плином часу для розкладання аміаку на азот і водень при 1100 °С. З нахилів дотичних, проведеного при t = 500 секунд, видно, що миттєві швидкості зміни концентрацій реагентів і продуктів пов'язані своїми стехіометричними факторами. Швидкість виробництва водню, наприклад, спостерігається в три рази більше, ніж при виробництві азоту:
\[\dfrac{2.91×10^{−6}\:M/\ce s}{9.71×10^{−6}\:M/\ce s}≈3 \nonumber \]
Першим кроком у виробництві азотної кислоти є спалювання аміаку:
\[\ce{4NH3}(g)+\ce{5O2}(g)⟶\ce{4NO}(g)+\ce{6H2O}(g) \nonumber \]
Напишіть рівняння, які пов'язують норми витрати реагентів і швидкості утворення продуктів.
Рішення
З огляду на стехіометрію цієї однорідної реакції, норми витрати реагентів і утворення продуктів становлять:
\[−\dfrac{1}{4}\dfrac{Δ[\ce{NH3}]}{Δt}=−\dfrac{1}{5}\dfrac{Δ[\ce{O2}]}{Δt}=\dfrac{1}{4}\dfrac{Δ[\ce{NO}]}{Δt}=\dfrac{1}{6}\dfrac{Δ[\ce{H2O}]}{Δt} \nonumber \]
Швидкість утворення Br 2 становить 6,0 × 10 −6 моль/л/с в реакції, описаної наступним чистим іонним рівнянням:
\[\ce{5Br- + BrO3- + 6H+ ⟶ 3Br2 + 3H2O} \nonumber \]
Напишіть рівняння, які пов'язують норми витрати реагентів і швидкості утворення продуктів.
- Відповідь
-
\[−\dfrac{1}{5}\dfrac{Δ[\ce{Br-}]}{Δt}=−\dfrac{Δ[\ce{BrO3-}]}{Δt}=−\dfrac{1}{6}\dfrac{Δ[\ce{H+}]}{Δt}=\dfrac{1}{3}\dfrac{Δ[\ce{Br2}]}{Δt}=\dfrac{1}{3}\dfrac{Δ[\ce{H2O}]}{Δt} \nonumber \]
Графік на малюнку\(\PageIndex{3}\) показує швидкість розкладання H 2 O 2 з плином часу:
\[\ce{2H2O2 ⟶ 2H2O + O2} \nonumber \]
Виходячи з цих даних, миттєва швидкість розкладання Н 2 О 2 при t = 11,1 ч визначається рівною 3,20 × 10 −2 моль/л/год, тобто:
\[−\dfrac{Δ[\ce{H2O2}]}{Δt}=\mathrm{3.20×10^{−2}\:mol\: L^{−1}\:h^{−1}} \nonumber \]
Яка миттєва швидкість виробництва Н 2 О і О 2?
Рішення
Використовуючи стехіометрію реакції, ми можемо визначити, що:
\[−\dfrac{1}{2}\dfrac{Δ[\ce{H2O2}]}{Δt}=\dfrac{1}{2}\dfrac{Δ[\ce{H2O}]}{Δt}=\dfrac{Δ[\ce{O2}]}{Δt} \nonumber \]
Тому:
і
\[\dfrac{Δ[\ce{O2}]}{Δt}=\mathrm{1.60×10^{−2}\:mol\:L^{−1}\:h^{−1}} \nonumber \]
Якщо швидкість розкладання аміаку, NH 3, при 1150 К становить 2,10 × 10 −6 моль/л/с, яка швидкість вироблення азоту і водню?
- Відповідь
-
1,05 × 10 −6 моль/л/с, N 2 і 3,15 × 10 −6 моль/л/с, Н 2.
Резюме
Швидкість реакції може виражатися або в плані зменшення кількості реагенту, або збільшення кількості продукту за одиницю часу. Відносини між різними швидкісними виразами для даної реакції виводяться безпосередньо зі стехіометричних коефіцієнтів рівняння, що представляє реакцію.
Глосарій
- середня ставка
- швидкість хімічної реакції обчислюється як відношення виміряної зміни кількості або концентрації речовини до часового інтервалу, за який відбулася зміна
- початкова ставка
- миттєва швидкість хімічної реакції при t = 0 с (відразу після початку реакції)
- миттєва швидкість
- швидкість хімічної реакції в будь-який момент часу, що визначається нахилом прямої тангенціальної до графіка концентрації в залежності від часу
- швидкість реакції
- міра швидкості, з якою відбувається хімічна реакція
- швидкість вираз
- математичне представлення, що стосується швидкості реакції зі змінами кількості, концентрації або тиску реагентів або видів продукту в одиницю часу
