12.2: Фактори, що впливають на швидкість реакції
- Page ID
- 22571
- Опишіть вплив хімічної природи, фізичного стану, температури, концентрації та каталізу на швидкість реакції
Швидкості, з якими витрачаються реагенти і утворюються продукти в ході хімічних реакцій, сильно різняться. Можна виділити п'ять факторів, які впливають на швидкість хімічних реакцій: хімічна природа реагуючих речовин, стан поділу (один великий кому проти багатьох дрібних частинок) реагентів, температура реагентів, концентрація реагентів, наявність каталізатора.
Хімічна природа реагуючих речовин
Швидкість реакції залежить від характеру речовин, що беруть участь. Реакції, які з'являються подібними, можуть мати різну швидкість при однакових умовах, залежно від ідентичності реагентів. Наприклад, коли невеликі шматочки металів залізо і натрій піддаються впливу повітря, натрій повністю реагує з повітрям протягом ночі, тоді як залізо ледве впливає. Активні метали кальцій і натрій реагують з водою з утворенням водневого газу та основи. Все ж кальцій реагує з помірною швидкістю, тоді як натрій реагує настільки швидко, що реакція майже вибухонебезпечна.
Стан підрозділу реагентів
За винятком речовин, що знаходяться в газоподібному стані або в розчині, реакції відбуваються на кордоні або межі розділу між двома фазами. Значить, швидкість реакції між двома фазами значною мірою залежить від поверхневого контакту між ними. Тонко розділене тверде тіло має більшу площу поверхні, доступну для реакції, ніж один великий шматок тієї ж речовини. Таким чином рідина швидше вступить в реакцію з дрібнодисперсним твердим тілом, ніж з великим шматком того ж твердого речовини. Наприклад, великі шматки заліза повільно вступають в реакцію з кислотами; тонкодисперсне залізо реагує набагато швидше (рис.\(\PageIndex{1}\)). Великі шматки дерева тліють, дрібні шматки швидко горять, а пил пил горить вибухонебезпечно.

Відео\(\PageIndex{1}\): Реакція цезію з водою в уповільненому режимі і обговорення того, як стан реагентів і розмір частинок впливають на швидкість реакції.
Температура реагентів
Хімічні реакції зазвичай відбуваються швидше при більш високих температурах. Їжа може швидко зіпсуватися, якщо її залишити на кухонному прилавку. Однак нижча температура всередині холодильника уповільнює цей процес, так що одна і та ж їжа залишається свіжою протягом декількох днів. Використовуємо пальник або нагрівальну плиту в лабораторії, щоб збільшити швидкість реакцій, які протікають повільно при звичайних температурах. У багатьох випадках підвищення температури лише на 10° C приблизно подвоїть швидкість реакції в однорідній системі.
Концентрації реагентів
Швидкості багатьох реакцій залежать від концентрацій реагентів. Норми зазвичай збільшуються при збільшенні концентрації одного або декількох реагентів. Наприклад, карбонат кальцію (\(\mathrm{CaCO_3}\)) погіршується в результаті його реакції з забруднювачем діоксидом сірки. Швидкість цієї реакції залежить від кількості діоксиду сірки в повітрі (рис.\(\PageIndex{2}\)). Як кислий оксид, діоксид сірки з'єднується з водяною парою в повітрі для отримання сірчистої кислоти в наступній реакції:
\[\ce{SO}_{2(g)}+\ce{H_2O}_{(g)}⟶\ce{H_2SO}_{3(aq)} \label{12.3.1} \]
Карбонат кальцію реагує з сірчистою кислотою наступним чином:
\[\ce{CaCO}_{3(s)}+\ce{H_2SO}_{3(aq)}⟶\ce{CaSO}_{3(aq)}+\ce{CO}_{2(g)}+\ce{H_2O}_{(l)} \label{12.3.2} \]
У забрудненій атмосфері, де концентрація діоксиду сірки висока, карбонат кальцію псується швидше, ніж в менш забрудненому повітрі. Так само фосфор набагато швидше згорає в атмосфері чистого кисню, ніж в повітрі, в якому всього близько 20% кисню.

Відео\(\PageIndex{2}\): Фосфор швидко горить на повітрі, але він буде горіти ще швидше, якщо концентрація кисню в вище.
Наявність каталізатора
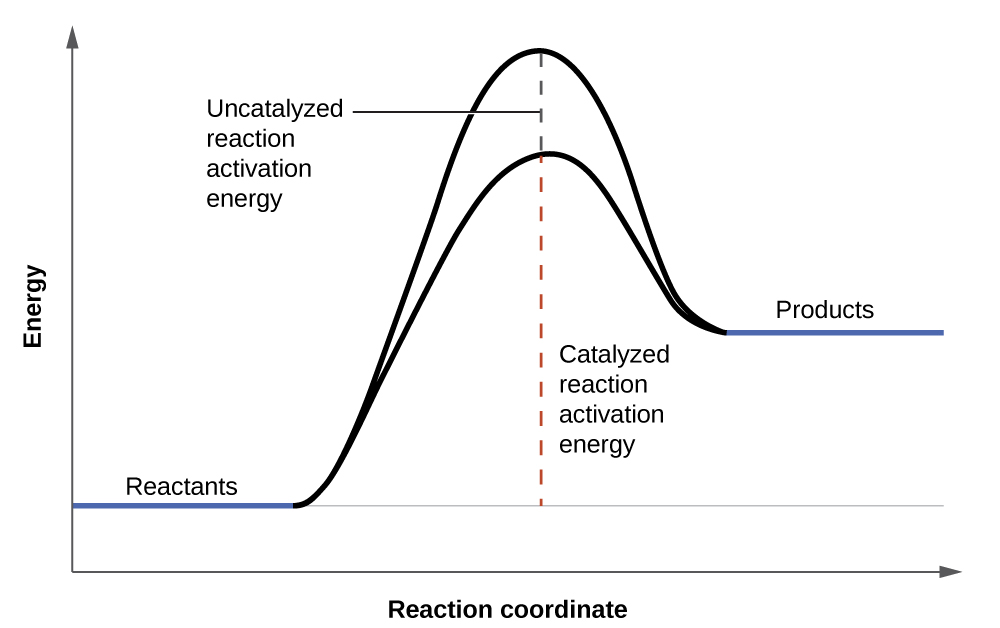
Розчини перекису водню піниться при заливанні на відкриту рану, оскільки речовини в оголених тканині виступають каталізаторами, збільшуючи швидкість розкладання перекису водню. Однак при відсутності цих каталізаторів (наприклад, у флаконі в аптечці) повне розкладання може зайняти місяці. Каталізатор - це речовина, яка збільшує швидкість хімічної реакції за рахунок зниження енергії активації, не споживаючи себе реакцією. Енергія активації - це мінімальна кількість енергії, необхідна для того, щоб хімічна реакція протікала в прямому напрямку. Каталізатор збільшує швидкість реакції, забезпечуючи альтернативний шлях або механізм для реакції слідувати (рис.\(\PageIndex{3}\)). Каталіз буде розглянуто більш детально далі в цьому розділі, оскільки він стосується механізмів реакцій.
Хімічні реакції відбуваються при зіткненні молекул один з одним і піддаються хімічному перетворенню. Перш ніж фізично виконувати реакцію в лабораторії, вчені можуть використовувати моделювання молекулярного моделювання, щоб передбачити, як параметри, обговорювані раніше, впливатимуть на швидкість реакції. Використовуйте інтерактивні PhET Reactions & Rates, щоб вивчити, як температура, концентрація та природа реагентів впливають на швидкість реакції.
Резюме
На швидкість хімічної реакції впливає кілька параметрів. Реакції, що включають дві фази, протікають швидше, коли спостерігається більша площа поверхні контакту. Якщо температура або концентрація реагентів підвищується, швидкість даної реакції, як правило, також збільшується. Каталізатор може збільшити швидкість реакції, надаючи альтернативний шлях, який призводить до зменшення енергії активації реакції.
Глосарій
- каталізатор
- речовина, яка збільшує швидкість реакції, не споживаючи себе реакцією
