11.4: Колігативні властивості
- Page ID
- 22515
- Експрес-концентрації компонентів розчину з використанням молярної фракції та молярності
- Опишіть вплив концентрації розчиненої речовини на різні властивості розчину (тиск пари, температуру кипіння, температуру замерзання та осмотичний тиск)
- Виконуйте розрахунки за допомогою математичних рівнянь, які описують ці різні колігативні ефекти.
- Опишіть процес дистиляції і його практичне застосування
- Поясніть процес осмосу і опишіть, як він застосовується промислово і в природі
Властивості розчину відрізняються від властивостей або чистого розчиненого речовини, або розчинника. Багато властивостей розчину залежать від хімічної ідентичності розчиненої речовини. У порівнянні з чистою водою розчин хлористого водню більш кислий, розчин аміаку більш основний, розчин хлориду натрію більш щільний, а розчин сахарози більш в'язкий. Однак існує кілька властивостей розчину, які залежать лише від загальної концентрації розчинених видів, незалежно від їх ідентичності. Ці колігативні властивості включають зниження тиску пари, підвищення температури кипіння, зниження температури замерзання та осмотичний тиск. Цей невеликий набір властивостей має центральне значення для багатьох природних явищ і технологічних застосувань, як буде описано в цьому модулі.
Кротова фракція і моляльність
Кілька одиниць, які зазвичай використовуються для вираження концентрацій компонентів розчину, були введені в попередній главі цього тексту, кожен з яких забезпечує певні переваги для використання в різних додатках. Наприклад, молярність (М) - зручна одиниця для використання в стехіометричних розрахунках, так як вона визначається в терміні молярних кількостей розчинених видів:
\[M=\dfrac{\text{mol solute}}{\text{L solution}} \label{11.5.1} \]
Оскільки обсяги розчину залежать від температури, молярні концентрації також змінюватимуться. При вираженні як молярність концентрація розчину з однаковими числами розчинених речовин і розчинників видів буде різною при різних температурах, через скорочення/розширення розчину. Більш доцільними для розрахунків, що включають багато колігативних властивостей, є одиниці концентрації на основі молю, значення яких не залежать від температури. Двома такими одиницями є мольна фракція (введена в попередньому розділі про гази) і моляльність.
Мольна\(\chi\) фракція компонента - це відношення його молярної кількості до загальної кількості молів всіх компонентів розчину:
\[\chi_\ce{A}=\dfrac{\text{mol A}}{\text{total mol of all components}} \label{11.5.2} \]
Моляльність - одиниця концентрації, яка визначається як відношення чисел молей розчиненої речовини до маси розчинника в кілограмах:
\[m=\dfrac{\text{mol solute}}{\text{kg solvent}} \label{11.5.3} \]
Оскільки ці одиниці обчислюються лише масами та молярними кількостями, вони не змінюються залежно від температури і, таким чином, краще підходять для застосувань, що вимагають незалежних від температури концентрацій, включаючи кілька колігативних властивостей, як буде описано в цьому розділі модуля.
Антифриз в більшості автомобільних радіаторів являє собою суміш рівних обсягів етиленгліколю і води, з незначними кількостями інших добавок, що перешкоджають корозії. Що таке (а) мольна фракція і (б) молярність етиленгліколю, C 2 H 4 (OH) 2, в розчині, приготованому з\(\mathrm{2.22 \times 10^3 \;g}\) етиленгліколю та\(\mathrm{2.00 \times 10^3\; g}\) води (приблизно 2 л гліколю та 2 л води)?
Рішення
(а) Мольна фракція етиленгліколю може бути обчислена спочатку виведенням молярних кількостей обох компонентів розчину, а потім заміщення цих кількостей у визначення одиниці.
\(\mathrm{mol\:H_2O=2000\:g×\dfrac{1\:mol\:H_2O}{18.02\:g\:H_2O}=111\:mol\:H_2O}\)
\(\chi_\mathrm{ethylene\:glycol}=\mathrm{\dfrac{35.8\:mol\:C_2H_4(OH)_2}{(35.8+111)\:mol\: total}=0.245}\)
Зверніть увагу, що моль фракція є безрозмірним властивістю, будучи співвідношенням властивостей з однаковими одиницями (молями).
(б) Щоб знайти моляльність, нам потрібно знати родимки розчиненої речовини і масу розчинника (в кг).
По-перше, використовуйте задану масу етиленгліколю та його молярну масу, щоб знайти молі розчиненої речовини:
\[\mathrm{2220\:g\:C_2H_4(OH)_2\left(\dfrac{mol\:C_2H_2(OH)_2}{62.07\:g}\right)=35.8\:mol\:C_2H_4(OH)_2} \nonumber \]
Потім, переведіть масу води з грамів в кілограми:
\[\mathrm{2000\: g\:H_2O\left(\dfrac{1\:kg}{1000\:g}\right)=2\: kg\:H_2O} \nonumber \]
Нарешті, розрахуйте молярність за її визначенням:
\ [\ почати {вирівнювати*}
\ ce {молярність} &=\ mathrm {\ dfrac {моль\: розчинна речовина} {кг\: розчинник}}
\\ ce {молярність} &=\ mathrm {\\ dfrac {35.8\ :моль\ :C_2H_4 (OH) _2} {2\ :кг\ :H_2O}\
\ ce {моляльність} &=17.9\ :m
\ end {вирівнювати*}\ nonumber\]
Які моль фракції і молярність розчину, що містить 0,850 г аміаку, NH 3, розчиненого в 125 г води?
- Відповідь
-
7,14 × 10 −3; 0,399 м
Розрахуйте мольну частку розчиненого речовини і розчинника в 3,0 м розчині хлориду натрію.
Засіб для торгів
Перетворення з однієї одиниці концентрації в іншу здійснюється шляхом першого порівняння двох визначень одиниць. При цьому обидві одиниці мають однаковий чисельник (молі розчиненої речовини), але різні знаменники. Надана концентрація моляль може бути записана як:
\[\mathrm{\dfrac{3.0\;mol\; NaCl}{1.0\; kg\; H_2O}} \nonumber \]
Отже, чисельником мольного дробу цього розчину є 3,0 моль NaCl. Знаменник можна обчислити, виводячи молярну кількість води, що відповідає 1,0 кг
\[\mathrm{1.0\:kg\:H_2O\left(\dfrac{1000\:g}{1\:kg}\right)\left(\dfrac{mol\:H_2O}{18.02\:g}\right)=55\:mol\:H_2O} \nonumber \]
а потім підставляючи ці молярні кількості у визначення мольної фракції.
\ [\ почати {вирівнювати*}
X_\ математика {H_2O} &=\ математика {\ dfrac {моль\ :H_2O} {моль\: NaCl + моль\ :H_2O}}\\
X_\ mathrm {H_2O} &=\ математика {\\ dfrac {55\ :моль\ :H_2O} {3.0\ :моль\: NaCl+55\ :моль\ :H_2O}}\\
X_\ mathrm {H_2O} &= 0,95\\
X_\ матрм {NaCl} &=\ матрм {\\ dfrac {моль\: NaCl} { моль\: NaCl+моль\ :H_2O}}\\
X_\ mathrm {NaCl} &=\ матрм {\\ фрак {3,0\ :NaCl} {3.0\ :моль\ :NaCl+55\ :моль\ :H_2O}}\\
X_\ mathrm {NaCl} &= 0,052
\ кінець {вирівнює*}\ NaCl} бурштино\]
Мольна фракція йоду\(\ce{I_2}\), розчиненого в дихлорметані\(\ce{CH_2Cl_2}\), становить 0,115. Яка концентрація мола, м, йоду в цьому розчині?
- Відповідь
-
1.50 м
Зниження тиску пари
Як описано в розділі про рідини та тверді речовини, рівноважний тиск пари рідини - це тиск, який чинить її газоподібна фаза, коли випаровування та конденсація відбуваються з однаковими швидкостями:
\[ \text{liquid} \rightleftharpoons \text{gas} \label{11.5.4} \]
Розчинення нелеткої речовини в летючій рідині призводить до зниження тиску пари рідини. Це явище можна раціоналізувати, враховуючи вплив доданих розчинених молекул на процеси випаровування та конденсації рідини. Для випаровування молекули розчинника повинні бути присутніми на поверхні розчину. Наявність розчиненої речовини зменшує площу поверхні, доступну молекулам розчинника, і тим самим знижує швидкість випаровування розчинника. Оскільки на швидкість конденсації не впливає присутність розчиненого речовини, то чистий результат полягає в тому, що рівновага випаровування-конденсація досягається при меншій кількості молекул розчинника в паровій фазі (тобто при більш низькому тиску пари) (рис.\(\PageIndex{1}\)). Хоча ця кінетична інтерпретація є корисною, вона не враховує кілька важливих аспектів колігативного характеру зниження тиску пари. Більш суворе пояснення передбачає властивість ентропії, тема обговорення в більш пізній текстовій главі про термодинаміку. Для розуміння зниження тиску пари рідини достатньо зазначити, що більша ентропія розчину порівняно з його окремим розчинником та розчиненою речовиною служить для ефективної стабілізації молекул розчинника та перешкоджати їх випаровуванню. Більш низький тиск пари і відповідно більш висока температура кипіння, як описано в наступному розділі цього модуля.
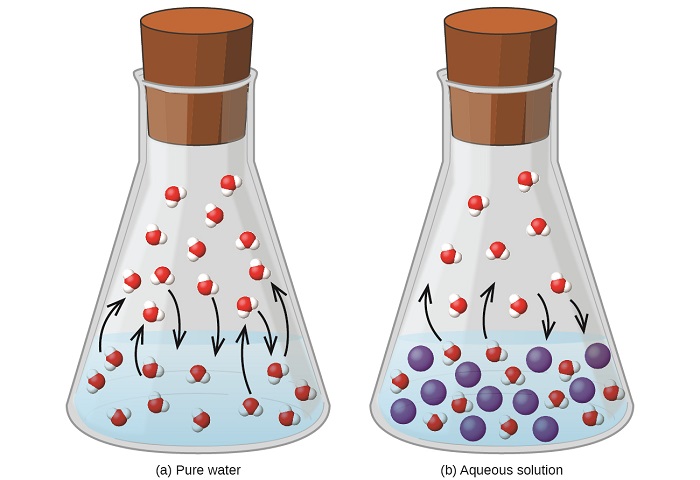
Взаємозв'язок між тиском пари компонентів розчину і концентраціями цих компонентів описується законом Рауля: парціальний тиск, що чиниться будь-яким компонентом ідеального розчину, дорівнює тиску пари чистого компонента, помноженому на його моль фракції в розчині.
\[P_\ce{A}=X_\ce{A}P^\circ_\ce{A} \label{11.5.5} \]
де Р А - парціальний тиск, що чиниться компонентом А в розчині,\(P^\circ_\ce{A}\) - тиск пари чистого А, а Х А - мольна частка А в розчині. (Моль фракція - одиниця концентрації, введена в розділі про гази.)
Нагадуючи, що загальний тиск газоподібної суміші дорівнює сумі парціальних тисків для всіх її складових (закон Дальтона парціальних тисків), загальний тиск пари, що чиниться розчином, що містить i компоненти, дорівнює
\[P_\ce{solution}=\sum_{i}P_i=\sum_{i}X_iP^\circ_i \label{11.5.6} \]
Нелетким речовиною вважається той, тиск пари якого незначний (P° ≈ 0), і тому тиск пари над розчином, що містить тільки нелеткі розчинні речовини, обумовлено тільки розчинником:
\[P_\ce{solution}=X_\ce{solvent}P^\circ_\ce{solvent} \label{11.5.7} \]
Обчислити тиск пари ідеального розчину, що містить 92,1 г гліцерину, C 3 H 5 (OH) 3 і 184,4 г етанолу, C 2 H 5 OH, при 40° C. Тиск пари чистого етанолу становить 0,178 атм при 40 °С. температура.
Рішення
Оскільки розчинник є єдиним летючим компонентом цього розчину, його тиск пари можна обчислити відповідно до закону Рауля як:
\(P_\ce{solution}=X_\ce{solvent}P^\circ_\ce{solvent}\)
Спочатку розрахуйте молярні кількості кожного компонента розчину, використовуючи надані дані маси.
\(\mathrm{92.1\cancel{g\:C_3H_5(OH)_3}×\dfrac{1\:mol\:C_3H_5(OH)_3}{92.094\cancel{g\:C_3H_5(OH)_3}}=1.00\:mol\:C_3H_5(OH)_3}\)
Далі розрахуйте мольну частку розчинника (етанолу) і використовуйте закон Рауля для обчислення тиску пари розчину.
\(X_\mathrm{C_2H_5OH}=\mathrm{\dfrac{4.000\:mol}{(1.00\:mol+4.000\:mol)}=0.800}\)
\(P_\ce{solv}=X_\ce{solv}P^\circ_\ce{solv}=\mathrm{0.800×0.178\:atm=0.142\:atm}\)
Розчин містить 5,00 г сечовини, СО (NH 2) 2 (нелеткий розчинний розчин) і 0,100 кг води. Якщо тиск пари чистої води при 25° C становить 23,7 торр, який тиск пари розчину?
- Відповідь
-
23,4 торр
Підвищення температури кипіння розчинника
Як описано в розділі про рідини і тверді речовини, температура кипіння рідини - це температура, при якій тиск її пари дорівнює атмосферному тиску навколишнього середовища. Оскільки тиск пари розчину знижується через наявність нелетких розчинів, цілком зрозуміло, що температура кипіння розчину згодом буде збільшена. Порівняно з чистим розчинником, розчин, отже, вимагатиме більш високої температури для досягнення будь-якого заданого тиску пари, включаючи один еквівалент тиску навколишньої атмосфери. Збільшення температури кипіння, що спостерігається при розчиненні нелеткої розчиненої речовини в розчиннику\(ΔT_b\), називається підвищенням температури кипіння і прямо пропорційно концентрації мола розчинених речовин:
\[ΔT_b=K_bm \label{11.5.8} \]
де
- \(K_\ce{b}\)є постійною точки кипіння, або ебулліоскопічна константа і
- \(m\)- концентрація моляль (моляльність) всіх розчинених видів.
Константи підйому температури кипіння - характерні властивості, які залежать від ідентичності розчинника. Значення K b для декількох розчинників наведені в табл\(\PageIndex{1}\).
| Розчинник | Температура кипіння (° C при 1 атм) | K b (См −1) | Температура замерзання (° C при 1 атм) | К ф (См −1) |
|---|---|---|---|---|
| вода | 100.0 | 0.512 | 0.0 | 1.86 |
| ацетат водню | 118.1 | 3.07 | 16.6 | 3.9 |
| бензолу | 80.1 | 2.53 | 5.5 | 5.12 |
| хлороформ | 61.26 | 3.63 | −63.5 | 4.68 |
| нітробензол | 210.9 | 5.24 | 5.67 | 8.1 |
Ступінь, в якій тиск пари розчинника знижується і температура кипіння підвищена, залежить від загальної кількості розчинених частинок, присутніх у певній кількості розчинника, а не від маси або розміру або хімічної ідентичності частинок. 1 м водний розчин сахарози (342 г/моль) і 1 м водний розчин етиленгліколю (62 г/моль) виявлять однакову температуру кипіння, оскільки кожен розчин має один моль розчинених частинок (молекул) на кілограм розчинника.
Яка температура кипіння 0,33 м розчину нелеткого розчиненого речовини в бензолі?
Рішення
Використовуйте рівняння, що стосується висоти точки кипіння, щоб розв'язати молярність, щоб вирішити цю задачу в два етапи.

- Обчисліть зміну температури кипіння.
\(ΔT_\ce{b}=K_\ce{b}m=2.53\:°\ce C\:m^{−1}×0.33\:m=0.83\:°\ce C\)
- Додайте висоту кипіння до температури кипіння чистого розчинника.
\(\mathrm{Boiling\: temperature=80.1\:°C+0.83\:°C=80.9\:°C}\)
Яка температура кипіння антифризу, описаного в прикладі\(\PageIndex{4}\)?
- Відповідь
-
109.2 °C
Знайдіть температуру кипіння розчину 92,1 г йоду\(\ce{I2}\), в 800,0 г хлороформу, припускаючи\(\ce{CHCl3}\), що йод нелеткий і що розчин ідеальний.
Рішення
Вирішити цю проблему ми можемо за допомогою чотирьох кроків.
- Перетворення з грам в молі\(\ce{I2}\) використання молярної маси\(\ce{I2}\) в коефіцієнт переведення одиниці виміру.
Результат: 0,363 моль
Визначають молярність розчину по кількості молів розчиненої речовини і маси розчинника, в кілограмах.
Результат: 0.454 м
Використовуйте пряму пропорційність між зміною температури кипіння та концентрацією моляль, щоб визначити, наскільки змінюється температура кипіння.
Результат: 1.65 °C
Визначте нову температуру кипіння від температури кипіння чистого розчинника і зміни.
Результат: 62.91 °C
Перевіряйте кожен результат як самооцінку.
Яка температура кипіння розчину 1,0 г гліцерину\(\ce{C3H5(OH)3}\), в 47,8 г води? Припустимо ідеальне рішення.
- Відповідь
-
100.12 °C
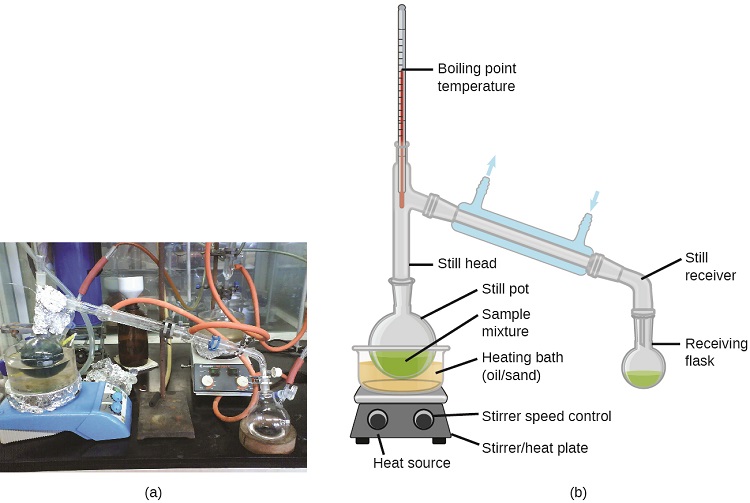
Дистиляція розчинів
Дистиляція - це методика поділу компонентів сумішей, яка широко застосовується як в лабораторних, так і в промислових умовах. Застосовується для очищення нафти, виділення продуктів бродіння та очищення води. Ця техніка поділу передбачає контрольоване нагрівання суміші зразків для вибіркового випаровування, конденсації та збору одного або декількох компонентів, що цікавлять. Типовий апарат для лабораторно-масштабних дистиляцій показаний на рис\(\PageIndex{2}\).
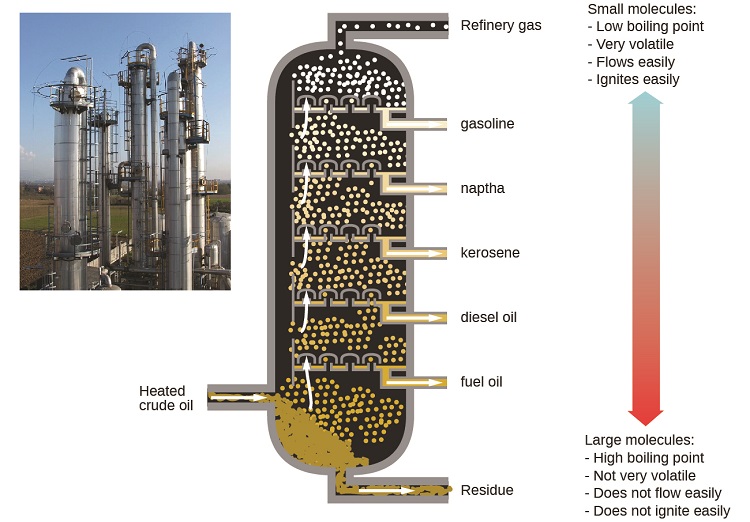
Нафтопереробні заводи використовують великомасштабну фракційну перегонку для поділу компонентів сирої нафти. Сира нафта нагрівається до високих температур біля основи високої фракціонуючої колони, випаровуючи багато компонентів, які піднімаються всередині колони. Оскільки випарені компоненти досягають адекватно прохолодних зон під час їх підйому, вони конденсуються і збираються. Зібрані рідини являють собою більш прості суміші вуглеводнів та інших нафтових сполук, які мають відповідний склад для різних застосувань (наприклад, дизельне паливо, гас, бензин), як показано на малюнку\(\PageIndex{3}\).
Пригнічення точки замерзання розчинника
Розчини замерзають при більш низьких температурах, ніж чисті рідини. Це явище використовується в схемах «протиобледеніння», які використовують сіль (рис.\(\PageIndex{4}\)), хлорид кальцію або сечовину для танення льоду на дорогах і тротуарах, а також у використанні етиленгліколю як «антифризу» в автомобільних радіаторах. Морська вода замерзає при більш низькій температурі, ніж прісна, і тому Північний Льодовитий і Антарктичний океани залишаються незамерзлими навіть при температурі нижче 0° C (як і рідини організму риб та інших холоднокровних морських тварин, що мешкають в цих океанах).

Зниження температури замерзання розведеного розчину порівняно з температурою чистого розчинника, Δ T f, називається депресією точки замерзання і прямо пропорційно моляльної концентрації розчиненої речовини
\[ΔT_\ce{f}=K_\ce{f}m \label{11.5.9} \]
де
- \(m\)це моляльна концентрація розчиненої речовини в розчиннику і
- \(K_f\)називається постійною депресії точки замерзання (або кріоскопічної константою).
Так само, як і для констант висоти точки кипіння, це характерні властивості, значення яких залежать від хімічної ідентичності розчинника. Значення K f для декількох розчинників наведені в табл\(\PageIndex{1}\).
Яка температура замерзання 0,33 м розчину нелеткого неелектролітного розчиненого речовини в бензолі, описаного в прикладі\(\PageIndex{4}\)?
Рішення
Використовуйте рівняння, що стосується депресії точки замерзання, щоб розв'язати моляльність, щоб вирішити цю проблему в два етапи.

- Обчисліть зміну температури замерзання. \[ΔT_\ce{f}=K_\ce{f}m=5.12\:°\ce C\:m^{−1}×0.33\:m=1.7\:°\ce C \nonumber \]
- Відніміть зміну температури замерзання, що спостерігається, від точки замерзання чистого розчинника. \[\mathrm{Freezing\: Temperature=5.5\:°C−1.7\:°C=3.8\:°C} \nonumber \]
Яка температура замерзання 1,85 м розчину нелеткого неелектролітного розчиненого в нітробензолі?
- Відповідь
-
-9.3 °C
Хлорид натрію і його аналоги 2 групи кальцію і хлориду магнію часто використовуються для знежирення доріг і тротуарів, через те, що розчин будь-якої з цих солей матиме температуру замерзання нижче 0° C, температуру замерзання чистої води. Солі металів групи 2 часто змішують з більш дешевим і доступним хлоридом натрію («кам'яною сіллю») для використання на дорогах, оскільки вони, як правило, дещо менш корозійні, ніж NaCl, і вони забезпечують більшу депресію температури замерзання, оскільки вони дисоціюють, щоб отримати три частинки на одиниця формули, а не дві частинки, як хлорид натрію.
Оскільки ці іонні сполуки, як правило, прискорюють корозію металу, вони не були б розумним вибором для використання в антифризі для радіатора у вашому автомобілі або для зменшення льоду літака до зльоту. Для цих застосувань часто використовуються ковалентні сполуки, такі як етилен або пропіленгліколь. Гликоли, що використовуються в радіаторній рідині, не тільки знижують температуру замерзання рідини, але і підвищують температуру кипіння, роблячи рідину корисною як взимку, так і влітку. Нагріті гліколі часто розпилюють на поверхню літаків перед зльотом в негоду взимку, щоб видалити вже утворився лід і запобігти утворенню більшої кількості льоду, що було б особливо небезпечно, якщо він утворився на керуючих поверхнях літака (Відео\(\PageIndex{1}\)).
Відео\(\PageIndex{1}\): Заглиблення точки замерзання експлуатується для видалення льоду з керуючих поверхонь літака.
Діаграма стану для водного розчину неелектроліту
Колігативні ефекти на тиск пари, температуру кипіння та температуру замерзання, описані в попередньому розділі, зручно підсумовуються шляхом порівняння діаграм стану чистої рідини та розчину, отриманого з цієї рідини. Фазові діаграми для води і водного розчину наведені на малюнку\(\PageIndex{5}\).
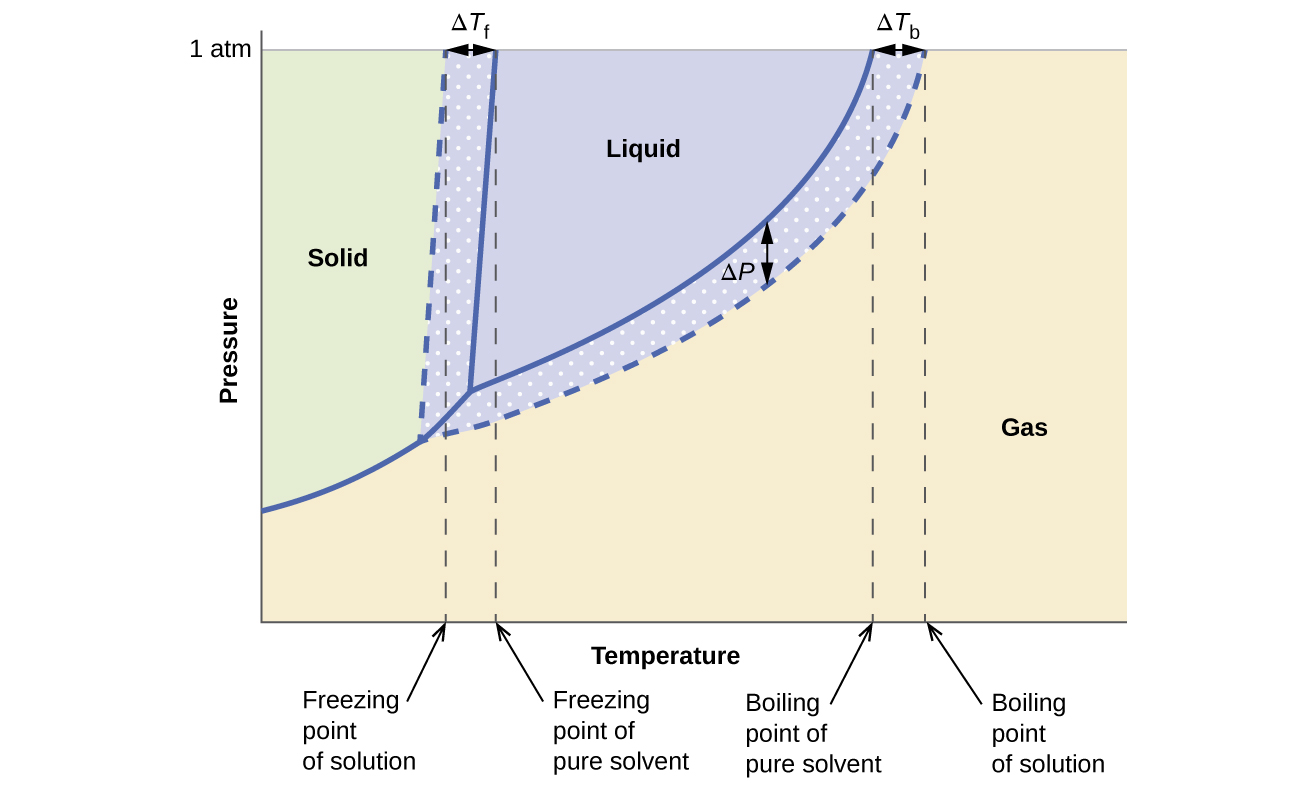
Крива рідина-пара для розчину розташована під відповідною кривою для розчинника, зображуючи зниження тиску пари, Δ P, що виникає внаслідок розчинення нелеткого розчиненого речовини. Отже, при будь-якому заданому тиску температура кипіння розчину спостерігається при більш високій температурі, ніж у чистого розчинника, що відображає підвищення температури кипіння, Δ T b, пов'язане з наявністю нелеткого розчиненого речовини. Крива тверда рідина для розчину зміщується ліворуч від кривої чистого розчинника, що представляє депресію точки замерзання Δ Tf, що супроводжує утворення розчину. Нарешті, зверніть увагу, що криві твердого газу для розчинника та його розчину ідентичні. Це стосується багатьох розчинів, що містять рідкі розчинники та нелеткі розчинні речовини. Так само, як і для випаровування, коли розчин такого роду заморожується, насправді це просто молекули розчинника, які проходять перехід рідина до твердого тіла, утворюючи чистий твердий розчинник, який виключає розчинені види. Таким чином, тверда і газоподібна фази складаються тільки розчинником, і тому переходи між цими фазами не схильні до колігативного впливу.
Осмос і осмотичний тиск розчинів
Ряд природних і синтетичних матеріалів виявляють селективне проникнення, тобто тільки молекули або іони певного розміру, форми, полярності, заряду і так далі здатні проходити (пронизувати) матеріал. Біологічні клітинні мембрани забезпечують елегантні приклади селективного проникнення в природі, тоді як діалізні трубки, що використовуються для видалення метаболічних відходів з крові, є більш спрощеним технологічним прикладом. Незалежно від того, як вони можуть бути виготовлені, ці матеріали прийнято називати напівпроникними мембранами.
Розглянемо апарат, показаний на малюнку\(\PageIndex{6}\), в якому зразки чистого розчинника і розчину розділені мембраною, яку можуть проникати тільки молекули розчинника. Молекули розчинника будуть дифундувати по мембрані в обох напрямках. Оскільки концентрація розчинника більша в чистому розчиннику, ніж розчин, ці молекули будуть дифундувати з боку розчинника мембрани на сторону розчину з більш швидкою швидкістю, ніж вони будуть у зворотному напрямку. Результатом є чистий перенесення молекул розчинника з чистого розчинника в розчин. Дифузійний перенесення молекул розчинника через напівпроникну мембрану - це процес, відомий як осмос.
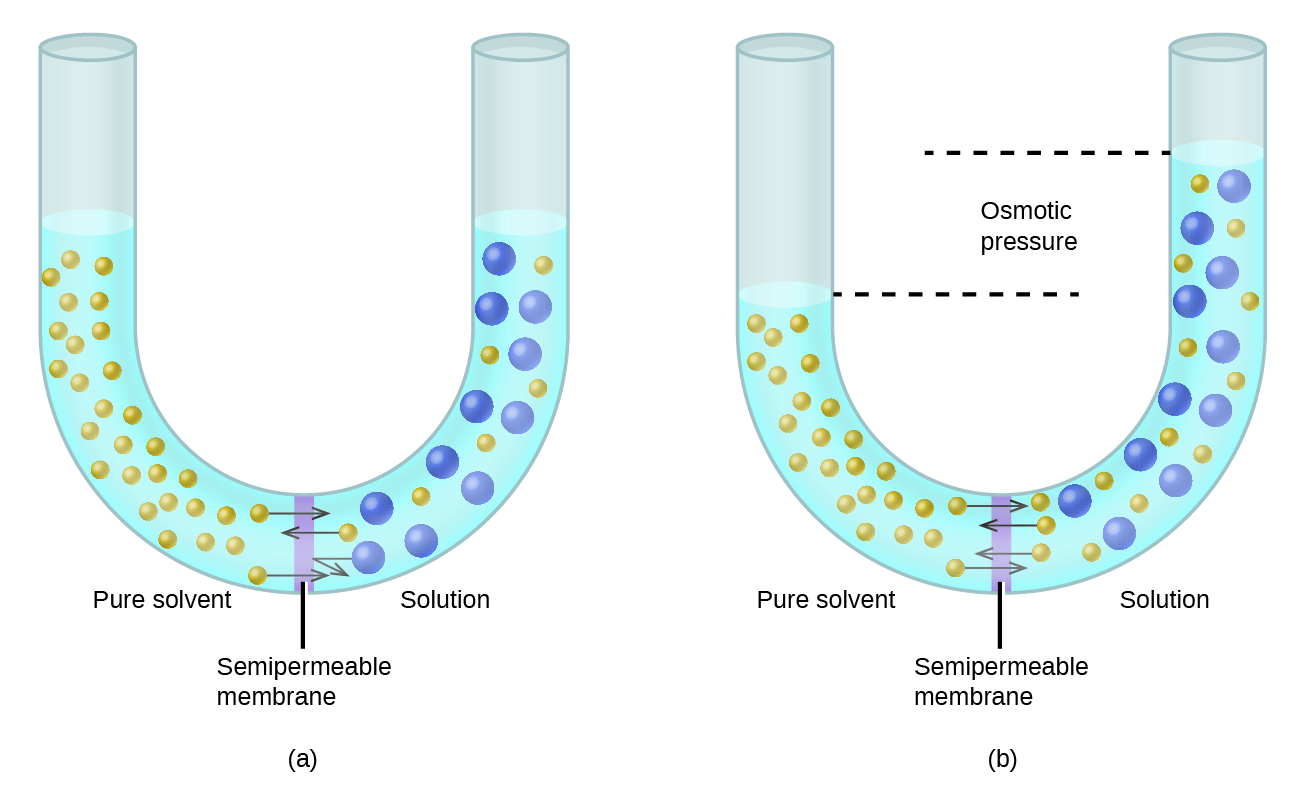
Коли осмос здійснюється в апараті, подібному до показаного на малюнку\(\PageIndex{6}\), обсяг розчину збільшується в міру його розведення накопиченням розчинника. Це призводить до підвищення рівня розчину, збільшуючи його гідростатичний тиск (через вагу стовпа розчину в трубці) і призводить до більш швидкого перенесення молекул розчинника назад в чисту сторону розчинника. Коли тиск досягає значення, яке дає швидкість зворотного перенесення розчинника, рівну швидкості осмосу, об'ємна передача розчинника припиняється. Цей тиск називається осмотичним тиском (e\(\Pi\)) розчину. Осмотичний тиск розведеного розчину пов'язаний з його молярністю розчиненої речовини, М, і абсолютною температурою, Т, відповідно до рівняння
\[Π=MRT \label{11.5.10} \]
де\(R\) - універсальна газова константа.
Який осмотичний тиск (атм) 0,30 М розчину глюкози у воді, який використовується для внутрішньовенної інфузії при температурі тіла, 37 °С?
Рішення
Ми можемо знайти осмотичний тиск\(Π\), використовуючи Equation\ ref {11.5.10}, де T знаходиться за шкалою Кельвіна (310 К) і значення R виражається у відповідних одиницях (0,08206 л атм/моль K).
\ [\ почати {вирівнювати*}
π&= MRT\\
&=\ матхм {0.03\ :моль/л × 0.08206\: L\: атм/моль\: K × 310\: K}\
&=\ mathrm {7.6\ :атм}
\ кінець {вирівнювати*}\ nonumber\]
Що таке осмотичний тиск (атм) розчин об'ємом 0,750 л, який містить 5,0 г метанолу, CH 3 ОН, у воді при 37 °С?
- Відповідь
-
5,3 атм
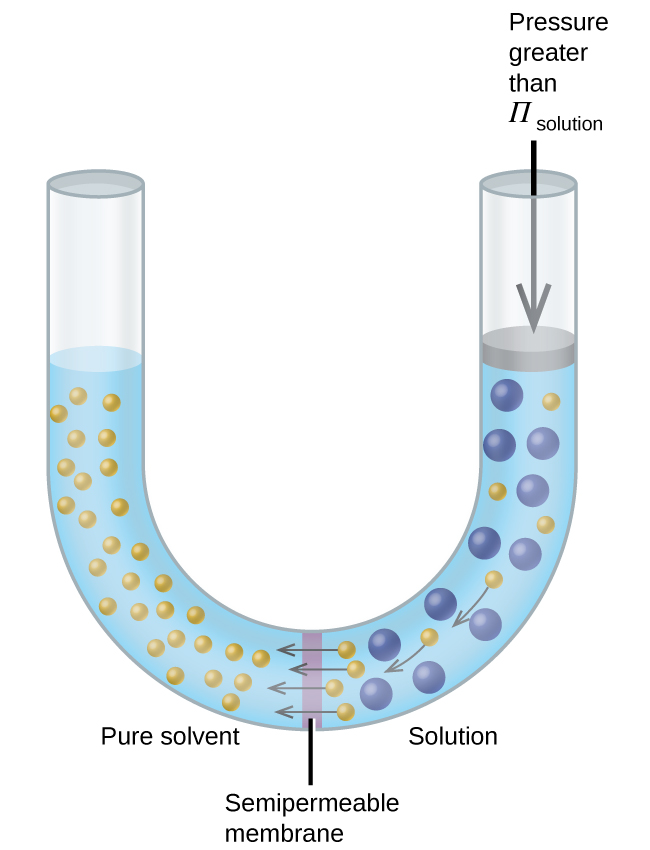
Якщо розчин поміщений в апарат, подібний до показаного на малюнку\(\PageIndex{7}\), подаючи тиск більше осмотичного тиску розчину, змінює осмос і виштовхує молекули розчинника з розчину в чистий розчинник. Ця методика зворотного осмосу використовується для масштабного опріснення морської води і в менших масштабах для отримання водопровідної води високої чистоти для пиття.
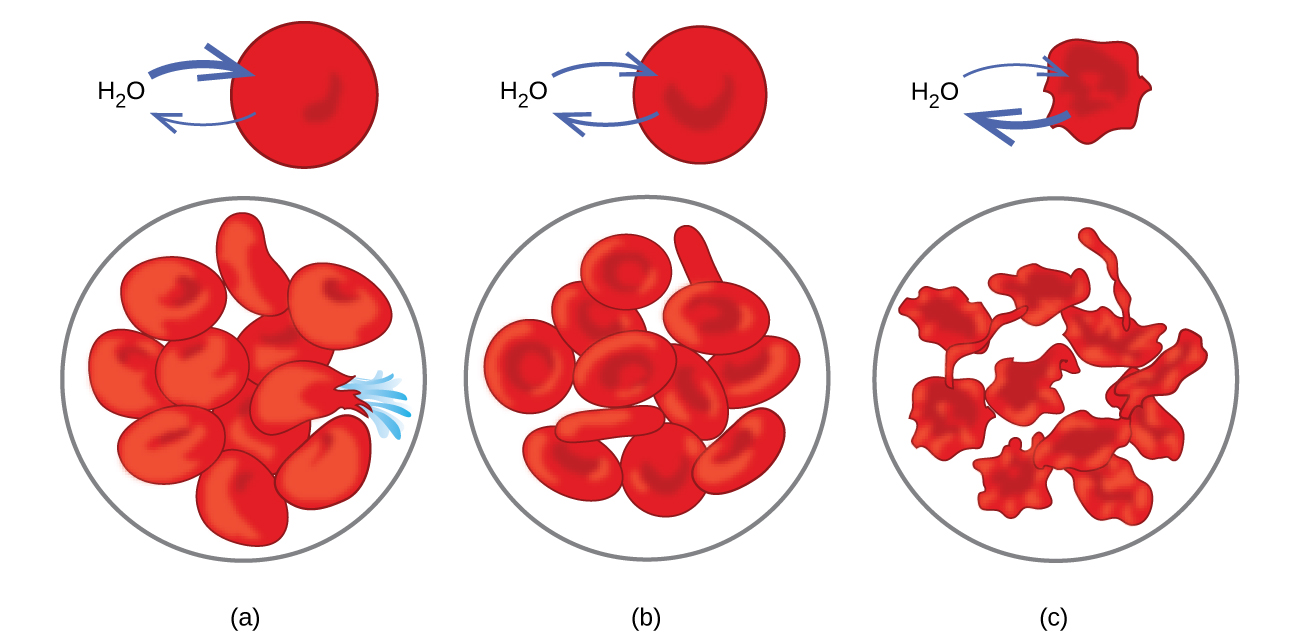
Приклади осмосу очевидні в багатьох біологічних системах, оскільки клітини оточені напівпроникними мембранами. Морква та селера, які стали млявими, оскільки втратили воду, можна знову зробити хрусткими, помістивши їх у воду. Вода переміщається в клітини моркви або селери шляхом осмосу. Огірок, поміщений в концентрований розчин солі, втрачає воду від осмосу і поглинає трохи солі, щоб стати розсілом. Осмос також може впливати на клітини тварин. Концентрації розчинених речовин особливо важливі при введенні розчинів в організм. Розчинені речовини в клітинних рідинях організму і сироватці крові дають цим розчинам осмотичний тиск приблизно 7,7 атм. Розчини, що вводяться в організм, повинні мати такий же осмотичний тиск, як і сироватка крові; тобто вони повинні бути ізотонічними з сироваткою крові. Якщо менш концентрований розчин, гіпотонічний розчин, вводять в достатній кількості для розрідження сироватки крові, вода з розведеної сироватки шляхом осмосу переходить в клітини крові, викликаючи розширення і розрив клітин. Цей процес називається гемолізом. При введенні більш концентрованого розчину, гіпертонічного розчину, клітини втрачають воду до більш концентрованого розчину, зморщуються і, можливо, гинуть в процесі, званому цренацією (рис. 11.5.8).
Визначення молярних мас
Осмотичний тиск і зміни температури замерзання, температури кипіння та тиску пари прямо пропорційні концентрації присутньої розчиненої речовини. Отже, ми можемо використовувати вимірювання однієї з цих властивостей для визначення молярної маси розчиненої речовини за результатами вимірювань.
Виявлено, що розчин 4,00 г неелектроліту, розчиненого в 55,0 г бензолу, замерзає при 2,32 °С.
Рішення
Вирішити цю проблему ми можемо за допомогою наступних кроків.
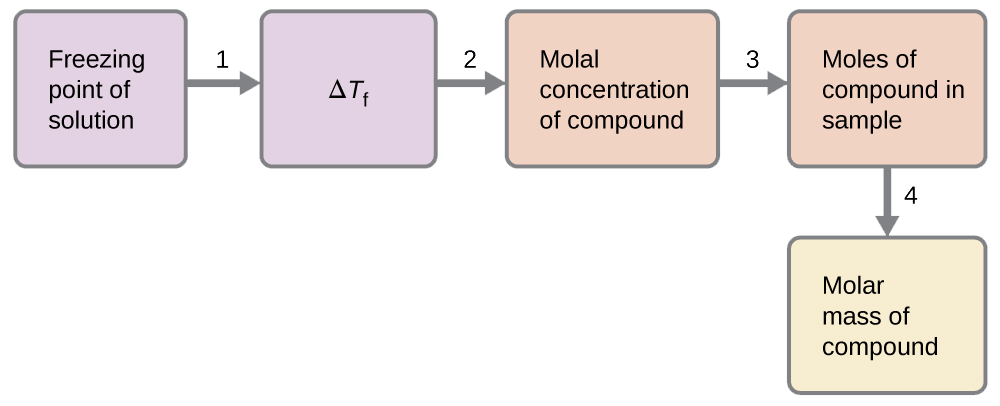
- Визначте зміну температури замерзання від спостережуваної температури замерзання і температури замерзання чистого бензолу (табл. 11.5.1).
- Визначте моляльну концентрацію з K f, постійної температури замерзання для бензолу (табл. 11.5.1) і Δ T f.
\(ΔT_\ce{f}=K_\ce{f}m\)
\(m=\dfrac{ΔT_\ce{f}}{K_\ce{f}}=\dfrac{3.2\:°\ce C}{5.12\:°\ce C m^{−1}}=0.63\:m\)
- Визначте кількість молів з'єднання в розчині з концентрації моля і маси розчинника, використовуваного для виготовлення розчину.
\(\mathrm{Moles\: of\: solute=\dfrac{0.62\:mol\: solute}{1.00\cancel{kg\: solvent}}×0.0550\cancel{kg\: solvent}=0.035\:mol}\)
- Визначте молярну масу по масі розчиненої речовини і кількості молів в цій масі.
\(\mathrm{Molar\: mass=\dfrac{4.00\:g}{0.034\:mol}=1.2×10^2\:g/mol}\)
Розчин 35,7 г неелектроліту в 220,0 г хлороформу має температуру кипіння 64,5 °С Яка молярна маса цієї сполуки?
- Відповідь
-
1,8 × 10 2 г/моль
Проба водного розчину на 0,500 л, що містить 10,0 г гемоглобіну, має осмотичний тиск 5,9 торр при 22 °С.
Рішення
Ось один набір кроків, які можна використовувати для вирішення проблеми:
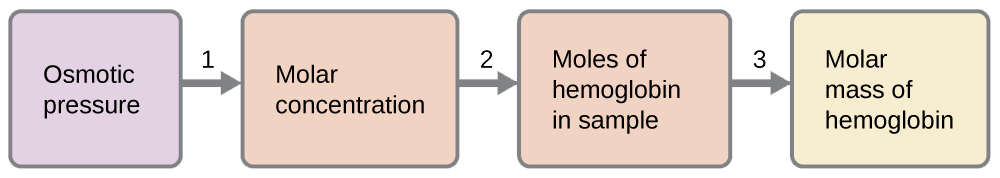
- \[\Pi=\mathrm{\dfrac{5.9\:torr×1\:atm}{760\:torr}=7.8×10^{−3}\:atm} \nonumber \]
\[\Pi=MRT \nonumber \]
\(M=\dfrac{Π}{RT}=\mathrm{\dfrac{7.8×10^{−3}\:atm}{(0.08206\:L\: atm/mol\: K)(295\:K)}=3.2×10^{−4}\:M}\)
- \(\mathrm{moles\: of\: hemoglobin=\dfrac{3.2×10^{−4}\:mol}{1\cancel{L\: solution}}×0.500\cancel{L\: solution}=1.6×10^{−4}\:mol}\)
- Визначте молярну масу з маси гемоглобіну і кількості молей в цій масі.
\(\mathrm{molar\: mass=\dfrac{10.0\:g}{1.6×10^{−4}\:mol}=6.2×10^4\:g/mol}\)
Яка молярна маса білка, якщо розчин 0,02 г білка в 25,0 мл розчину має осмотичний тиск 0,56 торр при 25 °С?
- Відповідь
-
2,7 × 10 4 г/моль
Колігативні властивості електролітів
Як зазначалося раніше в цьому модулі, колігативні властивості розчину залежать тільки від кількості, а не від виду розчинених видів розчинених речовин. Наприклад, 1 моль будь-якого неелектроліту, розчиненого в 1 кілограмі розчинника, виробляє таке ж зниження температури замерзання, як і 1 моль будь-якого іншого неелектроліту. Однак 1 моль хлориду натрію (електроліту) при розчиненні в розчині утворює 2 молі іонів. Кожен окремий іон виробляє такий же вплив на температуру замерзання, як і одна молекула.
Концентрація іонів в морській воді приблизно така ж, як і в розчині, що містить 4,2 г NaCl, розчиненого в 125 г води. Припустимо, що кожен з іонів в розчині NaCl надає такий же вплив на температуру замерзання води, як неелектролітна молекула, і визначте температуру замерзання розчину (яка приблизно дорівнює температурі замерзання морської води).
Рішення
Ми можемо вирішити цю проблему, використовуючи наступний ряд кроків.
- Перетворіть з грамів в молі NaCl, використовуючи молярну масу NaCl в коефіцієнті переведення одиниці виміру. Результат: 0,072 моль NaCl
- Визначити кількість молів іонів, присутніх в розчині, використовуючи кількість молів іонів в 1 моль NaCl як коефіцієнт перетворення (2 моль іонів/1 моль NaCl). Результат: 0,14 моль іони
- Визначають молярність іонів в розчині з числа молей іонів і маси розчинника, в кілограмах. Результат: 1.1 м
- Використовуйте пряму пропорційність між зміною температури замерзання та концентрацією молялу, щоб визначити, наскільки змінюється температура замерзання. Результат: 2.0 °C
- Визначте нову точку замерзання від точки замерзання чистого розчинника та зміни. Результат: −2.0 °C
Перевіряйте кожен результат як самооцінку.
Припустимо, що кожен з іонів хлориду кальцію, CaCl 2, має такий же вплив на температуру замерзання води, як неелектролітна молекула. Розрахуйте температуру замерзання розчину 0,724 г CaCl 2 в 175 г води.
- Відповідь
-
−0.208 °C
Припускаючи повну дисоціацію, 1,0 м водний розчин NaCl містить 2,0 моль іонів (1,0 моль Na + і 1,0 моль Cl −) на кожен кілограм води, і очікується його зниження температури замерзання
\[ΔT_\ce{f}=\mathrm{2.0\:mol\: ions/kg\: water×1.86\:°C\: kg\: water/mol\: ion=3.7\:°C.} \label{11.5.11} \]
При фактичному приготуванні цього розчину і його замерзанні температури замерзання, однак, отримують значення 3,4° C. Подібні розбіжності спостерігаються для інших іонних сполук, і відмінності між виміряними та очікуваними значеннями колігативних властивостей зазвичай стають більш значними у міру збільшення концентрації розчинених речовин. Ці спостереження говорять про те, що іони хлориду натрію (та інших сильних електролітів) не повністю дисоціюються в розчині.
Щоб врахувати це і уникнути помилок, що супроводжують припущення про тотальну дисоціацію, використовується експериментально виміряний параметр, названий на честь лауреата Нобелівської премії німецького хіміка Якобуса Генрікуса ван Гоффа. Коефіцієнт Ван Гофа (i) визначається як відношення розчинених частинок у розчині до кількості розчинених одиниць формули:
\[i=\dfrac{\textrm{moles of particles in solution}}{\textrm{moles of formula units dissolved}} \label{11.5.12} \]
Значення вимірюваних факторів Ван не Гоффа для декількох розчинених речовин разом з прогнозованими значеннями, що передбачають повну дисоціацію, наведені в табл\(\PageIndex{2}\).
| Електроліт | Частинки в розчині | i (Передбачений) | i (Вимірюється) |
|---|---|---|---|
| HCl | H +, Cl − | 2 | 1.9 |
| NaCl | Na +, Cl − | 2 | 1.9 |
| МГСО 4 | Мг 2 +,\(\ce{SO4^2-}\) | 2 | 1.3 |
| MgCl 2 | Мг 2 +, 2Сл − | 3 | 2.7 |
| FeCl 3 | Фе 3 +, 3Кл − | 4 | 3.4 |
| глюкоза (неелектроліт) | З 12 Ч 22 З 11 | 1 | 1.0 |
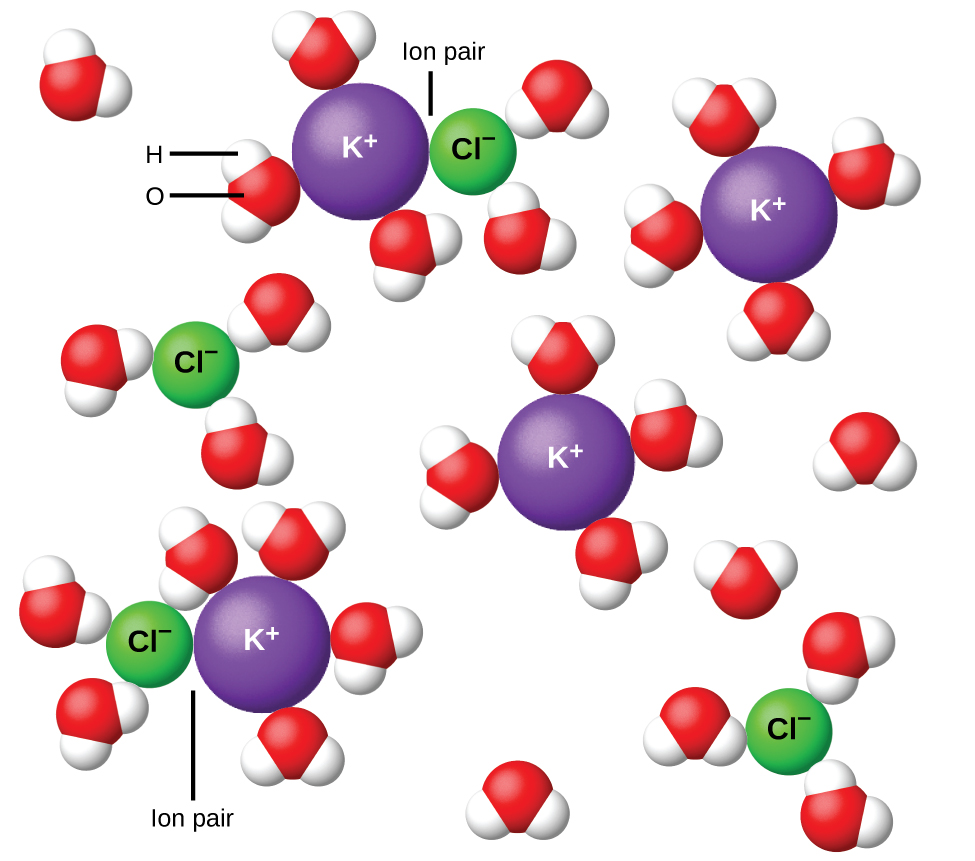
У 1923 році хіміки Пітер Дебай і Еріх Хюкель запропонували теорію пояснення видимої неповної іонізації сильних електролітів. Вони припустили, що хоча внутрішнє тяжіння у водному розчині дуже сильно знижується сольвацією іонів та ізоляційною дією полярного розчинника, воно не повністю зводиться до нуля. Залишкові атракціони перешкоджають іонам поводитися як абсолютно незалежні частинки (рис.\(\PageIndex{9}\)). У деяких випадках позитивний і негативний іон може насправді торкнутися, даючи сольвату одиницю, звану іонною парою. Таким чином, активність, або ефективна концентрація, будь-якого конкретного виду іонів менше, ніж вказана фактичною концентрацією. Іони стають все ширше відокремленими, чим більше розбавляють розчин, а залишкових інтеріонних атракціонів стає все менше і менше. Таким чином, в екстремально розведених розчинах ефективні концентрації іонів (їх діяльність) по суті рівні фактичним концентраціям. Зауважимо, що коефіцієнти van 't Hoff для електролітів у таблиці\(\PageIndex{2}\) призначені для 0,05 м розчинів, при концентрації яких значення i для NaCl становить 1,9, на відміну від ідеального значення 2.
Резюме
Властивості розчину, які залежать тільки від концентрації розчинених частинок, називаються колігативними властивостями. Вони включають зміни тиску пари, температури кипіння і температури замерзання розчинника в розчині. Величини цих властивостей залежать тільки від загальної концентрації розчинених частинок в розчині, а не від типу частинок. Загальна концентрація розчинених частинок в розчині також визначає його осмотичний тиск. Це тиск, який необхідно прикладати до розчину, щоб запобігти дифузії молекул чистого розчинника через напівпроникну мембрану в розчин. Іонні сполуки можуть не повністю дисоціюватися в розчині через ефекти активності, і в цьому випадку спостерігаються колігативні ефекти можуть бути меншими, ніж передбачалося.
Ключові рівняння
- \(\left(P_\ce{A}=X_\ce{A}P^\circ_\ce{A}\right)\)
- \(P_\ce{solution}=\sum_{i}P_i=\sum_{i}X_iP^\circ_i\)
- \(P_\ce{solution}=X_\ce{solvent}P^\circ_\ce{solvent}\)
- Δ Т б = К б м
- Δ Т ф = К ф м
- = МРТ
Виноски
- Показаний для порівняння неелектроліт.
Глосарій
- висота точки кипіння
- підвищення температури кипіння рідини шляхом додавання розчиненої речовини
- постійна висота точки кипіння
- константа пропорційності в рівнянні, що стосується висоти точки кипіння до розчиненої моляльності; також відома як ебулліоскопічна константа
- колігативна властивість
- властивість розчину, яке залежить тільки від концентрації розчиненого виду
- відродження
- процес, за допомогою якого біологічні клітини зморщуються через втрату води осмосом
- депресія точки замерзання
- зниження температури замерзання рідини шляхом додавання розчиненої речовини
- постійна депресія точки замерзання
- (також, кріоскопічна константа) константа пропорційності в рівнянні, що стосується депресії точки замерзання до розчиненої моляльності
- гемоліз
- розрив еритроцитів через скупчення надлишку води осмосом
- гіпертонічний
- більшого осмотичного тиску
- гіпотонічних
- меншого осмотичного тиску
- іонна пара
- сольватированная аніон/катіонна пара утримується помірним електростатичним притяганням
- ізотонічного
- рівного осмотичного тиску
- моляльність (м)
- одиниця концентрації, яка визначається як відношення чисел молів розчиненої речовини до маси розчинника в кілограмах
- осмосу
- дифузія молекул розчинника через напівпроникну мембрану
- осмотичний тиск ()
- протистояння тиску, необхідного для запобігання об'ємного перенесення молекул розчинника через напівпроникну мембрану
- Закон Рауля
- парціальний тиск, що чиниться компонентом розчину, дорівнює добутку мольної фракції компонента в розчині і його рівноважного тиску пари в чистому стані
- напівпроникна мембрана
- мембрана, яка вибірково дозволяє проходження певних іонів або молекул
- Фактор Хоффа (i)
- відношення кількості молів частинок в розчині до кількості молів формульних одиниць, розчинених в розчині
