11.5: Колоїди
- Page ID
- 22523
- Опишіть склад і властивості колоїдних дисперсій
- Перелічіть та поясніть кілька технологічних застосувань колоїдів
У дитинстві ви, можливо, робили суспензії, такі як суміші бруду та води, борошна та води, або суспензії твердих пігментів у воді, відомої як темперна фарба. Ці суспензії є неоднорідними сумішами, що складаються з відносно великих частинок, які видно (або які можна побачити за допомогою лупи). Вони каламутні, а зважені частинки осідають після змішування. З іншого боку, коли ми робимо розчин, ми готуємо однорідну суміш, в якій не відбувається осідання і в якій розчинені види є молекулами або іонами. Розчини демонструють зовсім іншу поведінку від суспензій. Розчин може бути кольоровим, але він прозорий, молекули або іони невидимі, і вони не осідають на стоянні. Група сумішей, званих колоїдами (або колоїдними дисперсіями), проявляє проміжні властивості між властивостями суспензій і розчинів (рис.\(\PageIndex{1}\)). Частинки в колоїді більші, ніж більшість простих молекул; однак колоїдні частинки досить малі, щоб вони не осідали при стоянні.

Частинки в колоїді досить великі, щоб розсіювати світло, явище називається ефектом Тиндалла. Це може зробити колоїдні суміші каламутними або непрозорими, наприклад, прожекторні промені, показані на малюнку\(\PageIndex{2}\). Хмари - це колоїдні суміші. Вони складаються з крапель води, які набагато більші за молекули, але вони досить малі, щоб вони не осідали.

Термін «колоїдний» - від грецьких слів kolla, що означає «клей», і ейдос, що означає «як» - вперше був використаний Томасом Гремом в 1861 році для класифікації сумішей, таких як крохмаль у воді та желатин. Багато колоїдні частинки являють собою агрегати сотень або тисяч молекул, але інші (наприклад, білки і полімерні молекули) складаються з однієї надзвичайно великої молекули. Молекули білка та синтетичного полімеру, що утворюють колоїди, можуть мати молекулярні маси в межах від декількох тисяч до багатьох мільйонів одиниць атомної маси.
Аналогічно ідентифікації компонентів розчину як «розчинений» та «розчинник», компоненти колоїду також класифікуються відповідно до їх відносних кількостей. Компонент твердих частинок, який зазвичай присутній у відносно незначній кількості, називається дисперсною фазою, а речовина або розчин, протягом якого диспергуються частинки, називається дисперсійним середовищем. Колоїди можуть включати практично будь-яку комбінацію фізичних станів (газ в рідині, рідина в твердому, тверде в газі і т.д.), про що ілюструють приклади колоїдних систем, наведених в табл\(\PageIndex{1}\).
| дисперсна фаза | Дисперсійне середовище | Поширені приклади | Ім'я |
|---|---|---|---|
| твердий | газ | дим, пил | — |
| твердий | рідкий | крохмаль у воді, деякі фарби, фарби, молоко магнезії | соль |
| твердий | твердий | деякі кольорові дорогоцінні камені, деякі сплави | — |
| рідкий | газ | хмари, тумани, тумани, спреї | аерозоль |
| рідкий | рідкий | молоко, майонез, вершкове масло | емульсія |
| рідкий | твердий | желе, гелі, перли, опал (H 2 O в SiO 2) | гель |
| газ | рідкий | пінки, збиті вершки, збиті яєчні білки | піна |
| газ | твердий | пемза, плаваючі мило | — |
Підготовка колоїдних систем
Ми можемо підготувати колоїдну систему, виробляючи частинки колоїдних розмірів і розподіляючи ці частинки по всьому дисперсійному середовищі. Частинки колоїдного розміру утворюються двома методами:
- Методи дисперсії: тобто шляхом руйнування більших частинок. Наприклад, фарбувальні пігменти отримують шляхом диспергування великих частинок шляхом подрібнення в спеціальних млинах.
- Методи конденсації: тобто зростання з менших одиниць, таких як молекули або іони. Наприклад, хмари утворюються, коли молекули води конденсуються і утворюють дуже дрібні крапельки.
Кілька твердих речовин при контакті з водою спонтанно диспергуються і утворюють колоїдні системи. Желатин, клей, крохмаль і зневоднене сухе молоко поводяться таким чином. Частинки вже колоїдного розміру, вода їх просто розганяє. Сухі частинки молока колоїдного розміру отримують шляхом зневоднення молочного спрею. Деякі пульверизатори виробляють колоїдні дисперсії рідини в повітрі.
Ми можемо приготувати емульсію, струшуючи разом або змішуючи дві рідини, що не змішуються. Це розбиває одну рідину на крапельки колоїдного розміру, які потім розходяться по всій іншій рідини. Розливи нафти в океані можуть бути важко очистити, частково тому, що хвильова дія може призвести до утворення нафти і води емульсії. Однак у багатьох емульсіях дисперсна фаза має тенденцію до злиття, утворюють великі краплі та відокремлюються. Тому емульсії зазвичай стабілізуються емульгатором - речовиною, що пригнічує коалесценцію дисперсної рідини. Наприклад, трохи мила стабілізує емульсію гасу у воді. Молоко являє собою емульсію молочного жиру у воді, з білком казеїном в якості емульгатора. Майонез являє собою емульсію олії в оцті, з компонентами яєчного жовтка в якості емульгаторів.
Методи конденсації утворюють колоїдні частинки шляхом агрегації молекул або іонів. Якщо частинки виростають за межі колоїдного діапазону розмірів, утворюються краплі або опади, і колоїдна система не призводить. Хмари утворюються, коли молекули води агрегуються і утворюють частинки колоїдного розміру. Якщо ці частинки води зливаються, утворюючи адекватно великі краплі води рідкої води або кристали твердої води, вони осідають з неба як дощ, мокрий сніг або сніг. Багато методи конденсації передбачають хімічні реакції. Ми можемо приготувати червону колоїдну суспензію гідроксиду заліза (III) шляхом змішування концентрованого розчину хлориду заліза (III) з гарячою водою:
\[\mathrm{Fe^{3+}}_{(aq)}+\mathrm{3Cl^-}_{(aq)}+\mathrm{6H_2O}_{(l)}⟶\mathrm{Fe(OH)}_{3(s)}+\mathrm{H_3O^+}_{(aq)}+\mathrm{3Cl^-}_{(aq)} \label{11.6.1} \]
Колоїдний золь золота виникає внаслідок відновлення дуже розведеного розчину хлориду золота (III) відновником, таким як формальдегід, хлорид олова (II) або сульфат заліза (II):
\[\ce{Au}^{3+}+ \ce{3e}^− \rightarrow \ce{Au} \label{11.6.2} \]
Деякі золоті золі, приготовані в 1857 році, все ще залишаються неушкодженими (частинки не злилися і не осіли), що ілюструє довгострокову стабільність багатьох колоїдів.
Мило та миючі засоби
Піонери виготовляли мило шляхом кип'ятіння жирів сильно основним розчином, виготовленим шляхом вилуговування карбонату калію\(\ce{K_2CO_3}\), з деревної золи гарячою водою. Тваринні жири містять поліефіри жирних кислот (довголанцюгові карбонові кислоти). Коли тваринні жири обробляються основою, як карбонат калію або гідроксид натрію, утворюються гліцерин і солі жирних кислот, таких як пальмітинова, олеїнова та стеаринова кислоти. Солі жирних кислот називаються милами. Натрієва сіль стеаринової кислоти, стеарат натрію, має формулу\(\ce{C_{17}H_{35}CO_2Na}\) і містить незаряджений неполярний вуглеводневий ланцюг,\(\mathrm{C_{17}H_{35}-}\) блок, і іонно-карбоксилатну групу -\(-\mathrm{\sideset{ }{_{2}^{-}}{CO}}\) одиницю (рис.\(\PageIndex{3}\)).
Миючі засоби (замінники мила) також містять неполярні вуглеводневі ланцюги\(\mathrm{C_{12}H_{25}—}\), такі як, і іонну групу, таку як сульфат\(—\mathrm{\sideset{ }{_{3}^{-}}{OSO}}\), або сульфонат\(—\mathrm{\sideset{ }{_{3}^{-}}{SO}}\) (рис.\(\PageIndex{4}\)). Мило утворює нерозчинні сполуки кальцію та магнію у жорсткій воді; миючі засоби утворюють водорозчинні продукти — безсумнівна перевага для миючих засобів.
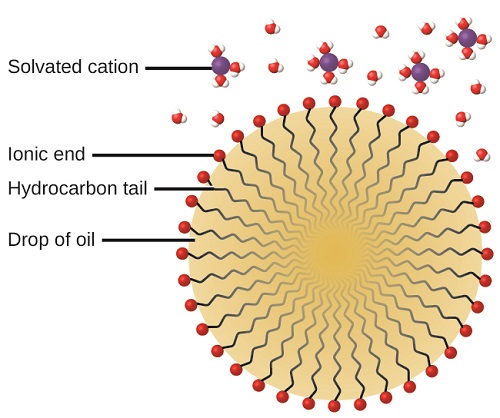
Очищаючу дію мила та миючих засобів можна пояснити з точки зору структур задіяних молекул. Вуглеводневий (неполярний) кінець молекули мила або миючого засобу розчиняється або притягується до неполярних речовин, таких як олія, жир або частинки бруду. Іонний кінець приваблює вода (полярна), проілюстрована на рис\(\PageIndex{5}\). В результаті молекули мила або миючого засобу орієнтуються на межі розділу між частинками бруду та водою, тому вони діють як своєрідний міст між двома різними видами речовин, неполярними та полярними. Такі молекули називаються амфіфільними, оскільки вони мають як гідрофобну («боязнь води») частину, так і гідрофільну («водолюбну») частину. Як наслідок, частинки бруду стають зваженими у вигляді колоїдних частинок і легко змиваються.
Вибух нафтової бурової установки Deepwater Horizon 20 квітня 2010 року в Мексиканській затоці поблизу Міссісіпі почався найбільший морський розлив нафти в історії нафти. За 87 днів після вибуху, за оцінками, 4,9 мільйона барелів (210 мільйонів галонів) нафти витікала з розриву свердловини на 5000 футів нижче поверхні води. Колодязь був остаточно оголошений опечатаним 19 вересня 2010 року.
Сира нафта не змішується і менш щільна, ніж вода, тому пролита олія піднялася на поверхню води. Плаваючі стріли, скиммерні кораблі та контрольовані опіки використовувалися для видалення нафти з поверхні води в спробі захистити пляжі та водно-болотні угіддя вздовж узбережжя Перської затоки. На додаток до видалення нафти, були також зроблені спроби зменшити його вплив на навколишнє середовище, зробивши його «розчинним» (у вільному розумінні цього терміна) і тим самим дозволивши його розбавити до, сподіваюся, менш шкідливих рівнів величезним обсягом океанської води. Цей підхід використовував 1,84 мільйона галонів нафтового диспергатора Corexit 9527, більша частина якого була введена під водою в місці витоку, при цьому невеликі кількості були розпорошені поверх розливу. Corexit 9527 містить 2-бутоксиетанол (C 6 H 14 O 2), амфіфільну молекулу, полярні та неполярні кінці якої корисні для емульгування олії в дрібні краплі, збільшуючи площу поверхні олії та роблячи її більш доступною для морських бактерій для травлення (рис. \(\PageIndex{6}\)). Хоча такий підхід дозволяє уникнути багатьох безпосередніх небезпек, які нафта представляє для морських та прибережних екосистем, він вводить можливість довгострокових наслідків, що виникають внаслідок впровадження складних та потенційних токсичних компонентів нафти в харчовий ланцюг океану. Ряд організацій беруть участь у моніторингу розширеного впливу цього розливу нафти, включаючи Національне управління океанічних та атмосферних впливів.

Електричні властивості колоїдних частинок
Дисперсні колоїдні частинки часто електрично заряджені. Колоїдна частка гідроксиду заліза (III), наприклад, не містить достатньої кількості гідроксидних іонів, щоб точно компенсувати позитивні заряди на іони заліза (III). Таким чином, кожна окрема колоїдна частинка несе позитивний заряд, а колоїдна дисперсія складається з заряджених колоїдних частинок і деяких вільних гідроксидних іонів, які зберігають дисперсію електрично нейтральною. Більшість колоїдів гідроксиду металів мають позитивні заряди, тоді як більшість металів і сульфідів металів утворюють негативно заряджені дисперсії. Всі колоїдні частинки в якій-небудь одній системі мають заряди одного знака. Це допомагає тримати їх дисперсними, оскільки частинки, що містять подібні заряди, відштовхуються один від одного.
Ми можемо скористатися зарядом на колоїдні частинки, щоб видалити їх з різних сумішей. Якщо ми помістимо колоїдну дисперсію в ємність із зарядженими електродами, позитивно заряджені частинки, такі як частинки гідроксиду заліза (III), перейдуть до негативного електрода. Там колоїдні частинки втрачають заряд і коагулюються у вигляді осаду.
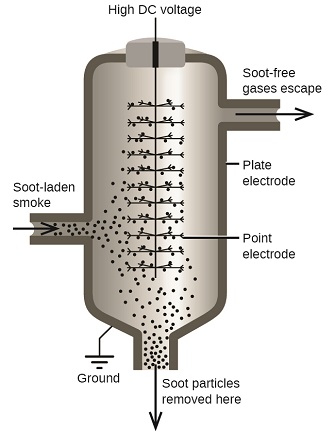
Частинки вуглецю та пилу в димі часто колоїдно дисперсні та електрично заряджені. Заряджені частинки притягуються до сильно заряджених електродів, де вони нейтралізуються і осідають у вигляді пилу (рис\(\PageIndex{7}\). Це один з важливих методів, що застосовуються для очищення диму від безлічі промислових процесів. Процес також важливий у відновленні цінних продуктів з диму і димового пилу плавильних заводів, печей, печей. Існують також іонні повітряні фільтри, призначені для домашнього використання для поліпшення якості повітря в приміщенні.
Гелі
Коли ми робимо желатин, такий як Jell-O, ми робимо тип колоїду (рис.\(\PageIndex{8}\)). Желатин встановлюється на охолодження, оскільки гаряча водна суміш желатину згортається, коли він охолоджується, і вся маса, включаючи рідину, потрапляє в надзвичайно в'язке тіло, відоме як гель, колоїд, в якому диспергуючим середовищем є твердим, а дисперсна фаза - рідина. Виявляється, що волокна диспергирующей середовища утворюють складну тривимірну мережу, проміжки заповнюються рідким середовищем або розведеним розчином диспергуючої середовища. Оскільки утворення гелю супроводжується захопленням води або будь-якого іншого розчинника, гель, як кажуть, гідратований або розчинений.

Пектин, вуглевод з фруктових соків, є студнеобразующей речовиною, важливою при виготовленні желе. Силікагель, колоїдна дисперсія гідратованого діоксиду кремнію, утворюється при додаванні розведеної соляної кислоти в розведений розчин силікату натрію. Консервоване тепло - це гель, виготовлений шляхом змішування спирту і насиченого водного розчину ацетату кальцію.
Резюме
Колоїди - це суміші, в яких одна або кілька речовин диспергуються у вигляді відносно великих твердих частинок або крапель рідини по всьому твердому, рідкому або газоподібному середовищу. Частинки колоїду залишаються дисперсними і не осідають через гравітацію, і вони часто електрично заряджені. Колоїди широко поширені в природі і беруть участь у багатьох технологічних застосуваннях.
Глосарій
- амфіфільний
- молекули, що володіють як гідрофобною (неполярної), так і гідрофільної (полярної) частинами
- колоїд
- (також колоїдна дисперсія) суміш, в якій відносно великі тверді або рідкі частинки диспергуються рівномірно по всьому газу, рідини або твердої речовини
- дисперсійне середовище
- тверде, рідке або газ, в якому диспергуються колоїдні частинки
- дисперсна фаза
- речовина, присутня у вигляді відносно великих твердих або рідких частинок в колоїді
- емульгуючий агент
- амфіфільна речовина, що використовується для стабілізації частинок деяких емульсій
- емульсія
- колоїд, що утворюється з незмішуваних рідин
- гель
- колоїдна дисперсія рідини в твердому
- Ефект Тиндалла
- розсіювання видимого світла колоїдною дисперсією
