11.3: Розчинність
- Page ID
- 22522
- Опишіть вплив температури і тиску на розчинність
- Створіть закон Генрі і використовуйте його в розрахунках, пов'язаних з розчинністю газу в рідині
- Поясніть ступені розчинності, можливі для рідинно-рідких розчинів
Уявіть, як додати невелику кількість солі в склянку води, помішуючи, поки вся сіль не розчиниться, а потім додаючи ще трохи. Ви можете повторювати цей процес до тих пір, поки концентрація солі розчину не досягне своєї природної межі, межі, визначеної в першу чергу відносними сильними сторонами розчин-розчинник, розчин-розчинник і розчинник-розчинник привабливих сил, розглянутих в попередніх двох модулів цієї глави. Ви можете бути впевнені, що досягли цієї межі, оскільки, як би довго ви не помішували розчин, залишається нерозчинена сіль. Концентрація солі в розчині в цей момент відома як її розчинність.
Розчинність розчиненої речовини в конкретному розчиннику - це максимальна концентрація, яка може бути досягнута в заданих умовах, коли процес розчинення знаходиться в рівновазі. Посилаючись на приклад солі у воді:
\[\ce{NaCl}(s)⇌\ce{Na+}(aq)+\ce{Cl-}(aq) \label{11.4.1} \]
Коли концентрація розчиненої речовини дорівнює його розчинності, розчин, як кажуть, насичений цією розчиненою речовиною. Якщо концентрація розчиненого речовини менше його розчинності, то розчин вважається ненасиченим. Розчин, який містить відносно низьку концентрацію розчиненої речовини, називається розбавленим, а той, що має відносно високу концентрацію, називається концентрованим.
Якщо ми додамо більше солі в насичений розчин солі, ми бачимо, як вона падає на дно і більше ніби не розчиняється. Насправді додана сіль дійсно розчиняється, як представлено прямим напрямком рівняння розчинення. Супроводжуючи цей процес, розчинена сіль випаде в осад, як зображено зворотним напрямком рівняння. Кажуть, що система знаходиться в рівновазі, коли ці два зворотні процеси відбуваються з однаковою швидкістю, і тому кількість нерозчиненої і розчиненої солі залишається постійною. Підтримка одночасного виникнення процесів розчинення і осадження забезпечується тим, що кількість і розміри нерозчинених кристалів солей з часом будуть змінюватися, хоча їх об'єднана маса залишиться колишньою.
Можуть готуватися розчини, в яких концентрація розчиненої речовини перевищує його розчинність. Такі рішення, як кажуть, перенасичені, і вони є цікавими прикладами нерівноважних станів. Наприклад, газований напій у відкритому посуді, ще не «зійшов», перенасичений газом вуглекислого газу; з огляду на час, концентрація CO 2 буде зменшуватися, поки не досягне рівноважного значення.
Розчини газів у рідинях
У попередньому модулі цієї глави обговорювалося вплив міжмолекулярних сил притягання на утворення розчинів. Хімічні структури розчиненого речовини і розчинника диктують типи можливих сил і, отже, є важливими факторами при визначенні розчинності. Наприклад, при подібних умовах розчинність кисню у воді приблизно в три рази більше, ніж у гелію, але в 100 разів менше розчинності хлорометану, ChCl 3. Розглядаючи роль хімічної структури розчинника, зверніть увагу, що розчинність кисню в рідкому вуглеводневому гексані, С 6 Н 14, приблизно в 20 разів більше, ніж у воді.
Інші фактори також впливають на розчинність даної речовини в даному розчиннику. Температура є одним з таких факторів, при цьому розчинність в газі зазвичай знижується з підвищенням температури (рис.\(\PageIndex{1}\)). Це один з основних впливів, що виникають внаслідок теплового забруднення природних водойм.
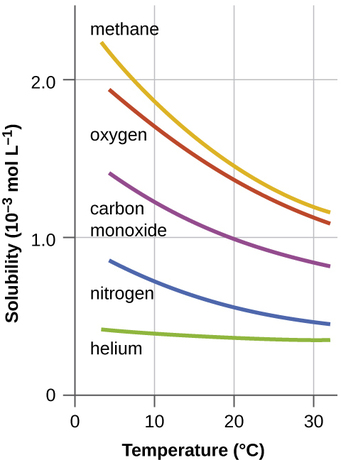
Коли температура річки, озера або потоку підвищується аномально високо, як правило, через скидання гарячої води з якогось промислового процесу, розчинність кисню у воді знижується. Зниження рівня розчиненого кисню може мати серйозні наслідки для здоров'я екосистем води і, у важких випадках, може призвести до масштабних вбивств риб (рис.\(\PageIndex{2}\)).

На розчинність газоподібного розчиненого речовини впливає також парціальний тиск розчиненої речовини в газі, якому піддається розчин. Розчинність в газі збільшується в міру збільшення тиску газу. Газовані напої дають приємну ілюстрацію цих відносин. Процес карбонізації включає в себе вплив напою відносно високому тиску вуглекислого газу, а потім герметизацію контейнера для напою, тим самим насичуючи напій CO 2 при цьому тиску. Коли контейнер для напоїв відкривається, чутно знайоме шипіння, коли виділяється тиск вуглекислого газу, і частина розчиненого вуглекислого газу зазвичай спостерігається, залишаючи розчин у вигляді невеликих бульбашок (рис.\(\PageIndex{3}\)). У цей момент напій перенасичується вуглекислим газом, і з часом концентрація розчиненого вуглекислого газу зменшиться до рівноважного значення, і напій стане «плоским».

Для багатьох газоподібних розчинених речовин співвідношення між розчинністю\(C_g\) та парціальним\(P_g\) тиском є пропорційним:
\[C_\ce{g}=kP_\ce{g} \nonumber \]
де\(k\) - константа пропорційності, яка залежить від ідентичності газоподібного розчиненого речовини і розчинника, і від температури розчину. Це математичне твердження закону Генрі: кількість ідеального газу, який розчиняється в певному обсязі рідини, прямо пропорційно тиску газу.
При 20 °С концентрація розчиненого кисню у воді, що піддається впливу газоподібного кисню, при парціальному тиску 101,3 кПа (760 торр) становить 1,38 × 10 −3 моль L −1. Використовуйте закон Генрі для визначення розчинності кисню, коли його парціальний тиск становить 20,7 кПа (155 торр), приблизний тиск кисню в земній атмосфері.
Рішення
Згідно із законом Генрі, для ідеального розчину розчинність, C g, газу (1,38 × 10 −3 моль L −1, в даному випадку) прямо пропорційна тиску, P g, нерозчиненого газу над розчином (101,3 кПа, або 760 торр, в даному випадку). Тому що ми знаємо як C g і P g, ми можемо переставити цей вираз, щоб вирішити для k.
\ [\ почати {вирівнювати*}
C_\ ce {г} &=kP_\ ce {г}\\ [4pt]
k&=\ dfrac {C_\ ce {г}} {P_\ ce {g}}\\ [4pt]
&=\ mathrm {\ dfrac {1,38×10^ {−3}\ :моль\ :L^ {−1} {101.3\ :кПа}}\\ [4pt]
&=\ математика {1,36 × 10^ {−5}\ :моль\ :L^ {−1}\ :кПа ^ {−1}}\\ [4pt]
&\ hspace {15px}\ математика {(1.82 × 10^ {−6}\ :моль\ :L^ {−1}\ :torr^ {−1})}
\ кінець {align*}\ number\]
Тепер ми можемо використовувати k, щоб знайти розчинність при нижньому тиску.
\[C_\ce{g}=kP_\ce{g} \nonumber \]
\ [\ матрм {1,36×10^ {−5}\ :моль\ :L^ {−1}\ :кПа ^ {−1} ×20,7\ :кПа\\ [4pt]
(або\ :1.82×10^ {−6}\ :моль\ :L^ {−1}\ :торр^ {−1} ×155\ :торр)\\ 4 pt]
=2.82 × 10^ {−4}\ :моль\ :L^ {−1}}\ номер\]
Зверніть увагу, що різні одиниці можуть використовуватися для вираження величин, що беруть участь у таких розрахунках. Будь-яка комбінація одиниць, що піддаються обмеженням розмірного аналізу, є прийнятною.
Експозиція зразка води 100,0 мл при 0° C в атмосферу, що містить газоподібну розчинену речовину при 20,26 кПа (152 торр), призвело до розчинення 1,45 × 10 −3 г розчиненої речовини. Використовуйте закон Генрі для визначення розчинності цього газоподібного розчиненого речовини, коли його тиск становить 101,3 кПа (760 торр).
- Відповідь
-
7,25 × 10 −3 г в 100,0 мл або 0,0725 г/л
Декомпресійна хвороба (DCS), або «вигини», - це ефект підвищеного тиску повітря, що вдихається аквалангістами при плаванні під водою на значних глибині. Крім тиску, що чиниться атмосферою, водолази піддаються додатковому тиску за рахунок води над ними, відчуваючи збільшення приблизно на 1 атм на кожні 10 м глибини. Тому повітря, що вдихається дайвером під час занурення, містить гази при відповідному більш високому тиску навколишнього середовища, а концентрації газів, розчинених у крові дайвера, пропорційно вищі за законом Генрі.
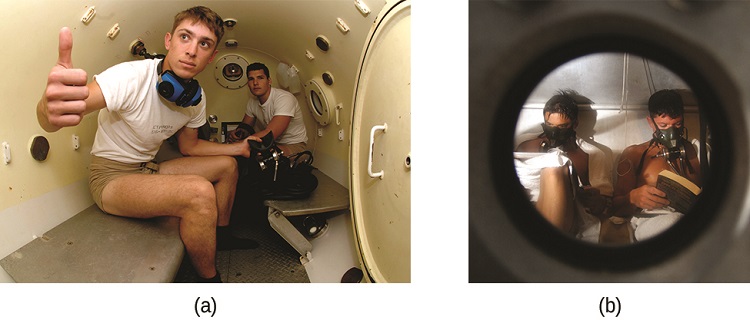
Коли дайвер піднімається на поверхню води, тиск навколишнього середовища зменшується, а розчинені гази стають менш розчинними. Якщо підйом занадто швидкий, гази, що виходять з крові дайвера, можуть утворювати бульбашки, які можуть викликати різні симптоми, починаючи від висипань і болю в суглобах до паралічу і смерті. Щоб уникнути DCS, дайвери повинні підніматися з глибини на відносно повільних швидкостях (10 або 20 м/хв) або іншим чином зробити кілька декомпресійних зупинок, призупиняючись на кілька хвилин на заданих глибині під час підйому. Коли ці профілактичні заходи не увінчаються успіхом, дайверам з ДКС часто надають гіпербаричну кисневу терапію в судини під тиском, звану декомпресійними (або рекомпресійними) камерами (рис.\(\PageIndex{4}\)).
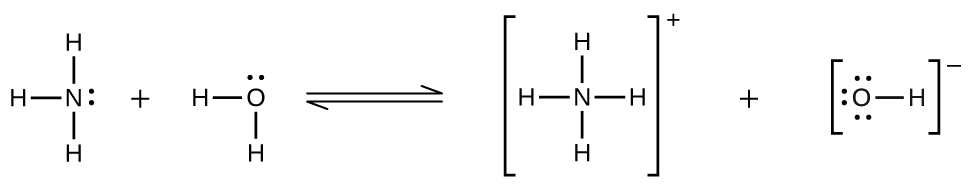
Відхилення від закону Генрі спостерігаються, коли відбувається хімічна реакція між газоподібним розчиненим речовиною і розчинником. Так, наприклад, розчинність аміаку у воді не зростає так швидко зі збільшенням тиску, як передбачено законом, оскільки аміак, будучи основою, певною мірою реагує з водою з утворенням іонів амонію та гідроксидних іонів.
Гази можуть утворювати перенасичені розчини. Якщо розчин газу в рідині готується або при низькій температурі, або під тиском (або обидва), то в міру нагрівання розчину або при зниженні тиску газу розчин може стати перенасиченим. У 1986 році понад 1700 людей у Камеруні загинули, коли хмара газу, майже напевно вуглекислого газу, вирувала з озера Ньос (рис.\(\PageIndex{5}\)), глибокого озера у вулканічному кратері. Вода на дні озера Ньос насичена вуглекислим газом вулканічною активністю під озером. Вважається, що озеро зазнало обороту за рахунок поступового нагрівання знизу озера, а більш тепла, менш щільна вода, насичена вуглекислим газом, досягла поверхні. Отже, були виділені величезні кількості розчиненого СО 2, а безбарвний газ, щільніший за повітря, стікав по долині нижче озера і задушив людей і тварин, що мешкають в долині.

Розчини рідин у рідинях
Ми знаємо, що деякі рідини змішуються між собою у всіх пропорціях; іншими словами, вони мають нескінченну взаємну розчинність і, як кажуть, змішуються. Етанол, сірчана кислота та етиленгліколь (популярні для використання в якості антифризу, зображені на малюнку\(\PageIndex{6}\)) - приклади рідин, які повністю змішуються з водою. Двотактне моторне масло змішується з бензином.

Рідини, які змішуються з водою у всіх пропорціях, зазвичай є полярними речовинами або речовинами, що утворюють водневі зв'язки. Для таких рідин дипольно-дипольні атракціони (або водневі зв'язки) молекул розчинених речовин з молекулами розчинника є принаймні такими ж сильними, як і між молекулами в чистому розчиненому речовині або в чистому розчиннику. Отже, два види молекул легко змішуються. Так само неполярні рідини змішуються між собою, оскільки немає помітної різниці в силах розчинень-розчинник, розчинник-розчинник та розчинник-розчинник міжмолекулярних атракціонів. Розчинність полярних молекул у полярних розчинниках та неполярних молекул у неполярних розчинниках є, знову ж таки, ілюстрацією хімічної аксіоми «як розчиняється, як».
Дві рідини, які не змішуються в помітній мірі, називаються незмішуваними. Шари утворюються, коли ми наливаємо незмішувані рідини в ту ж ємність. Бензин, масло (рис.\(\PageIndex{7}\)), бензол, чотирихлористий вуглець, деякі фарби і багато інших неполярні рідини незмішуються з водою. Тяжіння між молекулами таких неполярних рідин і полярними молекулами води неефективно слабке. Єдині сильні атракціони в такій суміші знаходяться між молекулами води, тому вони ефективно видавлюють молекули неполярної рідини. Різниця між незмішуваністю та змішуваністю насправді є однією з ступенів, так що змішувані рідини мають нескінченну взаємну розчинність, тоді як рідини, які, як кажуть, є незмішуваними, мають дуже низьку (хоча і не нульову) взаємну розчинність.

Кажуть, що дві рідини, такі як бром і вода, які мають помірну взаємну розчинність, частково змішуються. Дві частково змішуються рідини зазвичай утворюють два шари при змішуванні. У випадку з бромно-водною сумішшю верхній шар - вода, насичена бромом, а нижній шар - бром, насичений водою. Оскільки бром неполярний, і, таким чином, не дуже розчинний у воді, водний шар лише злегка знебарвлюється розчиненим в ньому яскраво-помаранчевим бромом. Так як розчинність води в бромі дуже низька, то помітного впливу на темний колір бромного шару немає (рис.\(\PageIndex{8}\)).

Розчини твердих тіл у рідинях
Залежність розчинності від температури для ряду неорганічних твердих речовин у воді показана кривими розчинності на рис\(\PageIndex{9}\). Перегляд цих даних свідчить про загальну тенденцію збільшення розчинності з температурою, хоча є винятки, про що свідчить іонна сполука сульфату церію.
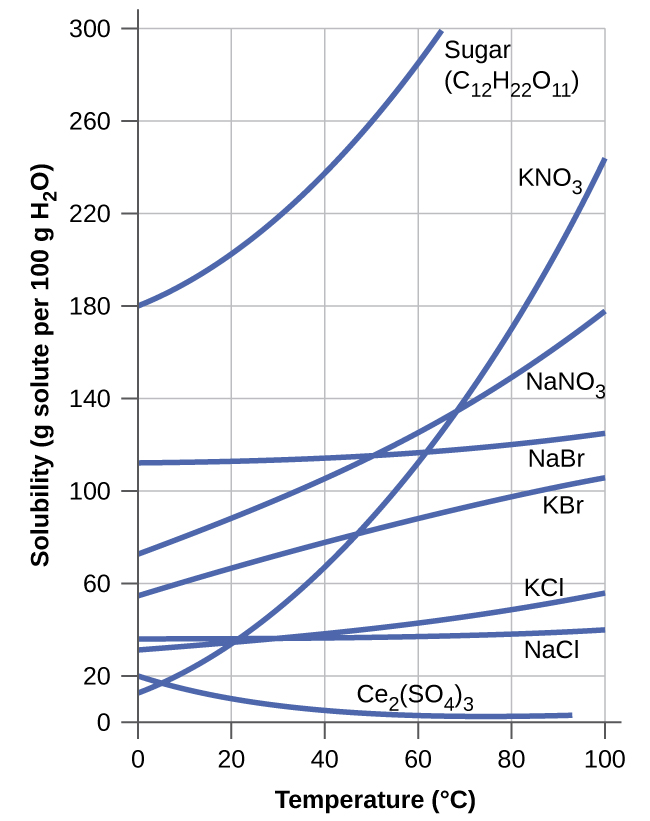
Температурна залежність розчинності може бути використана для приготування перенасичених розчинів певних сполук. Розчин може бути насичений сполукою при підвищеній температурі (де розчинений розчин більш розчинний) і згодом охолоджений до більш низької температури без осадження розчиненої речовини. Отриманий розчин містить розчинену речовину в концентрації, більшій за його рівноважну розчинність при більш низькій температурі (тобто він перенасичений) і є відносно стабільним. Осадження надлишку розчиненої речовини може бути ініційовано додаванням кристала насіння (див. Відео в Посилання на навчання раніше в цьому модулі) або механічним перемішуванням розчину. Деякі грілки для рук, такі як зображені на малюнку\(\PageIndex{10}\), користуються такою поведінкою.

Відео\(\PageIndex{2}\): У цьому відео показаний процес кристалізації, що відбувається в грілці для рук.
Резюме
Ступінь, в якій одна речовина розчиняється в іншій, визначається декількома факторами, включаючи типи та відносні сили міжмолекулярних сил привабливості, які можуть існувати між атомами, іонами або молекулами речовин. Ця тенденція до розчинення кількісно визначається як розчинність речовини, її максимальна концентрація в розчині при рівновазі за заданих умов. Насичений розчин містить розчинену речовину в концентрації, рівній його розчинності. Пересичений розчин - це розчин, в якому концентрація розчиненої речовини перевищує його розчинність - нерівноважний (нестабільний) стан, який призведе до осадження розчиненої речовини, коли розчин відповідним чином збурено. Змішувані рідини розчинні у всіх пропорціях, а незмішувані рідини виявляють дуже низьку взаємну розчинність. Розчинності для газоподібних розчинених речовин зменшуються зі збільшенням температури, тоді як ті, що для більшості, але не для всіх, твердих розчинів збільшуються з температурою. Концентрація газоподібного розчиненого речовини в розчині пропорційна парціальному тиску газу, якому піддається розчин, відношення, відоме як закон Генрі.
Ключові рівняння
- \(C_\ce{g}=kP_\ce{g}\)
Глосарій
- Закон Генрі
- закон, який визначає пропорційну залежність між концентрацією розчиненого газу в розчині і парціальним тиском газу, що контактує з розчином
- незмішаний
- незначної взаємної розчинності; зазвичай відноситься до рідких речовин
- змішаний
- взаємно розчинний у всіх пропорціях; зазвичай відноситься до рідких речовин
- частково змішується
- помірної взаємної розчинності; зазвичай відноситься до рідких речовин
- насичений
- концентрації, що дорівнює розчинності; містить максимальну концентрацію розчиненої речовини, можливу для заданої температури і тиску
- розчинність
- в якій мірі розчинена речовина може бути розчинена у воді або будь-якому розчиннику
- перенасичений
- концентрації, що перевищує розчинність; нерівноважний стан
- ненасичений
- концентрації менше розчинності
