11.2: Електроліти
- Page ID
- 22516
- Визначте і наведіть приклади електролітів
- Розрізняють фізичні та хімічні зміни, які супроводжують розчинення іонних і ковалентних електролітів
- Пов'язати міцність електроліту з силами привабливості розчинника
Коли деякі речовини розчиняються у воді, вони зазнають фізичної або хімічної зміни, яка дає іони в розчині. Ці речовини складають важливий клас сполук, званих електролітами. Речовини, які не виділяють іонів при розчиненні, називаються неелектролітами. Якщо фізичний або хімічний процес, який генерує іони, по суті, 100% ефективний (все розчинене з'єднання дає іони), то речовина відома як сильний електроліт. Якщо тільки відносно невелика частка розчиненого речовини піддається процесу іонопродукування, його називають слабким електролітом.
Речовини можуть бути ідентифіковані як сильні, слабкі або неелектроліти шляхом вимірювання електричної провідності водного розчину, що містить речовину. Для проведення електрики речовина повинна містити вільно рухливі, заряджені види. Найбільш звичним є проведення електрики через металеві дроти, в цьому випадку рухомими, зарядженими утвореннями є електрони. Розчини також можуть проводити електрику, якщо вони містять розчинені іони, при цьому провідність збільшується зі збільшенням концентрації іонів. Подача напруги на електроди, занурені в розчин, дозволяє оцінити відносну концентрацію розчинених іонів або кількісно, шляхом вимірювання витрати електричного струму, або якісно, спостерігаючи яскравість лампочки, включеної в ланцюг (рис.\(\PageIndex{1}\)).
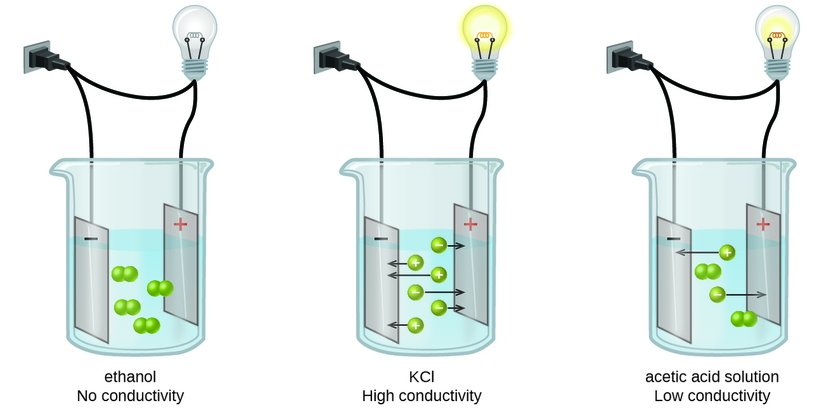
Іонні електроліти
Вода та інші полярні молекули притягуються до іонів, як показано на малюнку\(\PageIndex{2}\). Електростатичне тяжіння між іоном і молекулою з диполем називається іонно-дипольним притяганням. Ці атракціони відіграють важливу роль в розчиненні іонних сполук у воді.
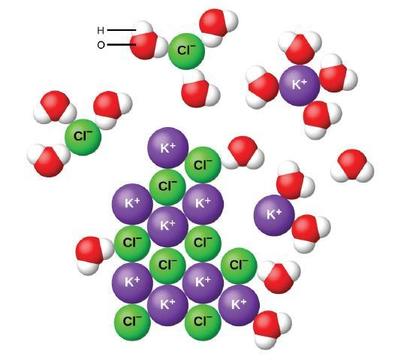
Коли іонні сполуки розчиняються у воді, іони в твердому тілі відокремлюються і рівномірно диспергуються по всьому розчину, оскільки молекули води оточують і сольватують іони, зменшуючи сильні електростатичні сили між ними. Цей процес являє собою фізичну зміну, відому як дисоціація. У більшості умов іонні сполуки будуть дисоціювати майже повністю при розчиненні, і тому вони класифікуються як сильні електроліти.
Розглянемо, що відбувається на мікроскопічному рівні, коли ми додаємо твердий KCl у воду. Іонно-дипольні сили притягують позитивний (водневий) кінець полярних молекул води до негативних іонів хлориду на поверхні твердого тіла, і вони притягують негативні (кисневі) кінці до позитивних іонів калію. Молекули води проникають між окремими іонами K + і Cl − і оточують їх, зменшуючи сильні внутрішньоіонні сили, які зв'язують іони разом, і дозволяючи їм рухатися в розчин як сольватние іони, як показано на малюнку. Зменшення електростатичного тяжіння дозволяє незалежний рух кожного гідратованого іона в розбавленому розчині, що призводить до збільшення розладу системи, оскільки іони змінюються з фіксованого та впорядкованого положення в кристалі до рухомих і набагато більш невпорядкованих станів у розчині. Це підвищений розлад відповідає за розчинення багатьох іонних сполук, включаючи KCl, які розчиняються при поглинанні тепла.
В інших випадках електростатичні атракціони між іонами в кристалі настільки великі, або іонно-дипольні сили притягання між іонами і молекулами води настільки слабкі, що збільшення розладу не може компенсувати енергію, необхідну для поділу іонів, і кристал нерозчинний. Таке стосується таких сполук, як карбонат кальцію (вапняк), фосфат кальцію (неорганічний компонент кістки) та оксид заліза (іржа).
ковалентні електроліти
Чиста вода є надзвичайно поганим провідником електроенергії, оскільки вона лише дуже слабо іонізована - лише близько двох з кожних 1 мільярда молекул іонізуються при 25° C. вода іонізується, коли одна молекула води віддає протон іншій молекулі води, утворюючи іони гідронію та гідроксиду.
\[\ce{H_2O (l)+ H_2O (l) \rightleftharpoons H_3O^{+} (aq) + OH^{−} (aq)} \label{11.3.2} \]
У деяких випадках ми виявляємо, що розчини, отримані з ковалентних сполук, проводять електрику, оскільки молекули розчинених речовин хімічно реагують з розчинником, утворюючи іони. Наприклад, чистий хлористий водень - це газ, що складається з ковалентних молекул HCl. Цей газ не містить іонів. Однак, коли ми розчиняємо хлористий водень у воді, ми виявляємо, що розчин є дуже хорошим провідником. Молекули води відіграють важливу роль у утворенні іонів: Розчини хлористого водню в багатьох інших розчинниках, таких як бензол, не проводять електрику і не містять іонів.
Хлористий водень є кислотою, і тому її молекули вступають в реакцію з водою, переносячи іони Н + з утворенням іонів гідронію (\(H_3O^+\)) і хлоридних іонів (Cl −):
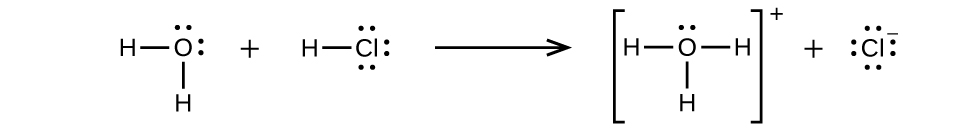
Ця реакція по суті 100% повна для HCl (тобто це сильна кислота і, отже, сильний електроліт). Так само слабкі кислоти та основи, які реагують лише частково, утворюють відносно низькі концентрації іонів при розчиненні у воді і класифікуються як слабкі електроліти. Читач, можливо, побажає переглянути обговорення сильних і слабких кислот, наведених у попередньому розділі цього тексту про класи реакцій та стехіометрії.
Резюме
Речовини, які розчиняються у воді з утворенням іонів, називаються електролітами. Електроліти можуть бути ковалентними сполуками, які хімічно реагують з водою з утворенням іонів (наприклад, кислот і основ), або вони можуть бути іонними сполуками, які дисоціюють з утворенням їх складових катіонів і аніонів при розчиненні. Розчиненню іонної сполуки сприяють іонно-дипольні атракціони між іонами сполуки і полярними молекулами води. Розчинні іонні речовини і сильні кислоти повністю іонізуються і є сильними електролітами, тоді як слабкі кислоти і підстави іонізуються лише в невеликій мірі і є слабкими електролітами. Неелектроліти - це речовини, які не виробляють іонів при розчиненні у воді.
Глосарій
- дисоціація
- фізичний процес, що супроводжує розчинення іонної сполуки, в якій складові іони сполуки розчиняються і диспергуються по всьому розчину
- електроліту
- речовина, що виробляє іони при розчиненні у воді
- іонно-дипольний атракціон
- електростатичне тяжіння між іоном і полярною молекулою
- неелектролітний
- речовина, що не виробляє іони при розчиненні у воді
- сильний електроліт
- речовина, яка дисоціює або повністю іонізується при розчиненні у воді
- слабкий електроліт
- речовина, яка іонізується лише частково при розчиненні у воді
