11.1: Процес розчинення
- Page ID
- 22528
- Опишіть основні властивості розчинів і те, як вони утворюються.
- Передбачте, чи отримає дана суміш розчин на основі молекулярних властивостей її компонентів.
- Поясніть, чому деякі розчини або виробляють або поглинають тепло, коли вони утворюються.
Більш ранній главі цього тексту були введені розчини, визначені як однорідні суміші двох і більше речовин. Нерідко один компонент розчину присутній в значно більшій концентрації, в такому випадку його називають розчинником. Інші компоненти розчину, присутні у відносно менших концентраціях, називаються розчиненими речовинами. Цукор - це ковалентне тверде речовина, що складається з молекул сахарози,\(\ce{C12H22O11}\). Коли це з'єднання розчиняється у воді, його молекули стають рівномірно розподіленими між молекулами води:
\[\ce{C12H22O11 (s) ⟶ C12H22O11 (aq) } \label{Eq1} \]
Нижній індекс «aq» у рівнянні означає, що молекули сахарози є розчиненими речовинами і тому індивідуально диспергуються по всьому водному розчину (вода є розчинником). Хоча молекули сахарози важчі за молекули води, вони залишаються диспергованими по всьому розчину; гравітація не змушує їх «осідати» з часом.
Біхромат калію - це іонна сполука\(\ce{K_2Cr_2O_7}\), що складається з безбарвних іонів калію та помаранчевих іонів дихромату\(\ce{Cr_2O_7^{2−}}\).\(\mathrm{K^+}\) При додаванні невеликої кількості твердого біхромата калію в воду з'єднання розчиняється і дисоціюється з отриманням іонів калію і іонів дихромату, рівномірно розподілених по всій суміші (рис.\(\PageIndex{1}\)), як зазначено в цьому рівнянні:
\[\ce{K2Cr2O7(s) ⟶ 2K^{+} (aq) + Cr2O7^{2-} (aq)} \label{Eq2} \]
Як і у випадку з сумішшю цукру і води, ця суміш також є водним розчином. Його розчинні речовини, іони калію та дихромату, залишаються індивідуально диспергованими серед молекул розчинника (води).

Вода використовується так часто як розчинник, що слово рішення прийшло на увазі водний розчин для багатьох людей. Однак в якості розчинника може виступати практично будь-який газ, рідина або тверда речовина. Багато сплавів є твердими розчинами одного металу, розчиненого в іншому; наприклад, п'ятицентові монети США містять нікель, розчинений в міді. Повітря являє собою газоподібний розчин, однорідну суміш азоту, кисню і декількох інших газів. Кисень (газ), спирт (рідина) та цукор (тверда речовина) розчиняються у воді (рідині), утворюючи рідкі розчини. У таблиці\(\PageIndex{1}\) наведені приклади декількох різних розчинів і фаз розчинників і розчинників.
| Рішення | Розчинений | Розчинник |
|---|---|---|
| повітря | О 2 (г) | N 2 (г) |
| безалкогольні напої | СО 2 (г) | Н 2 О (л) |
| водень в паладію | Н 2 (г) | Пд (и) |
| протирання спиртом | Н 2 О (л) | С 3 Н 8 О (л) (2-пропанол) |
| солона вода | NaCl (и) | Н 2 О (л) |
| латунь | Zn (и) | Cu (и) |
Рішення демонструють такі визначальні риси:
- Вони однорідні; тобто після замішування розчину він має однаковий склад у всіх точках по всьому (його склад однорідний).
- Фізичний стан розчину - твердого, рідкого або газового - зазвичай такий же, як і у розчинника, як показано прикладами в табл\(\PageIndex{1}\).
- Компоненти розчину диспергуються в молекулярному масштабі, тобто складаються з суміші відокремлених молекул, атомів і/або іонів.
- Розчинений в розчині розчинений розчин не буде осідати або відокремлюватися від розчинника.
- Склад розчину, або концентрації його компонентів, можуть змінюватися безперервно, в межах.
Формування рішень
Освіта розчину - приклад спонтанного процесу, процесу, що відбувається в заданих умовах без потреби енергії з якогось зовнішнього джерела. Іноді ми помішуємо суміш, щоб прискорити процес розчинення, але це не обов'язково; однорідний розчин утворився б, якщо ми чекаємо досить довго. Тема спонтанності є критично важливою для вивчення хімічної термодинаміки і більш детально розглядається в наступному розділі цього тексту. Для цілей обговорення цієї глави досить буде розглянути два критерії, які сприяють, але не гарантують спонтанного формування рішення:
- зниження внутрішньої енергії системи (екзотермічна зміна, про що йшлося в попередньому розділі, присвяченому термохімії)
- збільшення розладу в системі (що свідчить про збільшення ентропії системи, про що ви дізнаєтеся в наступному розділі, присвяченому термодинаміці)
У процесі розчинення внутрішня зміна енергії часто, але не завжди, відбувається в міру поглинання або виділення тепла. Збільшення розладу завжди призводить, коли утворюється розчин.
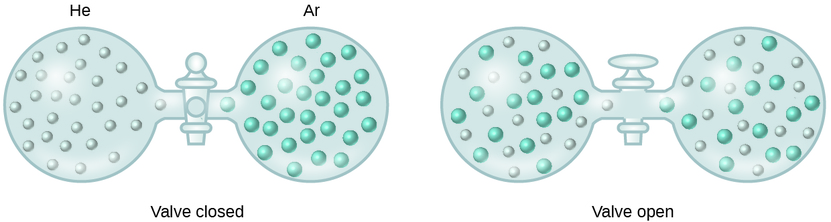
Коли сили міжмолекулярних сил тяжіння між розчиненими і розчинними видами в розчині нічим не відрізняються від тих, що присутні в розділених компонентах, розчин утворюється без супутніх змін енергії. Таке рішення називають ідеальним рішенням. Суміш ідеальних газів (або газів, таких як гелій і аргон, які тісно наближаються до ідеальної поведінки) є прикладом ідеального рішення, оскільки суб'єкти, що містять ці гази, не відчувають значних міжмолекулярних атракціонів.
При з'єднанні ємностей гелію і аргону гази мимовільно перемішуються за рахунок дифузії і утворюють розчин (рис.\(\PageIndex{2}\)). Освіта цього розчину явно передбачає збільшення розладу, так як атоми гелію і аргону займають обсяг в два рази більше, ніж той, який кожен займав перед змішуванням.
Ідеальні розчини можуть утворюватися і при змішуванні структурно схожих рідин. Наприклад, суміші спиртів метанолу (СН 3 ОН) і етанолу (С 2 Н 5 ОН) утворюють ідеальні розчини, як і суміші вуглеводнів пентану\(\ce{C5H12}\), і гексану,\(\ce{C6H14}\). Розміщення метанолу та етанолу, або пентану та гексану в цибулини, показані на малюнку,\(\PageIndex{2}\) призведе до тієї ж дифузії та подальшого змішування цих рідин, що спостерігається для газів He і Ar (хоча і з набагато повільнішою швидкістю), отримуючи розчини без суттєвої зміни енергії. На відміну від суміші газів, однак, компоненти цих рідинно-рідких розчинів дійсно відчувають міжмолекулярні сили привабливості. Але оскільки молекули двох змішуваних речовин структурно дуже схожі, міжмолекулярні сили притягання між подібними і несхожими молекулами по суті однакові, а процес розчинення, отже, не тягне за собою ніякого помітного збільшення або зменшення енергії. Ці приклади ілюструють, як сама дифузія може забезпечити рушійну силу, необхідну для спричинення спонтанного утворення розчину. Однак у деяких випадках відносні величини міжмолекулярних сил тяжіння між розчиненими та розчинними видами можуть запобігти розчиненню.
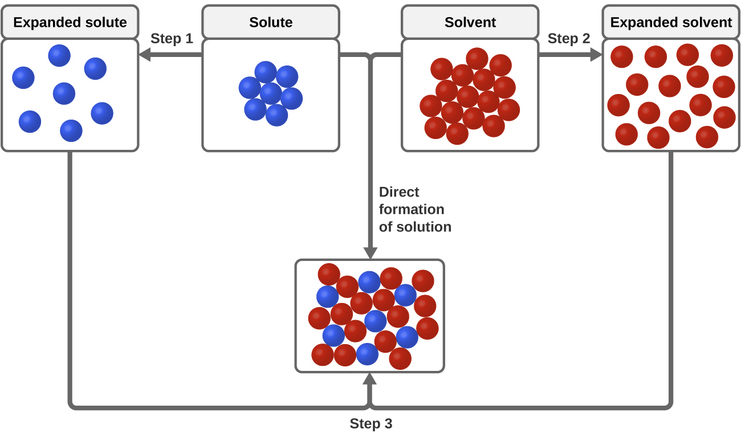
Три типи міжмолекулярних сил привабливості мають відношення до процесу розчинення: розчин-розчинник, розчинник-розчинник та розчинник-розчинник. Як показано на малюнку\(\PageIndex{3}\), формування розчину можна розглядати як ступінчастий процес, при якому енергія витрачається на подолання атракціонів розчинен-розчиненого речовини та розчинник-розчинник (ендотермічні процеси) і виділяється при встановленні атракціонів розчин-розчинник (екзотермічний процес, який називається сольватування). Відносні величини енергетичних змін, пов'язаних з цими ступеневими процесами, визначають, чи буде процес розчинення загалом вивільняти або поглинати енергію. У деяких випадках розчини не утворюються, оскільки енергія, необхідна для поділу розчинених речовин і розчинників видів, набагато більша, ніж енергія, що виділяється сольвацією.

Наприклад, кулінарні масла і вода не будуть змішуватися в будь-якій помітній мірі для виходу розчинів (рис.\(\PageIndex{4}\)). Водневий зв'язок - домінуюча міжмолекулярна сила привабливості, присутня в рідкій воді; неполярні вуглеводневі молекули кулінарних масел не здатні зв'язуватися воднем, замість цього утримуючись силами дисперсії. Формування масляно-водного розчину вимагало б подолання дуже сильного водневого зв'язку у воді, а також значно сильних сил дисперсії між відносно великими молекулами нафти. І, оскільки полярні молекули води та неполярні молекули олії не відчували б дуже сильного міжмолекулярного тяжіння, дуже мало енергії буде виділятися сольвацією.
З іншого боку, суміш етанолу і води буде змішуватися в будь-яких пропорціях, щоб вийшов розчин. При цьому обидві речовини здатні до водневого зв'язку, і тому процес сольватії досить екзотермічний для компенсації ендотермічного поділу молекул розчиненого речовини і розчинника.

Як зазначалося на початку цього модуля, спонтанне утворення розчинів сприяє, але не гарантується, екзотермічними процесами розчинення. Хоча багато розчинні сполуки дійсно розчиняються з виділенням тепла, деякі розчиняються ендотермічно. Аміачна селітра (NH 4 NO 3) є одним з таких прикладів і використовується для виготовлення миттєвих холодних упаковок для лікування травм, як на малюнку\(\PageIndex{5}\). Тонкостінний поліетиленовий пакет з водою запечатується всередині більшого мішка з твердим NH 4 NO 3. Коли менший мішок розбивається, утворюється розчин NH 4 NO 3, поглинаючи тепло з навколишнього середовища (травмована область, до якої прикладається упаковка) і забезпечує холодний компрес, який зменшує набряк. Ендотермічні розпускання, такі як цей, вимагають більшого споживання енергії для відділення розчинених видів, ніж відновлюються, коли розчинені речовини розчинені, але вони спонтанні, тим не менш, через збільшення розладу, яке супроводжує утворення розчину.
Відео\(\PageIndex{1}\): Перегляньте це коротке відео, що ілюструє процеси ендотермічного та екзотермічного розчинення.
Резюме
Розчин утворюється, коли два або більше речовин об'єднуються фізично, щоб отримати суміш, яка є однорідною на молекулярному рівні. Розчинник є найбільш концентрованим компонентом і визначає фізичний стан розчину. Розчинені речовини - це інші компоненти, які зазвичай присутні в концентраціях менше, ніж у розчинника. Розчини можуть утворюватися ендотермічно або екзотермічно, залежно від відносних величин міжмолекулярних сил привабливості розчиненої речовини та розчинника. Ідеальні рішення формуються без помітних змін енергії.
Виноски
- Якщо всередині рідини спостерігаються бульбашки газу, суміш неоднорідна і, таким чином, не є розчином.
Глосарій
- сплав
- суцільна суміш металевого елемента і одного або декількох добірних елементів
- ідеальне рішення
- рішення, яке утворюється без супутніх змін енергії
- сольватування
- екзотермічний процес, в якому встановлюються міжмолекулярні сили притягання між розчиненою речовиною та розчинником у розчині
- спонтанний процес
- фізичне або хімічне зміна, що відбувається без додавання енергії із зовнішнього джерела
