10.4: Фазові діаграми
- Page ID
- 22476
- Поясніть побудову та використання типової фазової діаграми
- Використовуйте фазові діаграми для виявлення стабільних фаз при заданих температурах і тисках, а також для опису фазових переходів, що виникають внаслідок зміни цих властивостей
- Опишіть надкритичну рідку фазу речовини
У попередньому модулі було описано зміну рівноважного тиску пари рідини з температурою. Розглядаючи визначення точки кипіння, ділянки тиску пари проти температури представляють, як температура кипіння рідини змінюється залежно від тиску. Також було описано використання кривих нагрівання та охолодження для визначення температури плавлення (або замерзання) речовини. Здійснення таких вимірювань у широкому діапазоні тисків дає дані, які можуть бути представлені графічно у вигляді діаграми стану. Фазова діаграма поєднує графіки тиску та температури для рівноваг рідина-газ, тверда та рідина та фазово-перехідний твердий газ речовини. Ці діаграми вказують на фізичні стани, які існують при конкретних умовах тиску і температури, а також забезпечують залежність від тиску температур фазового переходу (температури плавлення, точки сублімації, температури кипіння). Типова діаграма стану для чистої речовини показана на малюнку\(\PageIndex{1}\).
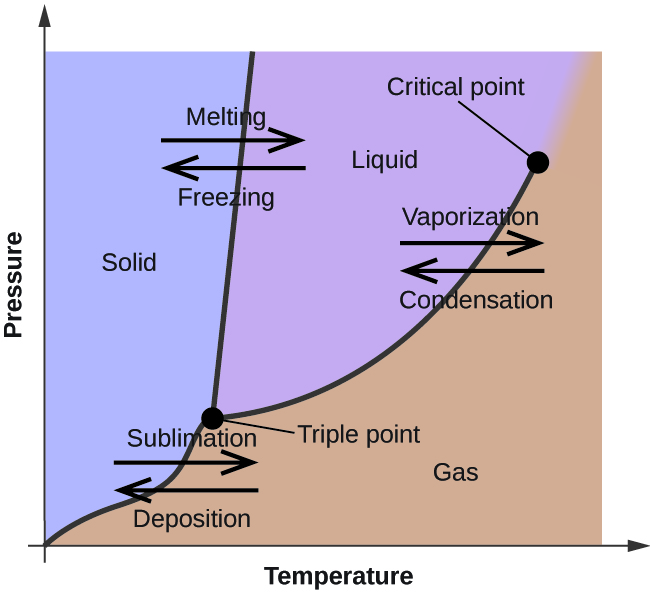
Щоб проілюструвати корисність цих ділянок, розглянемо діаграму стану для води, наведену на малюнку\(\PageIndex{2}\).

Ми можемо використовувати фазову діаграму для ідентифікації фізичного стану проби води при заданих умовах тиску і температури. Наприклад, тиск 50 кПа і температура −10 °C відповідають області діаграми з написом «лід». У цих умовах вода існує тільки як тверда речовина (лід). Тиск 50 кПа і температура 50° C відповідають «водному» регіону - тут вода існує тільки як рідина. При 25 кПа і 200 °С вода існує тільки в газоподібному стані. Зверніть увагу, що на фазовій діаграмі H 2 O осі тиску і температури не намальовані до постійної шкали, щоб дозволити ілюструвати кілька важливих особливостей, як описано тут.
Крива BC на малюнку\(\PageIndex{2}\) - це графік тиску пари проти температури, як описано в попередньому модулі цієї глави. Ця крива «рідина-пара» розділяє рідку і газоподібну області фазової діаграми і забезпечує температуру кипіння води при будь-якому тиску. Наприклад, при 1 атм температура кипіння становить 100° C. зверніть увагу, що крива рідина-пара закінчується при температурі 374° C і тиску 218 атм, що свідчить про те, що вода не може існувати як рідина вище цієї температури, незалежно від тиску. Фізичні властивості води в цих умовах є проміжними між властивостями її рідкої та газоподібної фаз. Це унікальний стан речовини називається надкритичної рідиною, тема, яка буде описана в наступному розділі цього модуля.
Крива твердої пари, позначена AB на малюнку\(\PageIndex{2}\), вказує на температури і тиск, при яких лід і водяна пара знаходяться в рівновазі. Ці пари даних температура-тиск відповідають точкам сублімації, або осадження, для води. Якби ми могли збільшити масштаб лінії твердого газу на малюнку\(\PageIndex{2}\), ми побачили б, що тиск пари лід становить близько 0,20 кПа при −10 °С, отже, якщо ми помістимо заморожений зразок у вакуум з тиском менше 0,20 кПа, лід буде піднесено. Це основа для процесу «сублімації», часто використовуваного для консервування продуктів, таких як морозиво, показане на малюнку\(\PageIndex{3}\).

Крива тверда рідина з маркуванням BD показує температури і тиск, при яких лід і рідка вода знаходяться в рівновазі, представляючи точки плавлення/замерзання води. Зверніть увагу, що ця крива демонструє невеликий негативний нахил (сильно перебільшений для наочності), що вказує на те, що температура плавлення для води трохи зменшується в міру збільшення тиску. Вода є незвичайним речовиною в цьому плані, так як більшість речовин проявляють підвищення температури плавлення при збільшенні тиску. Така поведінка частково відповідає за рух льодовиків, як показано на малюнку\(\PageIndex{4}\). Дно льодовика відчуває величезний тиск через свою вагу, яка може розтопити частину льоду, утворюючи шар рідкої води, по якому льодовик може легше ковзати.

Точка перетину всіх трьох кривих позначена B на рис\(\PageIndex{2}\). При тиску і температурі, представлених цією точкою, всі три фази води співіснують в рівновазі. Ця пара даних температура-тиск називається потрійною точкою. При тиску нижче потрійної точки вода не може існувати як рідина, незалежно від температури.
Використовуючи діаграму стану для води, наведену на малюнку 10.4.2, визначають стан води при наступних температурах і тисках:
- −10 °C і 50 кПа
- 25° C і 90 кПа
- 50 °C і 40 кПа
- 80° C і 5 кПа
- −10 °C і 0,3 кПа
- 50 °C і 0,3 кПа
Рішення
Використовуючи фазову діаграму для води, ми можемо визначити, що стан води при кожній заданій температурі і тиску такі: (а) тверда речовина; (б) рідина; (в) рідина; (г) газ; (е) тверда речовина; (f) газ.
Які фазові зміни може зазнати вода при зміні температури, якщо тиск утримується на рівні 0,3 кПа? Якщо тиск тримається на рівні 50 кПа?
- Відповідь
-
При 0,3 кПа: s⟶ g при −58 °С, при 50 кПа: s⟶ л при 0 °C, l ⟶ g при 78 °C
Розглянемо діаграму стану для вуглекислого газу, показану на малюнку\(\PageIndex{5}\), як інший приклад. Крива тверда рідина демонструє позитивний нахил, що вказує на те, що температура плавлення CO 2 збільшується з тиском, як це робиться для більшості речовин (вода є помітним винятком, як описано раніше). Зверніть увагу, що потрійна точка значно вище 1 атм, що вказує на те, що вуглекислий газ не може існувати як рідина в умовах навколишнього тиску. Натомість охолодження газоподібного вуглекислого газу при 1 атм призводить до його відкладення в твердий стан. Так само твердий вуглекислий газ не плавиться при тиску 1 атм, а натомість підноситься, утворюючи газоподібний CO 2. Нарешті, зверніть увагу, що критична точка для вуглекислого газу спостерігається при відносно скромній температурі і тиску в порівнянні з водою.
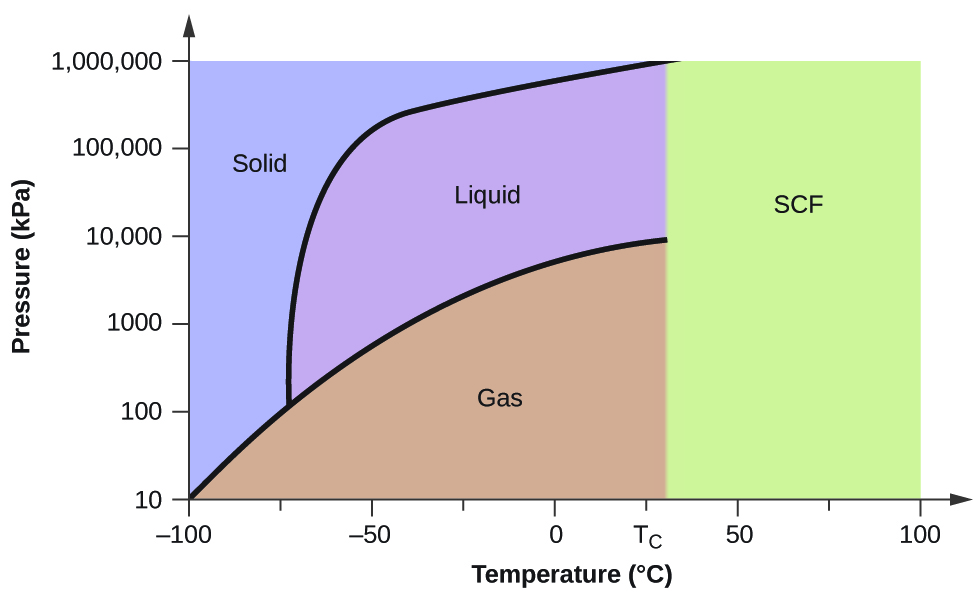
Використовуючи діаграму стану для вуглекислого газу, показану на малюнку 10.4.5, визначають стан СО 2 при наступних температурах і тисках:
- −30 °C і 2000 кПа
- −60 °C і 1000 кПа
- −60 °C і 100 кПа
- 20° C і 1500 кПа
- 0 °C і 100 кПа
- 20° C і 100 кПа
Рішення
Використовуючи фазову діаграму для наданої вуглекислого газу, ми можемо визначити, що стан СО 2 при кожній заданій температурі та тиску є наступним чином: (а) рідина; (б) тверда речовина; (c) газ; (г) рідина; (е) газ; (f) газ.
Визначити фазові зміни вуглекислий газ піддається при зміні його температури, утримуючи таким чином постійним його тиск на рівні 1500 кПа? При 500 кПа? При яких приблизних температурах відбуваються ці фазові зміни?
- Відповідь
-
при 1500 кПа: s⟶ л при −45 °C, l⟶ g при −10 °C; при 500 кПа: s⟶ g при −58 °C
Надкритичні рідини
Якщо ми помістимо пробу води в герметичну ємність при температурі 25° C, видаляємо повітря, і даємо рівновазі випаровування-конденсація встановити себе, ми залишаємо суміш рідкої води і водяної пари під тиском 0,03 атм. Чітко простежується межа між більш щільною рідиною і менш щільним газом. У міру підвищення температури тиск водяної пари зростає, як описано кривою рідина-газ на фазовій діаграмі для води (рис.\(\PageIndex{2}\)), і зберігається двофазна рівновага рідкої і газоподібної фаз. При температурі 374 °С тиск пари підвищився до 218 атм, а будь-яке подальше підвищення температури призводить до зникнення кордону між рідкою і паровою фазами. Вся вода в ємності зараз присутня в одній фазі, фізичні властивості якої є проміжними між властивостями газоподібного та рідкого станів. Ця фаза речовини називається надкритичної рідиною, а температура і тиск, вище яких існує ця фаза, є критичною точкою (рис.\(\PageIndex{5}\)). Вище критичної температури газ не може бути зріджений незалежно від того, скільки тиску застосовується. Тиск, необхідний для зрідження газу при його критичній температурі, називається критичним тиском. Критичні температури і критичні тиску деяких поширених речовин наведені в табл\(\PageIndex{1}\).
| Речовина | Критична температура (K) | Критичний тиск (атм) |
|---|---|---|
| водню | 33.2 | 12.8 |
| азоту | 126.0 | 33.5 |
| кисень | 154.3 | 49,7 |
| вуглекислий газ | 304.2 | 73.0 |
| нашатирний спирт | 405.5 | 111.5 |
| діоксид сірки | 430.3 | 77.7 |
| вода | 647,1 | 217.7 |
Як і газ, надкритична рідина буде розширюватися і заповнювати ємність, але її щільність набагато більша, ніж типові щільності газу, як правило, близькі до тих, що стосуються рідин. Подібно до рідин, ці рідини здатні розчиняти нелеткі розчинні речовини. Вони практично не проявляють поверхневого натягу і дуже низької в'язкості, однак, тому вони можуть більш ефективно проникати в дуже маленькі отвори в твердій суміші і видаляти розчинні компоненти. Ці властивості роблять надкритичні рідини надзвичайно корисними розчинниками для широкого спектру застосувань. Наприклад, надкритичний вуглекислий газ став дуже популярним розчинником у харчовій промисловості, який використовується для безкофеїну кави, видалення жирів з картопляних чіпсів та вилучення смакових і ароматичних сполук з цитрусових масел. Він нетоксичний, відносно недорогий, і не вважається забруднювачем. Після використання СО 2 можна легко відновити, зменшивши тиск і збираючи отриманий газ.
Якщо ми струшуємо вуглекислий вогнегасник у прохолодний день (18° C), ми можемо почути рідкий СО 2, що падає всередині циліндра. Однак той самий балон, схоже, не містить рідини в спекотний літній день (35° C). Поясніть ці спостереження.
Рішення
У прохолодний день температура СО 2 нижче критичної температури СО 2, 304 К або 31° C (табл.\(\PageIndex{1}\)), тому рідкий СО 2 присутній в циліндрі. У спекотний день температура СО 2 більша за критичну температуру 31° С, вище цієї температури жодна кількість тиску не може сріджувати СО 2, тому в вогнегаснику не існує рідкого СО 2.
Аміак можна розріджувати шляхом стиснення при кімнатній температурі; кисень не може бути зріджений в цих умовах. Чому два гази проявляють різну поведінку?
- Відповідь
-
Критична температура аміаку - 405,5 К, що вище кімнатної. Критична температура кисню нижче кімнатної температури; таким чином кисень не може бути зріджений при кімнатній температурі.
Кава без кофеїну з використанням надкритичного CO 2
Кава є другим у світі за широкою торгівлею товаром, слідуючи лише нафти. По всьому світу люди люблять аромат і смак кави. Багато з нас також залежать від одного компонента кави - кофеїну - щоб допомогти нам піти вранці або залишатися напоготові вдень. Але пізно вдень стимулюючий ефект кави може утримати вас від сну, тому ви можете вибрати пити каву без кофеїну ввечері.
З початку 1900-х років для кави без кофеїну було використано багато методів. Всі мають переваги і недоліки, і все залежить від фізичних і хімічних властивостей кофеїну. Оскільки кофеїн є дещо полярною молекулою, він добре розчиняється у воді, полярній рідині. Однак, оскільки багато інших 400-плюс сполук, які сприяють смаку та аромату кави, також розчиняються в Н 2 О, процеси декофеїнації гарячої води також можуть видалити деякі з цих сполук, негативно впливаючи на запах і смак кави без кофеїну. Дихлорметан (CH 2 Cl 2) та етилацетат (CH 3 CO 2 C 2 H 5) мають подібну полярність до кофеїну, і тому є дуже ефективними розчинниками для екстракції кофеїну, але обидва також видаляють деякі смакові та ароматичні компоненти та їх використання вимагає тривалого часу видобутку та очищення. Оскільки обидва ці розчинники токсичні, проблеми зі здоров'ям були підняті щодо ефекту залишкового розчинника, що залишається в каві без кофеїну.
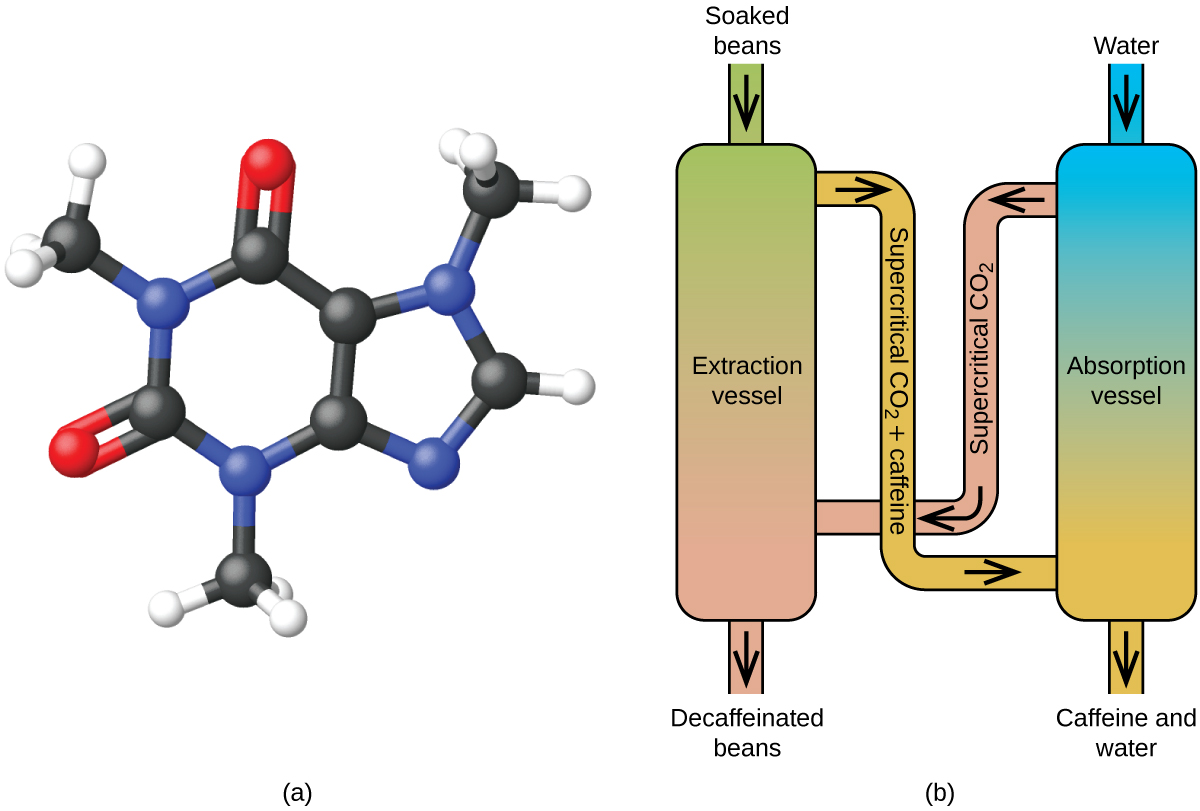
Надкритична екстракція рідини з використанням вуглекислого газу в даний час широко використовується як більш ефективний і екологічно чистий метод декофеїнації (рис.\(\PageIndex{7}\)). При температурах вище 304,2 К і тиску вище 7376 кПа СО 2 є надкритичною рідиною, що володіє властивостями як газу, так і рідини. Подібно газу, він проникає глибоко в кавові зерна; подібно до рідини, ефективно розчиняє певні речовини. Надкритична екстракція вуглекислого газу з парових кавових зерен видаляє 97 − 99% кофеїну, залишаючи незмінними смакові та ароматичні сполуки кави. Оскільки СО 2 є газом в стандартних умовах, його видалення з витягнутих кавових зерен легко здійснюється, як і відновлення кофеїну з екстракту. Кофеїн, отриманий з кавових зерен за допомогою цього процесу, є цінним продуктом, який згодом може бути використаний як добавка до інших продуктів харчування або ліків.
Резюме
Умови температури та тиску, при яких речовина існує у твердому, рідкому та газоподібному станах, узагальнені на фазовій діаграмі для цієї речовини. Фазові діаграми являють собою об'єднані графіки трьох кривих рівноваги тиску і температури: тверда рідина, рідина-газ і твердий газ. Ці криві представляють співвідношення між температурами фазового переходу і тиском. Точка перетину всіх трьох кривих являє собою потрійну точку речовини - температуру і тиск, при яких всі три фази знаходяться в рівновазі. При тисках нижче потрійної точки речовина не може існувати в рідкому стані незалежно від його температури. Кінцева крива рідина-газ представляє критичну точку речовини, тиск і температуру, вище якої рідка фаза не може існувати.
Глосарій
- критична точка
- температура і тиск, вище яких газ не може бути конденсований в рідину
- фазова діаграма
- графік тиску і температури, що підсумовує умови, при яких фази речовини можуть існувати
- надкритична рідина
- речовина при температурі і тиску вище його критичної точки; проявляє проміжні властивості між властивостями газоподібного і рідкого станів
- потрійна точка
- температура і тиск, при яких пара, рідка і тверда фази речовини знаходяться в рівновазі
