10.5: Твердий стан речовини
- Page ID
- 22475
- Визначте та опишіть зв'язок та властивості іонних, молекулярних, металевих та ковалентних кристалічних твердих тіл
- Опишіть основні типи кристалічних твердих речовин: іонні тверді тіла, металеві тверді речовини, тверді речовини ковалентної мережі та молекулярні тверді речовини
- Поясніть, як можуть виникати дефекти кристалів у твердому тілі
Коли більшість рідин охолоджуються, вони в кінцевому підсумку замерзають і утворюють кристалічні тверді речовини, тверді речовини, в яких атоми, іони або молекули розташовані в певному повторюваному малюнку. Також можна, щоб рідина замерзла до того, як її молекули стануть розташовані в упорядкованому порядку. Отримані матеріали називають аморфними твердими частинами або некристалічними твердими речовинами (або, іноді, стеклами). Частинки таких твердих тіл не мають впорядкованої внутрішньої структури і розташовані хаотично (рис.\(\PageIndex{1}\)).
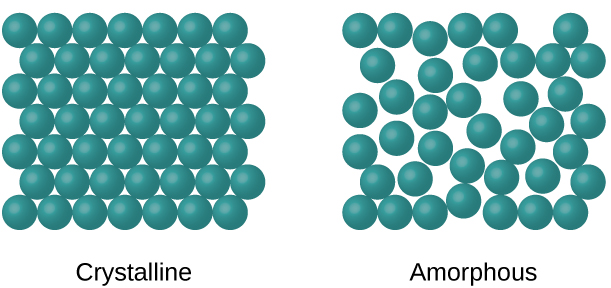
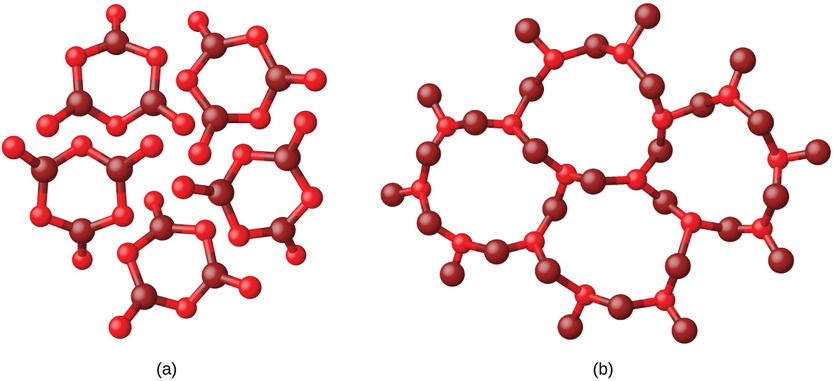
Метали та іонні сполуки зазвичай утворюють впорядковані кристалічні тверді речовини Речовини, що складаються з великих молекул, або суміш молекул, рухи яких більш обмежені, часто утворюють аморфні тверді речовини. Наприклад, свічкові воски - це аморфні тверді речовини, що складаються з великих молекул вуглеводнів. Деякі речовини, такі як оксид бору (рис.\(\PageIndex{2}\)), можуть утворювати або кристалічні, або аморфні тверді речовини, в залежності від умов, в яких він виробляється. Також аморфні тверді речовини можуть піддаватися переходу в кристалічний стан при відповідних умовах.
Кристалічні тверді речовини, як правило, класифікуються за характером сил, які утримують його частинки разом. Ці сили в першу чергу відповідають за фізичні властивості, що виявляються сипучими речовинами. У наступних розділах наведено описи основних типів кристалічних твердих тіл: іонних, металевих, ковалентних мереж та молекулярних.
Іонні тверді речовини
Іонні тверді речовини, такі як хлорид натрію і оксид нікелю, складаються з позитивних і негативних іонів, які утримуються електростатичними атракціонами, які можуть бути досить сильними (рис.\(\PageIndex{3}\)). Багато іонні кристали також мають високі температури плавлення. Це пов'язано з дуже сильними привабливостями між іонами - в іонних сполуках атракціони між повними зарядами (набагато) більші, ніж між частковими зарядами в полярних молекулярних сполуках. Це буде розглянуто більш детально в подальшому обговоренні ґратчастих енергій. Хоча вони тверді, вони також, як правило, крихкі, і вони руйнуються, а не згинаються. Іонні тверді речовини не проводять електрику; однак вони проводять при розплавленні або розчиненні, оскільки їх іони вільно рухаються. Багато прості сполуки, утворені в результаті реакції металевого елемента з неметалічним елементом, є іонними.

Металеві тверді речовини
Металеві тверді речовини, такі як кристали міді, алюмінію та заліза, утворені атомами металу Рисунок\(\PageIndex{4}\). Структура металевих кристалів часто описується як рівномірний розподіл атомних ядер в межах «моря» делокалізованих електронів. Атоми всередині такого металевого твердого тіла утримуються разом унікальною силою, відомою як металевий зв'язок, що породжує багато корисних та різноманітних об'ємних властивостей. Всі вони демонструють високу теплопровідність та електропровідність, металевий блиск та податливість. Багато дуже тверді і досить сильні. Через свою податливості (здатності деформуватися під тиском або забиванням) вони не руйнуються і, отже, роблять корисні будівельні матеріали. Точки плавлення металів сильно різняться. Ртуть є рідиною кімнатної температури, а лужні метали розплавляються нижче 200 °С. Деякі постперехідні метали також мають низькі температури плавлення, тоді як перехідні метали плавляться при температурах вище 1000 °С. Ці відмінності відображають відмінності міцності металевого зв'язку між металами.
Тверді тіла ковалентної мережі
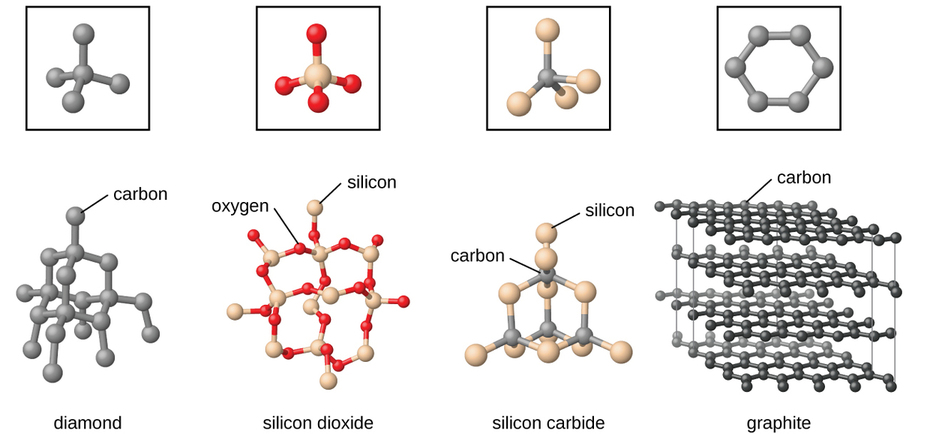
Тверді речовини ковалентної мережі включають кристали алмазу, кремнію, деяких інших неметалів, а також деякі ковалентні сполуки, такі як діоксид кремнію (пісок) і карбід кремнію (карборунд, абразив на наждачному папері). Багато мінералів мають мережі ковалентних зв'язків. Атоми в цих твердих тілах утримуються разом мережею ковалентних зв'язків, як показано на малюнку\(\PageIndex{5}\). Щоб розірвати або розплавити тверде тіло ковалентної мережі, ковалентні зв'язки повинні бути розірвані. Оскільки ковалентні зв'язки відносно міцні, тверді речовини ковалентної мережі зазвичай характеризуються твердістю, міцністю та високими температурами плавлення. Наприклад, алмаз є одним з найтвердіших речовин, відомих і плавиться вище 3500° C.
молекулярні тверді речовини
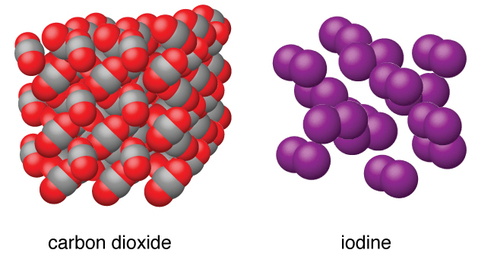
Молекулярні тверді речовини, такі як лід, сахароза (столовий цукор) та йод, як показано на малюнку\(\PageIndex{6}\), складаються з нейтральних молекул. Сильні сторони сил притягання між одиницями, присутніми в різних кристалах, сильно варіюються, на що вказують температури плавлення кристалів. Малі симетричні молекули (неполярні молекули), такі як H 2, N 2, O 2 і F 2, мають слабкі сили притягання і утворюють молекулярні тверді речовини з дуже низькими температурами плавлення (нижче −200° C). Речовини, що складаються з більших неполярних молекул, мають більші сили притягання і плавиться при більш високих температурах. Молекулярні тверді речовини, що складаються з молекул з постійними дипольними моментами (полярними молекулами), розплавляються при ще Приклади включають лід (температура плавлення, 0° C) і столовий цукор (температура плавлення, 185° C).
Властивості твердих тіл
Кристалічне тверде тіло, як і перераховані в таблиці,\(\PageIndex{1}\) має точну температуру плавлення, оскільки кожен атом або молекула одного типу утримується на місці з однаковими силами або енергією. Таким чином, атракціони між одиницями, що складають кристал, мають однакову силу і всі вимагають однакової кількості енергії для розбиття. Поступове розм'якшення аморфного матеріалу різко відрізняється від виразного плавлення кристалічного твердого тіла. Це є результатом структурної нееквівалентності молекул в аморфному твердому тілі. Деякі сили слабкіше інших, і при нагріванні аморфного матеріалу спочатку ламаються найслабші міжмолекулярні атракціони. У міру подальшого підвищення температури сильніші атракціони порушуються. Таким чином аморфні матеріали розм'якшуються в діапазоні температур.
| Тип твердого тіла | Тип частинок | Тип атракціонів | Властивості | Приклади |
|---|---|---|---|---|
| іонний | іони | іонні зв'язки | твердий, крихкий, проводить електрику як рідина, але не як тверда речовина, від високих до дуже високих температур плавлення | NaCl, Ал 2 О 3 |
| металевий | атоми електропозитивних елементів | металеві зв'язки | блискучий, ковкий, пластичний, добре проводить тепло і електрику, змінна твердість і температура плавлення | Cu, Fe, Ti, Pb, U |
| ковалентна мережа | атоми електронегативних елементів | ковалентні зв'язки | дуже жорсткий, не провідний, дуже високі температури плавлення | C (алмаз), SiO 2, SiC |
| молекулярної | молекули (або атоми) | МВФ | змінна твердість, змінна крихкість, не провідна, низькі температури плавлення | Н 2 О, СО 2, Я 2, С 12 Н 22 О 11 |
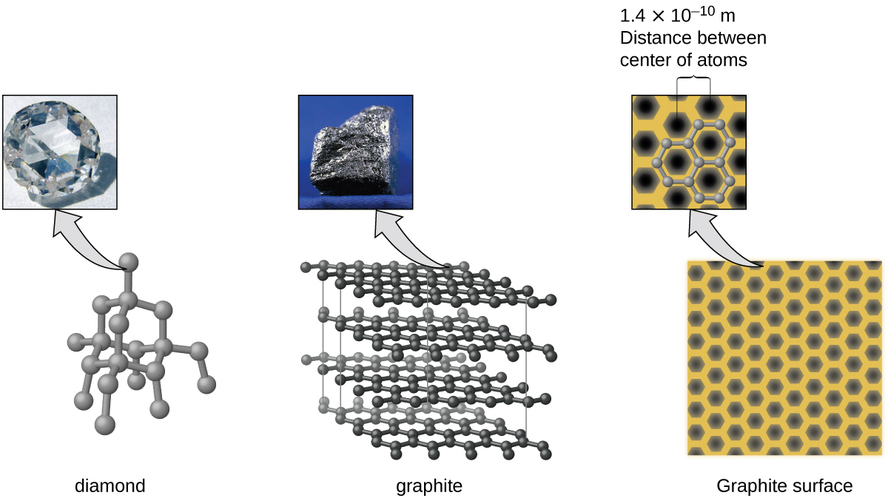
Вуглець є найважливішим елементом у нашому світі. Унікальні властивості атомів вуглецю дозволяють існувати такі форми життя на основі вуглецю, як ми самі. Вуглець утворює величезну кількість різноманітних речовин, які ми використовуємо щодня, в тому числі і наведені на рис\(\PageIndex{7}\). Можливо, ви знайомі з алмазом та графітом, двома найпоширенішими аллотропами вуглецю. (Аллотропи - це різні структурні форми одного і того ж елемента.) Алмаз - одна з найтвердіших речовин, тоді як графіт досить м'який, щоб його можна було використовувати як олівець. Ці дуже різні властивості випливають з різних розташувань атомів вуглецю в різних алотропах.
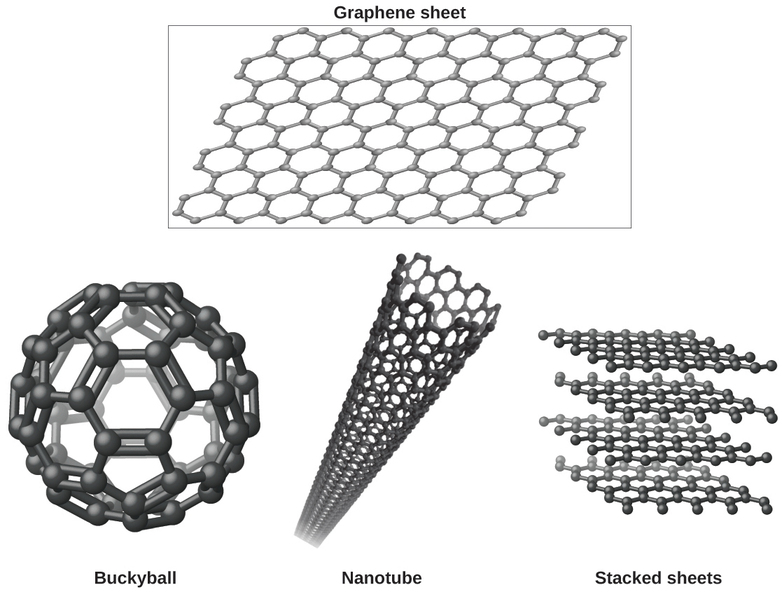
Можливо, ви менш знайомі з нещодавно виявленою формою вуглецю: графеном. Графен був вперше виділений у 2004 році за допомогою стрічки для відшарування тонших і тонких шарів з графіту. Це, по суті, один лист (товщиною один атом) графіту. Графен, проілюстрований на малюнку\(\PageIndex{8}\), не тільки міцний і легкий, але і є відмінним провідником електрики і тепла. Ці властивості можуть виявитися дуже корисними в широкому діапазоні застосувань, таких як значно вдосконалені комп'ютерні чіпи та схеми, кращі батареї та сонячні батареї, а також більш міцні та легкі конструкційні матеріали. Нобелівська премія з фізики 2010 року була присуджена Андре Гейму та Костянтину Новосьолову за новаторську роботу з графеном.
Кристалічні дефекти
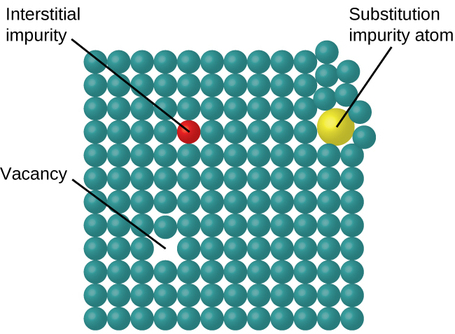
У кристалічному твердому тілі атоми, іони або молекули розташовані за певною повторюваною схемою, але в малюнку можуть виникати випадкові дефекти. Відомо кілька типів дефектів, як показано на малюнку\(\PageIndex{9}\). Вакансії - це дефекти, які виникають, коли вакантні позиції, які повинні містити атоми або іони. Рідше деякі атоми або іони в кристалі можуть займати позиції, звані інтерстиціальними ділянками, розташованими між регулярними положеннями для атомів. Інші спотворення виявляються в нечистих кристалах, як, наприклад, коли катіони, аніони або молекули домішки занадто великі, щоб вписатися в правильні положення без спотворення структури. Слідові кількості домішок іноді додають до кристала (процес, відомий як легування), щоб створити дефекти структури, які дають бажані зміни в його властивостях. Наприклад, кристали кремнію легуються різною кількістю різних елементів, щоб отримати відповідні електричні властивості для їх використання у виробництві напівпровідників і комп'ютерних мікросхем.
Резюме
Деякі речовини утворюють кристалічні тверді речовини, що складаються з частинок в дуже організованій структурі; інші утворюють аморфні (некристалічні) тверді речовини з внутрішньою структурою, яка не впорядкована. Основними типами кристалічних твердих речовин є іонні тверді речовини, металеві тверді речовини, тверді речовини ковалентної мережі та молекулярні тверді речовини. Властивості різних видів кристалічних твердих речовин обумовлені типами частинок, з яких вони складаються, розташуванням частинок і сильними сторонами атракціонів між ними. Оскільки їх частинки відчувають однакові атракціони, кристалічні тверді речовини мають чіткі температури плавлення; частинки в аморфних твердих тілах відчувають цілий ряд взаємодій, тому вони поступово розм'якшуються і плавиться в діапазоні температур. Деякі кристалічні тверді речовини мають дефекти в певному повторюваному малюнку своїх частинок. Ці дефекти (які включають вакансії, атоми або іони, які не знаходяться в регулярних положеннях, і домішки) змінюють фізичні властивості, такі як електропровідність, яка експлуатується в кристалах кремнію, що використовуються для виробництва комп'ютерних чіпів.
Глосарій
- аморфне тверде тіло
- (також, некристалічне тверде тіло) тверде тіло, в якому частинки не мають впорядкованої внутрішньої структури
- ковалентна мережа твердого тіла
- тверде тіло, частинки якого утримуються між собою ковалентними зв'язками
- кристалічна тверда речовина
- тверде тіло, в якому частинки розташовані за певним повторюваним малюнком
- інтерстиціальні сайти
- пробіли між правильними позиціями частинок у будь-якому масиві атомів або іонів
- іонна тверда речовина
- твердий, що складається з позитивних і негативних іонів, утримуваних сильними електростатичними атракціонами
- металевий твердий
- тверда речовина, що складається з атомів металу
- молекулярна тверда речовина
- тверда речовина, що складається з нейтральних молекул, утримуваних між собою міжмолекулярними силами тяжіння
- вакансія
- дефект, який виникає, коли позиція, яка повинна містити атом або іон, є вакантною
