7.5: Зміни держави
- Page ID
- 19179
Переконайтеся, що ви добре розумієте наступні основні ідеї, які були представлені вище. Особливо важливо, щоб ви знали точні значення всіх термінів в контексті цієї теми.
- Опишіть, що мається на увазі під тенденцією виходу молекул з твердої речовини, рідини або газу. Яка експериментально-спостережувана величина служить її мірою?
- Терміни «тиск пари» і «тиск пари над твердою речовиною або рідиною» легко сплутати. Поясніть різницю між ними, і вкажіть, за яких умов вони будуть мати однакові значення.
- Визначте відносну вологість і розрахуйте її значення, враховуючи парціальний тиск водяної пари і відповідну таблицю тиску пари або графік для води.
- Поясніть різницю між випаровуванням і кипінням, і чому рідини можуть не почати кипіти, поки температура не перевищить температуру кипіння.
- Враховуючи фазову діаграму чистої речовини, позначте всі лінії та області, які вони вкладають, визначте нормальні температури плавлення та кипіння, потрійну точку та критичну точку та вкажіть фізичну значимість останніх двох.
- І навпаки, намалюйте правильно позначену діаграму стану чистої речовини, враховуючи зазначені вище параметри, разом з інформацією про відносні щільності твердої та рідкої фаз.
Дана речовина буде існувати у вигляді твердої речовини, рідини або газу, в залежності від температури і тиску. У цьому блоці ми дізнаємося, які загальні фактори регулюють бажаний стан речовини при певному наборі умов, і розглянемо спосіб, яким одна фаза поступається місцем іншій, коли ці умови змінюються.
Стабільність фаз
Раніше вранці крапельки води на малюнку\(\PageIndex{1}\) були крихітними кристалами льоду, але, незважаючи на те, що температура повітря все ще близько 0° C і залишатиметься такою цілий день, сонячне тепло перетворило їх у рідку форму, пов'язану поверхневим натягом у світловідбиваючі сфери. До пізнього дня більшість крапель зникнуть, їх молекули H 2 O тепер розсіюються як слабкий атмосферний газ.

Тверде, рідке та газове — це основні три стани, або фази, в яких може існувати більшість дрібномолекулярних речовин. У більшості комбінацій тиску та температури буде підтримуватися лише одна з цих фаз; це фаза, яка є найбільш термодинамічно стабільною в цих умовах. Правильне пояснення того, чому більшість речовин мають чітко визначені температури плавлення та кипіння, повинно посилатися на деякі принципи термодинаміки та квантової механіки. Повне пояснення цього виходило б за рамки того, з чим знайомі більшість учнів, які бачать цей урок, але наступне значно спрощене пояснення повинно переконати вас, що це щось більше, ніж чорна магія.
Всі атоми і молекули при температурах вище абсолютного нуля володіють тепловою енергією, яка утримує їх в постійних станах руху. Основний закон природи передбачає, що ця енергія має тенденцію поширюватися і поширюватися якомога ширше. В межах однієї молекулярної одиниці це поширення і обмін може відбуватися шляхом розсіювання енергії в безліч дозволених станів руху (трансляції, вібрації, обертання) молекул самої речовини. Таких станів існує величезна кількість, і вони квантовані, а це означає, що всі вони вимагають різної кількості теплової енергії, щоб вступити в дію. Температура є мірою інтенсивності теплової енергії, тому чим вище температура, тим більшою буде кількість станів, які можуть бути активними, і чим ширше буде розподілятися енергія між цими дозволеними станами.
У твердих тілах молекулярні одиниці пов'язані у фіксовані місця, тому види руху (і, отже, кількість станів), які можуть бути термічно активовані, відносно невеликі. Оскільки молекули твердих тіл володіють найменшими потенційними енергіями, тверді речовини є найбільш стабільними станами при низьких температурах. На іншій крайності знаходяться молекули газу, які не тільки вібрують і обертаються, але знаходяться в постійному поступальному русі. Відповідна кількість квантових станів значно більше для газів, забезпечуючи майже нескінченну можливість поширення енергії. Але це може статися лише в тому випадку, якщо температура досить висока, щоб заселити це нове безліч держав. Як тільки це відбувається, газоподібний стан виграє зсувом.
Тенденція виходу та тиск пари
Тенденція втечі більш формально відома як вільна енергія. Майте на увазі також, що зміни в стані завжди передбачають зміни ентальпії та внутрішньої енергії. Практично так само, як чай поширюється з чайного пакетика у більший простір води, в яку він занурений, молекули, які обмежені фазою (рідина, тверда або газ), як правило, поширюватимуться (і теплова енергія, яку вони несуть з собою) якомога ширше. Цей фундаментальний закон природи проявляється в тому, що ми будемо називати тенденцією виходу молекул з фази. Тенденція виходу є величиною фундаментального значення в розумінні всіх хімічних рівноваг і перетворень. На даний момент нам не потрібно формально визначати термін. Наразі важливим є те, як ми можемо спостерігати та порівнювати тенденції уникнення.
Подумайте спочатку про газ: яка властивість газу є найкращим показником його тенденції до виходу з контейнера? Не потрібно багато роздумів, щоб зробити висновок, що чим більший тиск газу, тим частіше його молекули будуть стикатися зі стінками контейнера і, можливо, знаходять свій шлях через отвір назовні. Таким чином, тиск, що обмежує газ, є прямою мірою тенденції молекул до виходу з газоподібної фази.
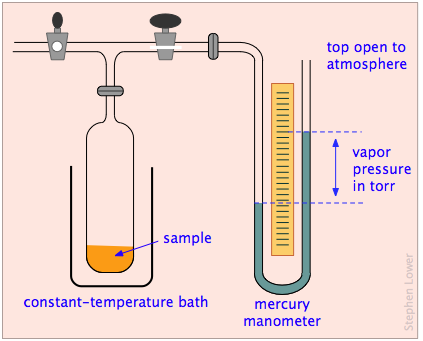
А як щодо рідин і твердих речовин? Хоча ми вважаємо молекули конденсованих фаз постійно обмеженими в них, ці молекули все ще мають деяку теплову енергію, і завжди є ймовірність того, що той, що знаходиться біля поверхні, іноді розлітається і втече в простір поза твердим або рідиною. Ми можемо спостерігати тенденцію виходу молекул в газову фазу з твердого або рідкого, помістивши речовину в закриту евакуйовану ємність, підключену до манометра для вимірювання тиску газу (рис.\(\PageIndex{2}\)).
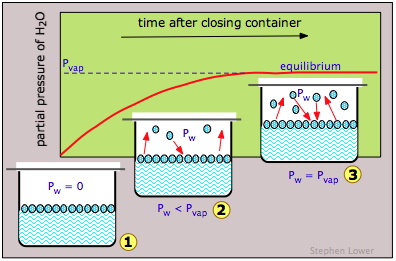
Якщо робити це для води (рис.\(\PageIndex{3}\)), парціальний тиск води P w в паровому просторі спочатку буде дорівнює нулю (1). Поступово P w буде підніматися в міру виходу молекул з речовини і вступу в парову фазу. Але в той же час частина молекул пари буде «виходити» назад в рідку фазу (2). Але оскільки цей останній процес менш сприятливий (при конкретній температурі, представленої тут), P w продовжує підвищуватися. Врешті-решт між двома процесами досягається рівновага (3), і P w врешті-решт стабілізується при фіксованому значенні P vap, яке залежить від речовини і від температури і відоме як рівноважний тиск пари, або просто як «тиск пари» рідини або твердої речовини. Тиск пари є прямою мірою тенденції виходу молекул з конденсованого стану речовини.
Уважно врахуйте, що якщо ємність залишити відкритою для повітря, то навряд чи багато молекул в паровій фазі повернуться в рідку фазу. Вони просто втечуть з усієї системи, і парціальний тиск водяної пари P w ніколи не досягне P vap; рідина просто випаровується без будь-якої рівноваги коли-небудь досягнуто.
Тенденція виходу молекул з фази завжди збільшується з температурою; тому тиск пари рідини або твердої речовини буде більшим при більш високих температурах. Як\(\PageIndex{4}\) показано на малюнку, зміна тиску пари з температурою не є лінійним.
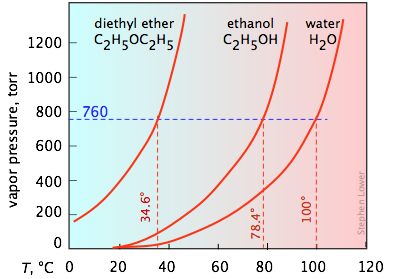
Важливо, щоб ви могли інтерпретувати діаграми тиску пари, такі як три, показані тут. Зверніть особливу увагу на те, як можна знайти точки кипіння з цих ділянок. Ви нагадаєте, що нормальна температура кипіння - це температура, при якій рідина знаходиться в рівновазі зі своєю парою при парціальному тиску 1 атм (760 торр). Таким чином, перехоплення кожної кривої з синьою пунктирною лінією 760-торр вказують на нормальні точки кипіння кожної рідини. Аналогічно, ви можете легко оцінити точки кипіння, які ці рідини мали б у Денвері, штат Колорадо, де атмосферний тиск становить 630 торр, просто побудувавши горизонтальну лінію, відповідну цьому тиску.
Нормальною температурою кипіння вважається температура, при якій рідина знаходиться в рівновазі зі своєю парою при парціальному тиску 1 атм. Це коли тиск пари знаходиться при атмосферному тиску.
Тиск пари води
Велике значення Н 2 О в нашому світі заслуговує більш детального погляду на його властивості тиску пари. Тому що тиск пари води сильно варіюється в діапазоні температур, при яких рідина може існувати (рис.\(\PageIndex{5}\)).
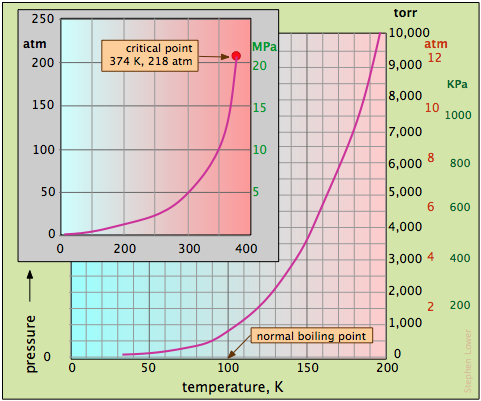
Більший графік на малюнку\(\PageIndex{5}\) охоплює найнижчі температури, тоді як вставка показує повний діапазон значень тиску. Зверніть увагу, зокрема, що
- Нормальна температура кипіння - це температура, при якій тиск пари такий же, як і в стандартній атмосфері, 760 торр.
- Точку кипіння при будь-якому іншому тиску можна дізнатися, опустивши вертикальну лінію від кривої до температурної осі.
- Як видно на графіку врізки, крива тиску пари води закінчується в критичній точці.
Відносна вологість
Тиск пари води при 22° C становить близько 20 торр або близько 0,026 атм (2,7 кПа). Це парціальний тиск Н 2 О, який буде знаходитися в паровому просторі всередині закритого контейнера з водою при цій температурі; повітря в цьому просторі, як кажуть, насичене водяною парою. Вологе повітря іноді описують як «важке», але це вводить в оману; середня молярна маса сухого повітря становить 29, але води лише 18, тому вологе повітря насправді менш щільне. Відчуття «тяжкості», ймовірно, відноситься до зниженої здатності потовиділення випаровуватися у вологому повітрі. У звичайному повітрі парціальний тиск водяної пари в нормі менше його насичення або рівноважного значення. Ставлення парціального тиску Н 2 О в повітрі до його (рівноважного) тиску пари при будь-якій заданій температурі відомо як відносна вологість. Вода надходить в атмосферу через випаровування з океану та інших водойм, а також з насичених водою грунтів. Отриманий пар має властивість розсіюватися і розбавлятися атмосферною циркуляцією, тому відносна вологість рідко досягає 100 відсотків. Коли це відбувається і погода тепла, нам дуже незручно, тому що випаровування води зі шкіри гальмується; якщо повітря вже насичене водою, то нашому поту нікуди йти, окрім як капати вниз по обличчю.
Оскільки тиск пари збільшується з температурою, ділянка повітря, що містить фіксований парціальний тиск водяної пари, матиме більшу відносну вологість при низьких температурах, ніж при високих температурах. Таким чином, коли холодне повітря надходить в опалювальний будинок, його вміст води залишається незмінним, але відносна вологість падає. У кліматі з холодними зимами це сприяє підвищеній втраті вологи з кімнатних рослин і зі слизових оболонок, приводячи до в'янення перших і подразнення останніх.
Тиск пари води становить 3,9 торр при —2° C і 20 торр при 22° C Якою буде відносна вологість всередині будинку, що підтримується на рівні 22° C, коли температура зовнішнього повітря становить -2° C і відносна вологість 70%?
Рішення
При відносній вологості 70 відсотків парціальний тиск повітря -2° становить (0,7 × 3,9 торр) = 2,7 торр. При надходженні цього повітря в будинок його відносна вологість складе (2,7 торр)/(20 торр) = 0,14 або 14%.
Увечері, особливо в ясні ночі, тверді предмети (навіть павутина!) втрачати тепло до неба швидше, ніж повітря. Часто важливо знати, до якої температури повинні опускатися такі предмети, щоб на них конденсувалася атмосферна волога (рис.\(\PageIndex{1}\)). Точка роси - це температура, при якій відносна вологість становить 100 відсотків — тобто температура, при якій тиск пари води стає рівним її парціальному тиску при заданій [вищій] температурі і відносній вологості. Щоб вода конденсувалася безпосередньо з атмосфери як дощ, повітря повинно знаходитися в точці роси або нижче, але це само по собі не єдина вимога для утворення дощу, як ми побачимо незабаром.
Тиск парів твердих гідратів
Багато твердих солей включають молекули води в свої кристалічні решітки; отримані сполуки відомі як гідрати. Ці тверді гідрати мають певний тиск пари, які відповідають рівновазі між гідратованими і безводними сполуками і водяною парою. Наприклад, гексагідрат хлориду стронцію:
\[ \ce{SrCl2 \cdot 6H2O(s) \rightarrow SrCl2(s) + 6H2O(g)} \label{\(\PageIndex{1}\)}\]
Тиск пари цього гідрату становить 8,4 торр при 25°C Тільки при цьому унікальному парціальному тиску водяної пари можуть співіснувати дві тверді речовини при 25°C Якщо парціальний тиск води в повітрі більше 8,4 торр, зразок безводного SrCl 2 буде поглинати вологу з повітря і перетворюватися в гідрат. Насправді, коли повністю зволожується, вода відповідає за 40% маси гідрату.

Якою буде відносна вологість повітря в закритому посудині, що містить твердий SrCl 2 · 6H 2 O при 25° C?
Рішення
Яку частку тиску пари води при цій температурі (23,8 торр) становить тиск пари гідрату (8,4 торр)? Виражається у відсотках, це відносна вологість.
Якщо парціальний тиск Н 2 О в повітрі менше, ніж тиск пари гідрату, останній буде мати тенденцію втрачати вологу і повернутися до своєї безводної форми. Цей процес іноді супроводжується розпадом кристала в порошкоподібну форму, ефект відомий як висоли.
Конденсація і кипіння: зародження
Випаровування і кипіння рідини, і конденсація газу (пари) - це такі звичайні частини нашого повсякденного життя, що ми навряд чи даємо про них задуматися. Кожен раз, коли ми кип'ятимо воду, щоб зробити горщик з чаєм і бачити хмару пари над чайником, ми спостерігаємо цю найпоширенішу з усіх фазових змін. Як ми можемо зрозуміти ці зміни з точки зору тиску пари?
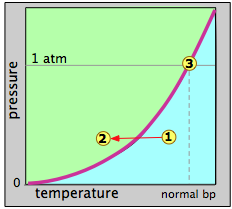
\(\PageIndex{6}\)Малюнок показує тиск пари в залежності від температури може представляти воду або будь-яку іншу рідину. Коли ми говоримо, що це графік тиску пари, ми маємо на увазі, що кожна точка на кривій являє собою комбінацію температури та тиску пари, при якій рідина (зелений) та пар (синій) можуть співіснувати. Таким чином, при нормальній температурі кипіння, визначеній як температура, при якій тиск пари дорівнює 1 атм, стан системи відповідає точці з маркуванням 3.
Припустимо, що ми вибираємо довільну точку 1 при температурі і тиску, при якій стабільно тільки газоподібний стан. Потім ми зменшуємо температуру таким чином, щоб перемістити точку стану до точки 2 в області рідини. Коли точка стану падає на лінію тиску пари, дві фази можуть співіснувати, і ми очікуємо, що деяка рідина конденсується. Як тільки точка стану переміщається вліво від лінії тиску пари, речовина буде повністю перебувати в рідкій фазі. Це нібито те, що відбувається, коли над каструлею з киплячою водою утворюється «пар» (насправді крихітні краплі води).
Зворотний процес повинен працювати так само: починаючи з температури в області рідини, нічого не відбувається, поки ми не досягнемо лінії тиску пари, в цей момент рідина починає змінюватися в пар. При більш високих температурах залишається тільки пар. Це теорія, але вона не повна. Справа в тому, що пар, як правило, не конденсується до рідини при температурі кипіння (також називається точкою конденсації або точкою роси), і рідина, як правило, не кипить при температурі кипіння.
Бульбашки і краплі
Причина розбіжності полягає в тому, що тиск пари, як ми зазвичай використовуємо цей термін і як це зображено лінією рідина-пара на фазовій діаграмі, відноситься до парціального тиску пари в рівновазі з рідиною, поверхня якої досить рівна, як це було б у частково заповненій ємності. У краплі рідини або в бульбашці пари всередині рідини поверхня рідини не рівна, а вигнута. Для крапель або бульбашок, які мають розумний розмір, це не має особливої різниці, але ці краплі та бульбашки повинні рости з менших, а ці з більш дрібних все ще. Зрештою, людина спускається до первісних крапель і бульбашок, що мають лише кілька молекулярних розмірів, і саме тут ми стикаємося з проблемою: це проблема зародження - утворення і зростання першої крихітної краплі (в парі) або бульбашки (в рідині).
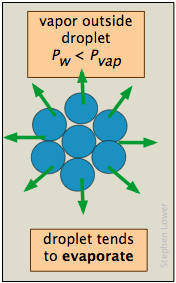
Тиск пари рідини визначається силами притягання, які діють над твердим кутом 180° на поверхні рідини. У дуже маленькій краплі поверхня рідини вигнута таким чином, що кожна молекула відчуває менше найближчих сусідських пам'яток, ніж це стосується об'ємної рідини. Найвіддаленіші молекули рідини пов'язані з крапелькою менш щільно, і крапля має більший тиск пари, ніж у сипучої рідини. Якщо тиск пари краплі буде більше парціального тиску пари в газовій фазі, то крапля випарується. Таким чином, вкрай малоймовірно, що крапля коли-небудь утворюється всередині пари, коли вона охолоджується.
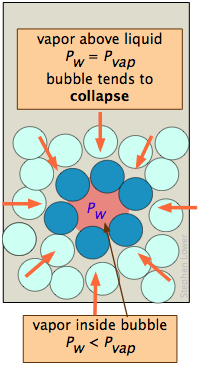
Бульбашка, як крапля, повинен починатися з малого і збільшуватися, але тут є складність, схожа на ту, що має бульбашки. Бульбашка - це отвір у рідині; молекули на кордоні рідини вигнуті всередину, так що вони відчувають пам'ятки найближчого сусіда над твердим кутом більше 180°. Як наслідок, тиск пари рідини, зверненої в міхур P w, завжди менше, ніж у насипної рідини P w при тій же температурі. Коли насипна рідина знаходиться в точці кипіння (тобто коли її тиск пари становить 1 атм), тиск пари всередині міхура буде менше 1 атм, тому міхур буде мати тенденцію до руйнування. Також, оскільки бульбашка утворюється всередині рідини, до цього ефекту додасть гідростатичний тиск рідини, що накладається. З обох цих причин рідина не кипить, поки температура не підніметься трохи вище температури кипіння, явище відоме як перегрів. Як тільки почнеться кипіння, воно буде продовжувати робити це при належній температурі кипіння рідини.
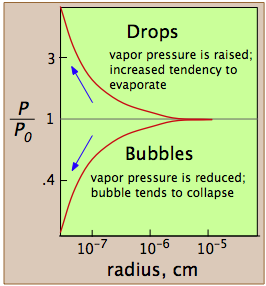
Ці графіки показують, як у випадку з водою тиск пари дуже маленького міхура або краплі змінюється в залежності від його радіуса кривизни; величина, що будується, - це відношення фактичного тиску пари P до P o, тиску пари плоскої поверхні.
Конденсація рідин
Якщо найдрібніші краплі призначені для самознищення, чому пари коли-небудь конденсуються (наприклад, чому йде дощ)?
- Якщо охолодити пар в ємності, конденсат відбувається не всередині самого пара, а на внутрішній поверхні ємності. Тут відбувається те, що міжмолекулярні атракціони між твердою поверхнею призведуть до того, що молекули пари адсорбуються на поверхні та стабілізують початкову краплю, поки вона не виросте до розміру, при якому вона може бути самоокупною. Це походження конденсату зовні від прохолодного напою, або роси, яка з'являється на траві.
- У випадку з хмарою пари, яку ви бачите над киплячою водою, перші кілька крапель утворюються на крихітних частинках пилу в повітрі - ті, які можна побачити розсіяним світлом, коли сонячний промінь світить через затемнене приміщення.
Хмари та опади В області атмосфери, де утворюється дощ, є велика кількість твердих частинок, переважно мікроскопічних розмірів. Деякі з них є частинками солі, що утворюються при випаровуванні спрею з поверхні океану. Багато ядер конденсації мають біологічне походження; до них відносяться бактерії, спори та частинки сульфату амонію. Є вулканічний і метеоритний пил, і звичайно є пил і дим через діяльність людини. Ці частинки мають тенденцію адсорбувати водяну пару, а деякі можуть навіть розчинятися, утворюючи крапельку концентрованого розчину. У будь-якому випадку тиск пари води знижується нижче її рівноважного значення, таким чином стабілізуючи агрегат, поки він не зможе вирости до самопідтримуваних розмірів і стати туманом, дощем або снігом.
Ось, до речі, тому туман є подразником для носа і горла; кожна крапелька туману несе в собі частинку пилу або (в повітрі, забрудненому спалюванням сірковмісних викопних палив) крапельку сірчаної кислоти, яку вона ефективно відкладає на ваших чутливих слизових оболонках. Якщо у вас є автомобіль, який залишився на вулиці в туманну ніч, ви, можливо, помітили, наскільки брудне лобове скло вранці.
Перегрів і кип'ятіння рідин
У чому різниця між випаровуванням і кипінням рідини? Коли рідина випаровується при температурі нижче її температури кипіння, молекули, що входять в парову фазу, роблять це безпосередньо з поверхні. Коли рідина закипає, бульбашки пари утворюються всередині рідини, і виводяться на поверхню своєю меншою щільністю (плавучістю). Коли вони піднімаються, зменшується гідростатичний тиск змушує бульбашки розширюватися, зменшуючи їх щільність (і збільшуючи їх плавучість) ще більше.
Але, як ми пояснювали вище, отримати цей перший міхур, щоб сформувати і вижити, часто досить важко, щоб рідини зазвичай перегріваються, перш ніж вони починають кипіти. Якщо у вас був досвід роботи в лабораторії органічної хімії, ви, напевно, знаєте це як «натикаючись», і вас навчили вживати запобіжних заходів проти нього. У великих кількостях перегріті рідини можуть бути дуже небезпечними, оскільки введення домішки (наприклад, виділення повітряного міхура з поверхні контейнера) або навіть механічне порушення може спровокувати зародження і викликати кипіння раптово і майже вибухонебезпечно (Відео\(\PageIndex{1}\)).
Багато людей були серйозно спалені після спроби кип'ятити воду в мікрохвильовій печі або після додавання порошкоподібного матеріалу, такого як розчинна кава в таку воду. Коли вода нагрівається на плиті, дно ємності перегріває тільки тонкий шар води, відразу стикаючись з нею, виробляючи локалізовані «мікровибухи», які можна почути безпосередньо перед початком регулярного плавного кипіння; ці бульбашки швидко розходяться і служать центрами зародження для регулярного кип'ятіння . У мікрохвильовій печі, однак, енергія поглинається самою водою, так що вся основна маса води може перегрітися. Якщо це станеться, найменше порушення може спричинити вибуховий спалах в пару.
Сублімація
Деякі тверді речовини мають настільки високий тиск пари, що нагрівання призводить до значної кількості прямого випаровування ще до досягнення температури плавлення. Це стосується твердого йоду, наприклад. I 2 тане при 115° C і кипить при 183° C, легко піддається сублімації при температурі близько 100° C, навіть лід має вимірюваний тиск пари поблизу температури замерзання, про що свідчить тенденція випаровування снігу в холодну суху погоду. Є й інші тверді речовини, тиск пари яких перевершує тиск рідини до того, як може статися плавлення. Такі речовини піднесені без танення; поширеним прикладом є твердий вуглекислий газ («Сухий лід») в 1 атм (див. Діаграму стану СО 2 нижче).
Фазові діаграми
Температури і тиск, при яких дана фаза речовини стабільна (тобто, від яких молекули мають найнижчу тенденцію виходу), є важливою властивістю будь-якої речовини. Оскільки і температура, і тиск є факторами, прийнято будувати області стійкості різних фаз в координатах P - T, як в цій загальній діаграмі фаз для гіпотетичної речовини.
Оскільки тиск і температура можуть змінюватися в дуже широких діапазонах, звичайною практикою є малювання фазових діаграм з нелінійними або спотвореними координатами. Це дозволяє нам компактно висловити багато інформації та візуалізувати зміни, які не могли бути представлені на лінійно масштабованому графіку. Важливо, щоб ви могли інтерпретувати фазову діаграму, або, як варіант, побудувати грубу, якщо дані відповідні дані. Зверніть особливу увагу на наступні моменти:
- Три кольорові області на діаграмі - це діапазони тиску і температури, при яких відповідна фаза є єдиною стабільною.
- Три рядки, які зв'язали ці області, визначають усі значення (P, T), при яких дві фази можуть співіснувати (тобто перебувати в рівновазі). Зверніть увагу, що однією з цих ліній є крива тиску пари рідини, як описано вище. «Крива сублімації» - це лише крива тиску пари твердого тіла. Ухил лінії залежить від різниці щільності двох фаз.
- Для того, щоб зобразити важливі особливості фазової діаграми в дуже широкому діапазоні тисків і температур, які вони охоплюють, осі зазвичай не намальовані в масштабі і, як правило, сильно спотворюються. Це є причиною того, що «крива плавлення» виглядає як пряма лінія на більшості цих діаграм.
- Там, де три названі криві перетинаються, всі три фази можуть співіснувати. Ця умова може відбуватися лише при унікальному значенні (P, T), відомому як потрійна точка. Оскільки всі три фази знаходяться в рівновазі в потрійній точці, їх тиск пари при цій температурі буде ідентичним.
- Лінія, яка розділяє рідинну і парну області, закінчується в критичній точці. При температурах і тисках, що перевищують критичну температуру і тиск, окремої рідкої фази не існує. Ми називаємо цей стан просто рідиною, хоча термін надкритична рідина також широко використовується.
Найкращий спосіб переконатися, що ви розумієте фазову діаграму - це уявити, що ви починаєте з певною температурою і тиском, а потім змінюєте лише один з цих параметрів, зберігаючи інший постійним. Ви будете проходити горизонтальний або вертикальний шлях на фазовій діаграмі, і буде змінюватися стан кожного разу, коли ваш шлях перетинає лінію. Особливе значення має горизонтальний шлях (показаний синьою лінією на діаграмі вище), відповідний тиску в 1 атмосферу; ця лінія визначає нормальні температури плавлення і кипіння речовини.
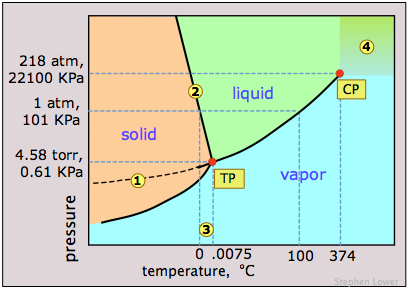
Зверніть увагу на наступні особливості для діаграми стану води (рис.\(\PageIndex{11}\)):
- Нахил лінії 2, що розділяє тверду і рідку області, негативний; це відображає незвичайну властивість того, що щільність рідини більше, ніж у твердої речовини, і це означає, що температура плавлення льоду зменшується зі збільшенням тиску. Таким чином, якщо лід при 0° C піддається високому тиску, він виявиться вище температури плавлення і розтане. (Всупереч тому, що іноді говорять, однак, це не є причиною того, що лід тане під тиском ковзанів або лиж, забезпечуючи мастильну плівку, яка робить ці способи транспортування такими приємними. Плавлення в цих випадках виникає при фрикційному нагріванні).
- Пунктирна лінія 1 є продовженням лінії тиску пари рідини нижче точки замерзання. Це являє собою тиск пари переохолодженої води - метастабільний стан води, який може тимчасово існувати приблизно до -20° C. (Якщо ви живете в регіоні, схильному до «замерзання дощу», ви зіткнулися з переохолодженою водою!)
- 3 Потрійна точка (TP) води знаходиться всього на 0,0075° вище точки замерзання; тільки при цій температурі і тиску всі три фази води можуть співіснувати нескінченно довго.
- 4 Вище критичної температури (CP) 374° C, окремої рідкої фази води не існує.
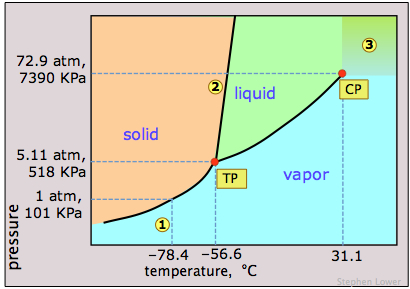
Сухий лід, твердий вуглекислий газ, широко використовується в якості холодоагенту, і фазова діаграма на малюнку\(\PageIndex{12}\) показує, чому він «сухий». Потрійний точковий тиск становить 5,11 атм, тому нижче цього тиску рідкий СО 2 не може існувати; тверда речовина може піднесено лише безпосередньо до пари. Газовий вуглекислий газ при парціальному тиску 1 атм знаходиться в рівновазі з твердою речовиною при 195К (−79 °С, 1); це нормальна температура сублімації вуглекислого газу. Температура поверхні сухого льоду буде трохи менше цієї, так як парціальний тиск СО 2 при контакті з твердим тілом зазвичай буде менше 1 атм. Зверніть увагу також, що критична температура СО 2 становить лише 31° C, це означає, що в дуже теплий день СО 2 у вогнегаснику буде повністю випаровуватися; тому посудина повинна бути достатньо міцною, щоб витримати тиск 73 атм.
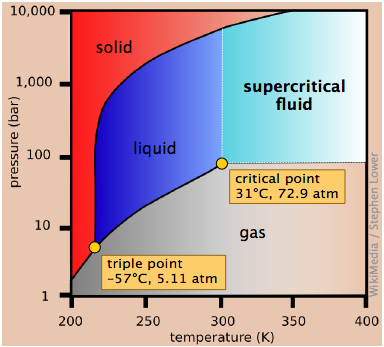
Цей погляд на діаграму вуглекислого газу використовує логарифмічну шкалу тиску і, таким чином, охоплює набагато ширший діапазон тисків, виявляючи верхню межу рідкої фази (рідкої та надкритичної). Надкритичний вуглекислий газ (СО 2 вище його критичної температури) має властивості розчинника рідини та проникаючі властивості газу; одним з основних застосувань є видалення кофеїну з кавових зерен.
Елементарний йод, I 2, утворює темно-сірі кристали, які мають майже металевий вигляд. Він часто використовується в класах хімії як приклад твердого тіла, яке легко піддається сублімації; якщо ви бачили таку демонстрацію або експериментували з нею в лабораторії, його фазова діаграма може бути цікавою.
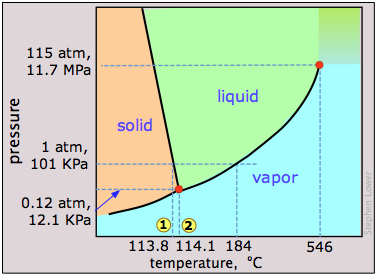
Найбільш помітною особливістю фазової поведінки йоду є невелика різниця (менше градуса) між температурами його потрійної точки 1 і температурою плавлення 2. Всупереч враженню багатьох людей, немає нічого особливого в схильності йоду до піднесення, яку поділяють багато молекулярних кристалів, включаючи лід та нафталін («кульки молі».) Тиск пари йоду при кімнатній температурі дійсно досить малий - всього близько 0,3 торр (40 Па) .Той факт, що твердий йод має сильний запах і оточений фіолетовою парою в закритій ємності, в основному є наслідком його сильної здатності поглинати зелене світло (це залишає синій і червоний, які роблять фіолетовий) і висока чутливість наших носів до його парів.
Діаграма стану сірки
Сірка демонструє дуже складну фазову поведінку, яка спантеличує хіміків більше століття; те, що ви бачите тут, - це значно спрощена діаграма, показана в більшості підручників. Складність виникає через тенденцію молекул S 8 розбиватися на ланцюги (особливо в рідині вище 159° C) або переставлятися на кільця різного розміру (S 6 до S 20). Навіть пар може містити суміш видів S 2 через S 10.
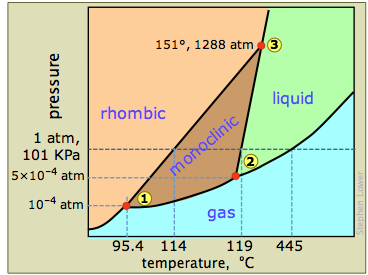
Діаграма стану сірки містить нову особливість: виділяють дві тверді фази, ромбічну і моноклінну. Назви відносяться до кристалічних структур, в яких влаштовуються молекули S 8. Це дає початок трьом потрійним точкам, позначеним цифрами на схемі.
З фазової діаграми на малюнку\(\PageIndex{14}\) identify one example of three phases that never coexist in s ulfur (\(S_8\)(підказка є кілька правильних відповідей)?
Коли ромбічна сірка (стабільна низькотемпературна фаза) нагрівається повільно, вона змінюється до моноклінної форми при 114° C, яка потім плавиться при 119°. Але якщо моноклінна форма швидко нагрівається, молекули не встигають переставити себе, тому ромбічне розташування зберігається як метастабільна фаза, поки вона не розплавиться при 119-120°. Утворення більш ніж однієї твердої фази не рідкість - насправді, якщо досліджувати дуже високий тиск (див. Нижче), це, здається, правило.
Екстремальний тиск і температура
Ми схильні думати про властивості речовин, як вони існують в умовах, з якими ми стикаємося в повсякденному житті, забуваючи, що більша частина матерії, що становить наш світ, знаходиться всередині Землі, де тиск на порядки вище (рис.\(\PageIndex{15}\)). Геохіміки та планетарні вчені повинні знати про фазову поведінку речовин при високих температурах і тиску, щоб розробити корисні моделі для перевірки своїх теорій про будову та еволюцію Землі та Сонячної системи.
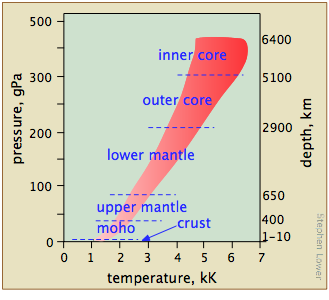
Які діапазони температур і тиску, ймовірно, будуть цікаві - і, що більш важливо, є експериментально доступними?
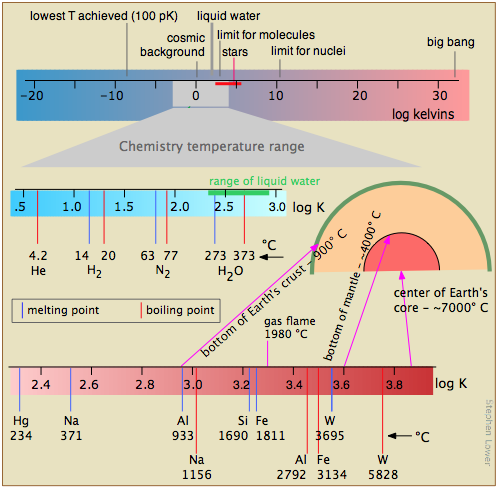
\(\PageIndex{16}\)На малюнку показано кілька шкал (всі з яких, будь ласка, зауважте, є логарифмічними), які охоплюють відповідно діапазон температур для Всесвіту; низькі температури, що мають важливе значення для хімії (зверніть увагу на зелену лінію, що вказує на температури, при яких може існувати рідка вода); більш високі температури, показуючи температури плавлення і кипіння декількох елементів для довідки. Найвищі температури, які можуть бути вироблені в лабораторії, досягаються (але тільки на дуже короткі проміжки часу) світловими імпульсами від лазерного або синхротронного випромінювання.
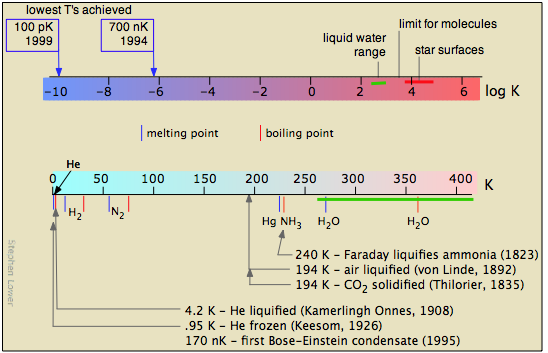
Вивчення низьких температур обмежується законами фізики, які забороняють досягати абсолютного нуля. Але той факт, що немає меж тому, наскільки близько можна наблизитися до 0 К, спонукало багато творчих експериментів.
Вивчення речовини при високих тисках - завдання непросте. Загальні методи були першопрохідцями між 1908-1960 роками П.У. Бріджмен з Гарвардського університету, чия робота отримала йому Нобелівську премію 1946 року з фізики. Більш пізня розробка клітини алмазної ковадла значно розширила діапазон досяжних тисків та види спостережень, які можна зробити. Ударно-хвильові прийоми зробили можливим виробництво короткочасних тисків в діапазоні TPa.
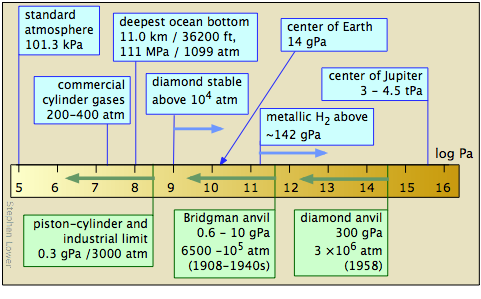
Лабораторні дослідження високого тиску показали, що багато молекулярних речовин, таких як водень і вода, змінюються на тверді фази, що мають температуру плавлення значно вище кімнатної температури при дуже високих тисках; існує тверда форма льоду, яка залишається замороженою навіть при 100° C. при все ще більш високих тисках багато з них речовини стають металами. Вважається, що більша частина внутрішньої частини найбільших планет складається з металевого водню — і, власне, що всі речовини можуть стати металевими при досить високому тиску.
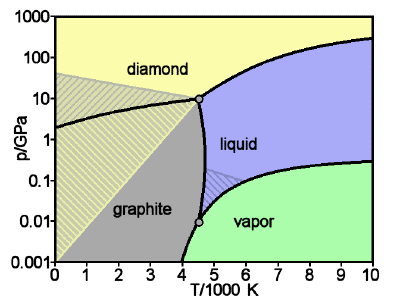
Малюнок\(\PageIndex{19}\): Діаграма стану вуглецю: алмаз і графіт
Графіт є стабільною формою твердого вуглецю при низькому тиску; алмаз стабільний лише вище приблизно 10 4 атм. Але як тільки він знаходиться в такій формі, швидкість, з якою алмаз перетворюється назад у графіт, є невимовно повільною в звичайних умовах навколишнього середовища; просто недостатньо теплової енергії, щоб розірвати всі ці вуглецево-вуглецеві зв'язки. Тож діаманти, якими ми захоплюємося в ювелірних виробах і дорого платимо за них, кажуть, метастабільні. [зображення: Вікімедіа]
Синтетичні алмази
Для перетворення графіту в алмаз з розумною швидкістю потрібно тиск 200 000 атм і температура близько 4000 К. Оскільки жоден апарат не може вижити в цих умовах, процес, відомий як синтез високої температури високого тиску (HPHT) здійснюється комерційно при 70 000 атм і 2300 К в розчині розплавленого нікелю, який також виступає каталізатором. Сліди Ni в готовому виробі служать для відрізнення синтетичних алмазів від натуральних. Однак більшість синтетичних алмазів занадто малі (всього кілька міліметрів) і занадто недосконалі для якості дорогоцінних каменів, і використовуються в основному для виготовлення промислових шліфувальних та ріжучих інструментів.
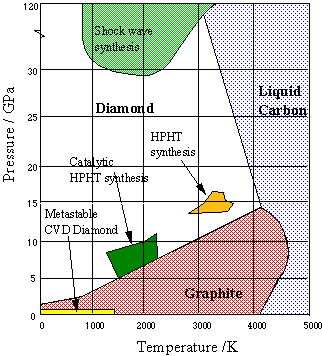
Малюнок\(\PageIndex{20}\): Діаграма стану вуглецю: алмаз і графіт
Зовсім недавно тонкі алмазні плівки стали важливими для інженерних застосувань та виготовлення напівпровідників. Вони найчастіше виготовляються шляхом конденсації газоподібного вуглецю на відповідну підкладку (хімічне осадження пари, CVD). Умови, при яких виготовляються синтетичні алмази, зображені на наведеній вище фазовій діаграмі Брістольського університету.
Відео\(\PageIndex{2}\): Хімік Рой Гат пояснює, як він використовує фазові діаграми для синтезу синтетичних алмазів при низькому тиску і температурах.
Гелій фази дивацтва
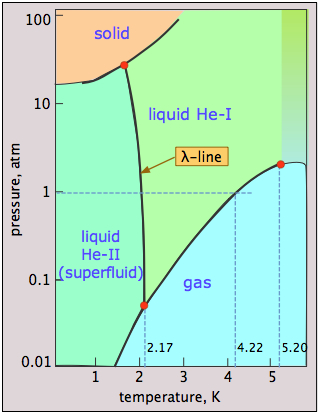
Гелій унікальний тим, що квантові явища, які зазвичай стосуються лише крихітних об'єктів, таких як атоми та електрони, поширюються і домінують над його макроскопічними властивостями. Погляд на фазову діаграму\(\ce{^4He}\) виявляє деякі з цієї квантової дивацтва. Основні моменти, на які слід звернути увагу, є:
- Гелій можна заморожувати тільки при високому тиску;
- Тверде тіло і газ не можуть співіснувати (перебувати в рівновазі) ні за яких умов;
- Існує дві рідкі фази, гелій I (звичайна рідина) і гелій II (вкрай незвичайна впорядкована рідина);
- Лінія λ (лямбда) представляє (P, T) значення, при яких дві фази можуть співіснувати;
- Гелій-II поводиться як надтекуча — по суті квантова рідина.
Чому рідкий гелій не може замерзнути при низькому тиску? Низька маса атомів Він і їх тісне ув'язнення в твердому тілі забезпечує їм дуже високу енергію нульової точки (принцип невизначеності Гейзенберга в дії!) що дозволяє їм вібрувати з такою амплітудою, що вони долають сили дисперсії, які в іншому випадку утримують тверде тіло разом, тим самим зберігаючи атоми занадто відокремленими, щоб утворити тверде тіло. Тільки застосовуючи високий тиск (25 атм) цей ефект можна подолати.
Гелій-II, квантові рідини та надплинність
Зазвичай квантова теорія потрібна лише для опису властивостей крихітних об'єктів, таких як електрони, але з рідким He-II вона поширюється на макроскопічну шкалу об'ємної рідини. \(\ce{^4He}\)атоми (99,99+ відсотків природного гелію) є бозонами, а це означає, що при низьких температурах всі вони можуть займати однаковий квантовий стан (всі інші нормальні атоми є ферміонами і підпорядковуються принципу виключення Паулі).
Всі разом, тепер
Об'єкти, які займають однаковий квантовий стан, мають однаковий імпульс. Таким чином, коли один атом рухається, всі вони рухаються разом. У певному сенсі це означає, що вся основна маса рідини He-II виступає як єдине ціле. Ця властивість, відома як надплинність, породжує ряд чудових ефектів, зокрема:
- Рідина може протікати по вузькому каналу без тертя, аж до критичної швидкості, яка залежить від співвідношення швидкості потоку до ширини каналу;
- При розміщенні в контейнері вони утворюють плівку, яка піднімається вгору по стінках і вниз зовні, домагаючись того ж рівня за межами контейнера, що і всередині, якщо це можливо;
- Мала молекула, розчинена в Гелію-II, поводиться так само, як і у вакуумі.
У рідкому Гелію-II тільки близько 10% атомів знаходяться в такому стані, але цього достатньо, щоб надати рідини деякі дивні властивості квантової рідини.
Він 3 демонструє подібні властивості, але завдяки низькому природному достатку він не був широко вивчений до 1940-х років, коли великі кількості стали доступні як побічний продукт виробництва ядерної зброї. Нарешті, в 1996 році його надплинність спостерігалася при температурі 2 нК. Хоча атоми He 3 є ферміонами, лише ті, які з'єднуються (і, таким чином, припускають властивості бозонів), породжують надплинність.
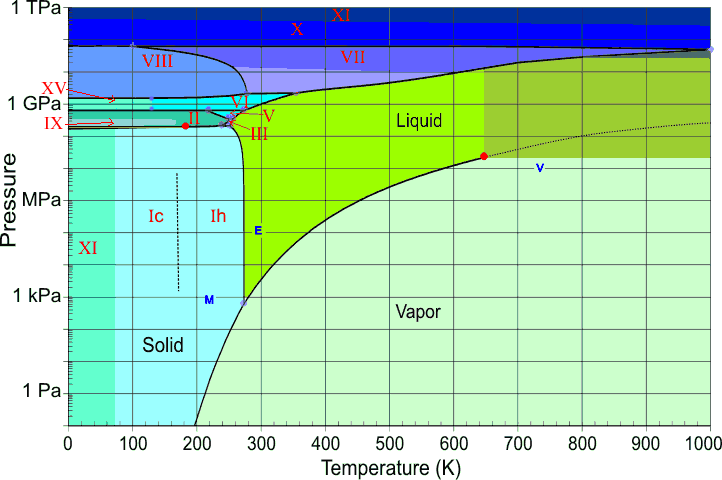
Вода при високому тиску
Вода, як і більшість інших речовин, проявляє багато твердих форм при більш високих тисках (рис.\(\PageIndex{22}\)). До цих пір було визначено п'ятнадцять різних крижаних фаз; вони позначені римськими цифрами ICE-I через ICE-XV. Ice-I може існувати у двох модифікаціях; кристалічна решітка Ice-IC є кубічною, тоді як кришталева решітка льоду-lh - шестикутна. Останній відповідає звичайному льоду, який ми всі знаємо. Цікаво відзначити, що кілька фаз високого тиску льоду можуть існувати при температурі понад 100° C.