5.1: Основи енергетики
- Page ID
- 22723
- Визначте енергію, розрізняйте типи енергії та опишіть природу енергетичних змін, які супроводжують хімічні та фізичні зміни
- Розрізняють пов'язані властивості тепла, теплової енергії та температури
- Визначте та розрізніть питому теплоємність і теплоємність, а також опишіть фізичні наслідки обох
- Виконання розрахунків за участю теплоти, питомої теплоти та зміни температури
Хімічні зміни і супутні їм зміни в енергії є важливими частинами нашого повсякденного світу (рис.\(\PageIndex{1}\)). Макроелементи в їжі (білки, жири та вуглеводи) проходять метаболічні реакції, які забезпечують енергію для підтримки функціонування нашого організму. Ми спалюємо різноманітне паливо (бензин, природний газ, вугілля) для виробництва енергії для транспортування, опалення та виробництва електроенергії. Промислові хімічні реакції використовують величезну кількість енергії для виробництва сировини (наприклад, заліза та алюмінію). Потім енергія використовується для виробництва цієї сировини в корисні продукти, такі як автомобілі, хмарочоси та мости.

Понад 90% енергії, яку ми використовуємо, походить від сонця. Щодня Сонце забезпечує землю майже в 10 000 разів більшою кількістю енергії, необхідної для задоволення всіх світових енергетичних потреб на цей день. Наше завдання полягає в тому, щоб знайти способи перетворення та зберігання вхідної сонячної енергії, щоб її можна було використовувати в реакціях або хімічних процесах, які є зручними та екологічно чистими. Рослини та багато бактерій захоплюють сонячну енергію за допомогою фотосинтезу. Ми виділяємо енергію, що зберігається в рослині, коли спалюємо деревину або рослинні продукти, такі як етанол. Ми також використовуємо цю енергію для підживлення нашого організму, вживаючи їжу, яка надходить безпосередньо з рослин або від тварин, які отримували свою енергію, поїдаючи рослини. Спалювання вугілля та нафти також виділяє накопичену сонячну енергію: ці види палива є скам'янілими рослинними та тваринними речовинами.
У цьому розділі будуть представлені основні ідеї важливої галузі науки, пов'язаної з кількістю тепла, що поглинається або виділяється під час хімічних та фізичних змін - області, яка називається термохімією. Поняття, введені в цій главі, широко використовуються практично у всіх науково-технічних областях. Харчові вчені використовують їх для визначення енергетичності харчових продуктів. Біологи вивчають енергетику живих організмів, таку як метаболічне згоряння цукру в вуглекислий газ і воду. Нафтова, газова та транспортна галузі, постачальники відновлюваних джерел енергії та багато інших намагаються знайти кращі методи виробництва енергії для наших комерційних та особистих потреб. Інженери прагнуть підвищити енергоефективність, знайти кращі способи обігріву та охолодження наших будинків, охолодити нашу їжу та напої та задовольнити потреби в енергії та охолодженні комп'ютерів та електроніки, серед інших застосувань. Розуміння термохімічних принципів має важливе значення для хіміків, фізиків, біологів, геологів, кожного типу інженерів і майже всіх, хто вивчає або займається будь-якою наукою.
Енергетика
Енергію можна визначити як потужність для подачі тепла або виконання робіт. Одним з видів роботи (w) є процес змушення матерії рухатися проти протилежної сили. Наприклад, ми робимо роботу, коли ми надуваємо велосипедну шину - ми рухаємо матерію (повітря в насосі) проти протилежної сили повітря, що оточує шину.
Як і матерія, енергія буває різних типів. Одна схема класифікує енергію на два типи: потенційна енергія, енергія, яку має об'єкт через його відносне положення, склад або стан, і кінетична енергія, енергія, якою володіє об'єкт через його рух. Вода у верхній частині водоспаду або греблі має потенційну енергію через своє положення; коли вона тече вниз через генератори, вона має кінетичну енергію, яку можна використовувати для роботи та виробництва електроенергії на гідроелектростанції (рис.\(\PageIndex{2}\)). Акумулятор має потенційну енергію, оскільки хімічні речовини всередині нього можуть виробляти електроенергію, яка може працювати.

Енергія може бути перетворена з однієї форми в іншу, але вся енергія, присутня перед зміною, завжди існує в тій чи іншій формі після завершення зміни. Це спостереження виражається в законі збереження енергії: під час хімічної або фізичної зміни енергія не може бути ні створена, ні руйнуватися, хоча її можна змінювати за формою. (Це також одна з версій першого закону термодинаміки, про що ви дізнаєтеся пізніше.)
Коли одна речовина перетворюється в інше, завжди відбувається пов'язане перетворення однієї форми енергії в іншу. Тепло зазвичай виділяється або поглинається, але іноді перетворення включає світло, електричну енергію або якусь іншу форму енергії. Наприклад, хімічна енергія (тип потенційної енергії) зберігається в молекулах, що складають бензин. Коли бензин згоряє в циліндрах двигуна автомобіля, швидко розширюються газоподібні продукти цієї хімічної реакції генерують механічну енергію (тип кінетичної енергії), коли вони рухають поршні циліндрів.
Відповідно до закону збереження речовини (розглянутого в попередньому розділі), не спостерігається виявлених змін загальної кількості речовини під час хімічної зміни. Коли відбуваються хімічні реакції, зміни енергії відносно скромні, а зміни маси занадто малі для вимірювання, тому закони збереження речовини та енергії тримаються добре. Однак в ядерних реакціях зміни енергії набагато більше (за факторами мільйона або близько того), зміни маси вимірювані, а матерія-енергетичні перетворення значні. Більш детально це буде розглянуто в наступному розділі, присвяченому ядерній хімії. Щоб охопити як хімічні, так і ядерні зміни, ми об'єднуємо ці закони в одне твердження: загальна кількість речовини і енергії у Всесвіті фіксована.
Теплова енергія, температура та тепло
Теплова енергія - кінетична енергія, пов'язана з випадковим рухом атомів і молекул. Температура - це кількісна міра «гарячої» або «холодної». Коли атоми та молекули в об'єкті швидко рухаються або вібрують, вони мають вищу середню кінетичну енергію (КЕ), і ми говоримо, що об'єкт «гарячий». Коли атоми і молекули рухаються повільно, у них нижче КЕ, і ми говоримо, що об'єкт «холодний» (рис.\(\PageIndex{3}\)). Припускаючи, що ніякої хімічної реакції або зміни фази (наприклад, плавлення або випаровування) не відбувається, збільшення кількості теплової енергії в зразку речовини призведе до підвищення її температури. І, припускаючи, що ніякої хімічної реакції або зміни фази (наприклад, конденсації або заморожування) не відбувається, зменшення кількості теплової енергії в зразку речовини призведе до зниження її температури.

Більшість речовин розширюються при збільшенні їх температури і стискаються, коли їх температура знижується. Це властивість можна використовувати для вимірювання температурних перепадів, як показано на малюнку\(\PageIndex{4}\). Робота багатьох термометрів залежить від розширення і стиснення речовин у відповідь на перепади температур.


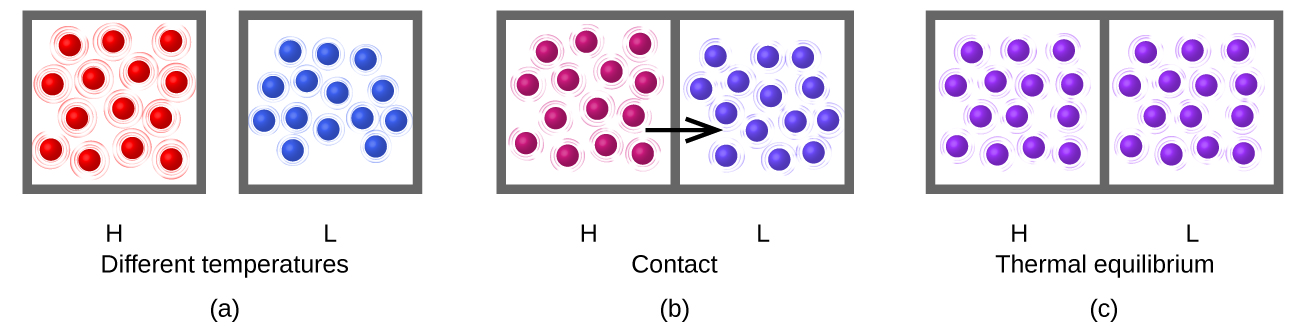
Тепло (q) - це передача теплової енергії між двома тілами при різних температурах. Тепловий потік (надлишковий термін, але один часто вживаний) збільшує теплову енергію одного тіла і зменшує теплову енергію іншого. Припустимо, у нас спочатку є висока температура (і висока теплова енергія) речовина (Н) і низькотемпературне (і низька теплова енергія) речовина (L). Атоми і молекули в Н мають більш високий середній KE, ніж у L. Якщо ми помістимо речовину H в контакт з речовиною L, теплова енергія буде стикатися мимовільно від речовини H до речовини L. Температура речовини H знизиться, як і середня KE його молекул; температура речовина L буде збільшуватися разом із середнім КЕ його молекул. Тепловий потік буде тривати до тих пір, поки дві речовини не будуть при однаковій температурі (рис.\(\PageIndex{5}\)).
Матерія, що зазнає хімічних реакцій і фізичних змін, може виділяти або поглинати тепло. Зміна, що виділяє тепло, називається екзотермічним процесом. Наприклад, реакція горіння, яка виникає при використанні оксиацетиленового факела, є екзотермічним процесом - цей процес також вивільняє енергію у вигляді світла, про що свідчить полум'я факела (рис.\(\PageIndex{6a}\)). Реакція або зміна, що поглинає тепло, - це ендотермічний процес. Холодний пакет, який використовується для лікування м'язових напружень, є прикладом ендотермічного процесу. Коли речовини в холодній упаковці (вода і сіль на кшталт аміачної селітри) зближуються, отриманий процес поглинає тепло, приводячи до відчуття холоду.

Вимірювання енергії та теплоємності
Історично енергія вимірювалася в одиницях калорій (кал). Калорійність - це кількість енергії, необхідне для підняття одного грама води на 1 градус С (1 кельвін). Однак ця величина залежить від атмосферного тиску і стартової температури води. Легкість вимірювання енергетичних змін калорій означало, що калорійність все ще часто використовується. Калорійність (з великої літери C), або велика калорія, зазвичай використовується для кількісного визначення вмісту енергії в їжі, є кілокалорією. Одиницею SI тепла, роботи та енергії є джоуль. Джоуль (J) визначається як кількість енергії, яка використовується, коли сила 1 ньютон рухає об'єкт на 1 метр. Названий він на честь англійського фізика Джеймса Прескотта Джоуля. Один джоуль еквівалентний 1 кг м 2 /с 2, який також називають 1 ньютон-метр. Кілоджоуль (кДж) дорівнює 1000 джоулів. Щоб стандартизувати його визначення, 1 калорія була встановлена рівною 4,184 джоуля.
Тепер ми введемо два поняття, корисні при описі теплового потоку і зміни температури. Теплоємність (С) тіла речовини - це кількість тепла (q), яке воно поглинає або виділяє, коли зазнає зміни температури (Δ T) на 1 градус Цельсія (або еквівалентно 1 кельвін)
\[C=\dfrac{q}{ΔT} \label{5.2.1} \]
Теплоємність визначається як типом, так і кількістю речовини, яке поглинає або виділяє тепло. Тому це велика властивість - його вартість пропорційна кількості речовини.
Для прикладу розглянемо теплоємності двох чавунних сковорідок. Теплоємність великої каструлі в п'ять разів більша, ніж у маленької каструлі, оскільки, хоча обидва зроблені з одного матеріалу, маса великої каструлі в п'ять разів перевищує масу маленької каструлі. Більша маса означає, що в більшій каструлі присутня більше атомів, тому потрібно більше енергії, щоб змусити всі ці атоми вібрувати швидше. Теплоємність невеликої чавунної сковороди знаходять, спостерігаючи, що для підвищення температури сковороди на 50,0° C потрібно 18 150 Дж енергії.
\[C_{\text{small pan}}=\mathrm{\dfrac{18,140\; J}{50.0\; °C} =363\; J/°C} \label{5.2.2} \]
Більша чавунна сковорода, виготовлена з тієї ж речовини, вимагає 90 700 Дж енергії для підвищення її температури на 50.0° C. більша сковорода має (пропорційно) більшу теплоємність, оскільки більша кількість матеріалу вимагає (пропорційно) більшої кількості енергії для отримання тієї ж температури зміна:
\[C_{\text{large pan}}=\mathrm{\dfrac{90,700\; J}{50.0\;°C}=1814\; J/°C} \label{5.2.3} \]
Питома теплоємність (с) речовини, яку прийнято називати його «питомою теплотою», - це кількість тепла, необхідне для підвищення температури 1 грама речовини на 1 градус Цельсія (або 1 кельвін):
\[c = \dfrac{q}{\mathrm{m\Delta T}} \label{5.2.4} \]
Питома теплоємність залежить тільки від виду речовини, що поглинає або виділяє тепло. Це інтенсивне властивість - тип, але не кількість речовини - це все, що має значення. Наприклад, невелика чавунна сковорода має масу 808 м Питома теплоємність заліза (матеріал, який використовується для виготовлення сковороди), тому:
\[c_\ce{iron}=\mathrm{\dfrac{18,140\; J}{(808\; g)(50.0\;°C)} = 0.449\; J/g\; °C} \label{5.2.5} \]
Велика сковорода має масу 4040 м Використовуючи дані для цієї сковороди, ми також можемо розрахувати питому теплоємність заліза:
\[c_\ce{iron}=\mathrm{\dfrac{90,700\; J}{(4,040\; g)(50.0\;°C)}=0.449\; J/g\; °C} \label{5.2.6} \]
Хоча велика каструля більш масивна, ніж маленька каструля, так як обидві зроблені з одного матеріалу, вони обидва дають однакове значення для питомої теплоти (для матеріалу будівництва, заліза). Відзначимо, що питома теплоємність вимірюється в одиницях енергії на температуру на масу і є інтенсивним властивістю, що отримується від співвідношення двох великих властивостей (теплоти і маси). Молярна теплоємність, також інтенсивне властивість, є теплоємністю на моль тієї чи іншої речовини і має одиниці Дж/моль °C (рис.\(\PageIndex{7}\)).

Рідка вода має відносно високу питому теплоємність (близько 4,2 Дж/г° C); більшість металів мають набагато менші питомі нагрівання (зазвичай менше 1 Дж/г° C). Питома теплоємність речовини дещо змінюється в залежності від температури. Однак ця варіація, як правило, досить мала, що ми будемо розглядати питому теплоту як постійну в діапазоні температур, які будуть розглянуті в цьому розділі. Питомі тепловиділення деяких поширених речовин наведені в табл\(\PageIndex{1}\).
| Речовина | Символ (стан) | Питома теплота (Дж/г° C) |
|---|---|---|
| гелій | Він (г) | 5.193 |
| вода | Н 2 О (л) | 4.184 |
| етанолу | С 2 Н 6 О (л) | 2.376 |
| лід | Н 2 О (с) | 2.093 (при −10 °C) |
| водяна пара | Н 2 О (г) | 1,864 |
| азоту | N 2 (г) | 1.040 |
| повітря | 1.007 | |
| кисень | О 2 (г) | 0,918 |
| алюміній | Аль (и) | 0,897 |
| вуглекислий газ | СО 2 (г) | 0,853 |
| аргон | Ар (г) | 0.522 |
| залізо | Плата (и) | 0,449 |
| мідь | Cu (и) | 0,385 |
| свинець | Пб (и) | 0.130 |
| золото | Au (и) | 0.129 |
| кремній | Сі (и) | 0,712 |
Якщо ми знаємо масу речовини та її питому теплоту, ми можемо визначити кількість тепла, q, що надходить або залишає речовину, вимірюючи зміну температури до і після отримання або втрати тепла:
\[\begin{align*} q &= \ce{(specific\: heat)×(mass\: of\: substance)×(temperature\: change)}\label{5.2.7}\\q&=c×m×ΔT \\[4pt] &=c×m×(T_\ce{final}−T_\ce{initial})\end{align*} \]
У цьому рівнянні\(c\) - питома теплоємність речовини, m - його маса, а Δ T (що читається «дельта Т») - зміна температури, T кінцева − T початкова. Якщо речовина отримує теплову енергію, її температура зростає, її кінцева температура вище початкової температури, T final − T початкова має позитивне значення, а значення q - позитивне. Якщо речовина втрачає теплову енергію, її температура знижується, кінцева температура нижча за початкову, T final − T початкова має негативне значення, а значення q - від'ємне.
Колбу, що містить\(\mathrm{8.0 \times 10^2\; g}\) воду, нагрівають, і температура води збільшується з 21 °С до 85 °С.
Рішення
Щоб відповісти на це питання, розглянемо такі фактори:
- питома теплоємність нагрівається речовини (в даному випадку води)
- кількість нагрівається речовини (в даному випадку 800 г)
- величина зміни температури (в даному випадку від 21° C до 85° C).
Питома теплота води становить 4,184 Дж/г °C, тому для нагрівання 1 г води на 1° C потрібно 4,184 Дж. Ми зауважимо, що оскільки 4,184 Дж потрібно нагріти 1 г води на 1° C, нам знадобиться 800 разів більше, щоб нагріти 800 г води на 1° C Нарешті, ми спостерігаємо, що оскільки 4.184 Дж потрібно нагріти 1 г води на 1° C, ми знадобиться в 64 рази більше, щоб нагріти його на 64° C (тобто від 21° C до 85° C).
Це можна підсумувати за допомогою рівняння:
\[\begin{align*} q&=c×m×ΔT \\[4pt] &=c×m×(T_\ce{final}−T_\ce{initial}) \\[4pt] &=\mathrm{(4.184\:J/\cancel{g}°C)×(800\:\cancel{g})×(85−21)°C}\\[4pt] &=\mathrm{(4.184\:J/\cancel{g}°\cancel{C})×(800\:\cancel{g})×(64)°\cancel{C}}\\[4pt] &=\mathrm{210,000\: J(=210\: kJ)} \end{align*} \nonumber \]
Оскільки температура підвищилася, вода поглинає тепло і\(q\) є позитивним.
Скільки тепла в джоулі потрібно додавати в\(\mathrm{5.00 \times 10^2 \;g}\) залізну сковороду, щоб збільшити її температуру з 25° C до 250° C? Питома теплоємність заліза становить 0,451 Дж/г° С.
Відповідь-
\(\mathrm{5.05 \times 10^4\; J}\)
Зверніть увагу, що залежність між теплотою, питомою теплотою, масою та зміною температури може бути використана для визначення будь-якої з цих величин (не тільки тепла), якщо інші три відомі або можуть бути виведені.
Шматок невідомого металу важить 348 г Коли металевий шматок поглинає 6,64 кДж тепла, його температура збільшується з 22,4° C до 43,6° C. Визначте питому теплоємність цього металу (що може дати підказку до його ідентичності).
Рішення
Оскільки для цього металу відомі зміни маси, тепла та температури, ми можемо визначити його питому теплоємність, використовуючи співвідношення:
\[\begin{align*} q&=c \times m \times \Delta T \\[4pt] &=c \times m \times (T_\ce{final}−T_\ce{initial}) \end{align*} \nonumber \]
Підставляємо відомі значення:
\[6,640\; \ce J=c \times \mathrm{(348\; g) \times (43.6 − 22.4)\; °C} \nonumber \]
Рішення:
\[c=\mathrm{\dfrac{6,640\; J}{(348\; g) \times (21.2°C)} =0.900\; J/g\; °C} \nonumber \]
Порівнюючи це значення зі значеннями в табл.\(\PageIndex{1}\), ця величина відповідає питомої теплоємності алюмінію, що говорить про те, що невідомим металом може бути алюміній.
Шматок невідомого металу важить 217 г Коли металевий шматок поглинає 1,43 кДж тепла, його температура збільшується з 24,5 °С до 39,1 °С. Визначають питому теплоємність цього металу та прогнозують його ідентичність.
- Відповідь
-
\(c = \mathrm{0.45 \;J/g \;°C}\); метал, швидше за все, буде залізом від перевірки таблиці\(\PageIndex{1}\).
Сонячні теплові електростанції
Сонячне світло, яке досягає землі, містить в тисячі разів більше енергії, ніж ми зараз захоплюємо. Сонячні теплові системи забезпечують одне можливе рішення проблеми перетворення енергії сонця в енергію, яку ми можемо використовувати. Великі сонячні теплові установки мають різну специфіку конструкції, але всі концентрують сонячне світло для нагрівання певної речовини; тепло, «накопичене» в цій речовині, потім перетворюється в електрику.
Генеруюча станція Солана в пустелі Сонора в Арізоні виробляє 280 мегават електроенергії. Тут використовуються параболічні дзеркала, які фокусують сонячне світло на трубах, заповнених теплоносієм (HTF) (рис.\(\PageIndex{8}\)). Потім HTF робить дві речі: перетворює воду в пару, яка обертає турбіни, яка, в свою чергу, виробляє електроенергію, і вона плавиться і нагріває суміш солей, яка функціонує як система накопичення теплової енергії. Після того, як сонце заходить, розплавлена сольова суміш може потім вивільнити достатню кількість накопиченого тепла для отримання пари для запуску турбін протягом 6 годин. Розплавлені солі використовуються тому, що вони володіють рядом корисних властивостей, серед яких високі теплоємності і теплопровідність.

377-мегаватна сонячна генеруюча система Іванпа, розташована в пустелі Мохаве в Каліфорнії, є найбільшою сонячною тепловою електростанцією в світі (рис.\(\PageIndex{9}\)). Його 170 000 дзеркал зосереджують величезну кількість сонячного світла на трьох наповнених водою вежах, виробляючи пар при температурі понад 538° C, що приводить в дію турбіни, що виробляють електроенергію. Він виробляє достатньо енергії для живлення 140 000 будинків. Вода використовується в якості робочої рідини через її великої теплоємності і теплоти випаровування.

Резюме
Енергія - це здатність виконувати роботу (застосовуючи силу для переміщення матерії). Кінетична енергія (КЕ) - енергія руху; потенційна енергія - енергія, обумовлена відносним положенням, складом або умовою. Коли енергія перетворюється з однієї форми в іншу, енергія не створюється і не руйнується (закон збереження енергії або перший закон термодинаміки). Матерія має теплову енергію завдяки КЕ своїх молекул і температурі, яка відповідає середньому КЕ її молекул. Тепло - це енергія, яка передається між об'єктами при різних температурах; вона перетікає від високої до низької температури. Хімічні та фізичні процеси можуть поглинати тепло (ендотермічні) або виділяти тепло (екзотермічне). Одиницею СІ енергії, тепла і роботи є джоуль (Дж). Питома теплоємність і теплоємність - це заходи енергії, необхідної для зміни температури речовини або об'єкта. Кількість тепла, що поглинається або виділяється речовиною, безпосередньо залежить від виду речовини, його маси і зміни температури, яке воно зазнає.
Ключові рівняння
- \(q=c×m×ΔT=c×m×(T_\ce{final}−T_\ce{initial})\)
Глосарій
- калорійність (кал)
- одиниця теплової або іншої енергії; кількість енергії, необхідної для підняття 1 грама води на 1 градус Цельсія; 1 кал визначається як 4,184 Дж
- ендотермічний процес
- хімічна реакція або фізичні зміни, які поглинають тепло
- енергетика
- потужність для подачі тепла або виконання робіт
- екзотермічний процес
- хімічна реакція або фізичні зміни, які виділяють тепло
- тепло (q)
- передача теплової енергії між двома тілами
- теплоємність (С)
- велика властивість тіла речовини, що представляє кількість тепла, необхідне для підвищення його температури на 1 градус Цельсія (або 1 кельвін)
- джоуль (Дж)
- СІ одиниця енергії; 1 джоуль - кінетична енергія об'єкта з масою 2 кілограми, що рухається зі швидкістю 1 метр в секунду, 1 Дж = 1 кг м 2 /с і 4,184 Дж = 1 кал
- кінетична енергія
- енергія рухомого тіла, в джоулі, дорівнює\(\dfrac{1}{2}mv^2\) (де m = маса і v = швидкість)
- потенційна енергія
- енергія частинки або системи частинок, отриманих від відносного положення, складу або умови
- питома теплоємність (с)
- інтенсивне властивість речовини, що представляє кількість тепла, необхідне для підвищення температури 1 грама речовини на 1 градус Цельсія (або 1 кельвін)
- температура
- інтенсивне властивість матерії, яка є кількісним показником «гарячості» і «холодності»
- теплова енергія
- кінетична енергія, пов'язана з випадковим рухом атомів і молекул
- термохімія
- дослідження вимірювання кількості тепла, поглиненого або виділеного під час хімічної реакції або фізичної зміни
- робота (ж)
- передача енергії через зміни зовнішніх макроскопічних змінних, таких як тиск і об'єм; або змушуючи речовину рухатися проти протилежної сили
