4.2: Класифікація хімічних реакцій
- Page ID
- 22796
- Визначте три загальні типи хімічних реакцій (осадження, кислотно-лужні та окислювально-відновні)
- Класифікувати хімічні реакції як один з цих трьох типів з урахуванням відповідних описів або хімічних рівнянь
- Визначте загальні кислоти та основи
- Прогнозувати розчинність звичайних неорганічних сполук за допомогою правил розчинності
- Обчислити стани окислення елементів у сполуках
Люди взаємодіють один з одним різними і складними способами, і ми класифікуємо ці взаємодії відповідно до загальних моделей поведінки. Коли двоє людей обмінюються інформацією, ми говоримо, що вони спілкуються. Коли вони обмінюються ударами кулаками або ногами, ми говоримо, що вони б'ються. Зіткнувшись з широким спектром різноманітних взаємодій між хімічними речовинами, вчені також вважали зручним (або навіть необхідним) класифікувати хімічні взаємодії шляхом виявлення загальних закономірностей реактивності. Цей модуль забезпечить ознайомлення з трьома найбільш поширеними типами хімічних реакцій: осадження, кислотно-лужної та окислювально-відновної.
Реакції опадів та правила розчинності
Реакція опадів - це реакція, при якій розчинені речовини реагують з утворенням одного (або декількох) твердих продуктів. Багато реакцій цього типу передбачають обмін іонами між іонними сполуками у водному розчині і іноді їх називають реакціями подвійного зміщення, подвійного заміщення або метатези. Ці реакції є загальними в природі і відповідають за утворення коралових рифів у водах океану та каменів у нирок у тварин. Вони широко використовуються в промисловості для виробництва ряду товарних і спеціальних хімічних речовин. Реакції опадів також відіграють центральну роль у багатьох методах хімічного аналізу, включаючи точкові тести, що використовуються для ідентифікації іонів металів, і гравіметричні методи визначення складу речовини (див. Останній модуль цієї глави).
Ступінь, в якій речовина може бути розчинена у воді, або будь-якому розчиннику, кількісно виражається як його розчинність, визначена як максимальна концентрація речовини, яка може бути досягнута за певних умов. Кажуть, що речовини з відносно великими розчинними речовинами. Речовина випаде в осад, коли умови розчину такі, що його концентрація перевищує його розчинність. Речовини з відносно низькою розчинністю, як кажуть, є нерозчинними, і це ті речовини, які легко випадають в осад з розчину. Більше інформації про ці важливі поняття наведено в текстовому розділі про рішення. З метою прогнозування ідентичності твердих тіл, утворених реакціями опадів, можна просто звернутися до закономірностей розчинності, які спостерігалися для багатьох іонних сполук (табл.\(\PageIndex{1}\)).
| Розчинні сполуки містять | Винятки з цих правил розчинності включають |
|
|
| Нерозчинні сполуки містять | Винятки з цих правил нерозчинності включають |
|
|
Яскравий приклад опадів спостерігається при змішуванні розчинів йодистого калію і нітрату свинцю, в результаті чого утворюється твердий йодид свинцю:
\[\ce{2KI}(aq)+\ce{Pb(NO3)2}(aq)\rightarrow \ce{PbI2}(s)+\ce{2KNO3}(aq) \nonumber \]
Це спостереження відповідає рекомендаціям щодо розчинності: єдиною нерозчинною сполукою серед усіх учасників є йодид свинцю, один із винятків із загальної розчинності йодидних солей.
Чисте іонне рівняння, що представляє цю реакцію, таке:
\[\ce{Pb^2+}(aq)+\ce{2I-}(aq)\rightarrow \ce{PbI2}(s) \nonumber \]
Йодид свинцю - яскраво-жовта тверда речовина, яка раніше використовувалася як пігмент художника, відомий як йод жовтий (рис.\(\PageIndex{1}\)). Властивості чистих кристалів PBi 2 роблять їх корисними для виготовлення детекторів рентгенівських і гамма-променів.

Рекомендації щодо розчинності в таблиці\(\PageIndex{1}\) можуть бути використані для прогнозування того, чи відбудеться реакція осадження при змішуванні розчинних іонних сполук. Потрібно лише визначити всі іони, присутні в розчині, а потім розглянути, чи можливе сполучення катіон/аніонів може призвести до нерозчинної сполуки. Наприклад, змішування розчинів нітрату срібла та фториду натрію дасть розчин, що містить іони Ag +\(\ce{NO3-}\), Na + та F −. Окрім двох іонних сполук, спочатку присутніх у розчині, AgNO 3 та NaF, з цієї колекції іонів можуть бути отримані дві додаткові іонні сполуки: NaNo 3 та AgF. Рекомендації щодо розчинності вказують, що всі нітратні солі розчинні, але що AgF є одним із винятків із загальної розчинності солей фтору. Отже, прогнозується, що відбудеться реакція опадів, як описано наступними рівняннями:
\[\ce{NaF}(aq)+\ce{AgNO3}(aq)\rightarrow \ce{AgF}(s)+\ce{NaNO3}(aq)\hspace{20px}\ce{(molecular)} \nonumber \]
\[\ce{Ag+}(aq)+\ce{F-}(aq)\rightarrow \ce{AgF}(s)\hspace{20px}\ce{(net\: ionic)} \nonumber \]
Прогнозують результат змішування розумно концентрованих розчинів наступних іонних сполук. Якщо очікується випадання опадів, запишіть збалансоване чисте іонне рівняння для реакції.
- сульфат калію і нітрат барію
- хлорид літію і ацетат срібла
- нітрат свинцю і карбонат амонію
Рішення
(a) Два можливі продукти для цієї комбінації - KNO 3 та BasO 4. Рекомендації щодо розчинності вказують на те, що BaSO 4 нерозчинний, і тому очікується реакція опадів. Чисте іонне рівняння для цієї реакції, виведене способом, деталізованим у попередньому модулі, становить
\[\ce{Ba^2+}(aq)+\ce{SO4^2-}(aq)\rightarrow \ce{BaSO4}(s) \nonumber \]
(b) Два можливі продукти для цієї комбінації - це LiC 2 H 3 O 2 та AgCl. Рекомендації щодо розчинності вказують на те, що AgCl нерозчинний, і тому очікується реакція опадів. Чисте іонне рівняння для цієї реакції, виведене способом, деталізованим у попередньому модулі, становить
\[\ce{Ag+}(aq)+\ce{Cl-}(aq)\rightarrow \ce{AgCl}(s) \nonumber \]
(c) Два можливі продукти для цієї комбінації - PbCo 3 та NH 4 NO 3. Рекомендації щодо розчинності вказують, що PbCo 3 нерозчинний, і тому очікується реакція опадів. Чисте іонне рівняння для цієї реакції, виведене способом, деталізованим у попередньому модулі, становить
\[\ce{Pb^2+}(aq)+\ce{CO3^2-}(aq)\rightarrow \ce{PbCO3}(s) \nonumber \]
Який розчин можна використовувати для осадження іона барію, Ba 2 +, у зразку води: хлорид натрію, гідроксид натрію або сульфат натрію? Яка формула передбачуваного осаду?
- Відповідь
-
сульфат натрію, BasO 4
Кислотно-лужна реакція
Кислотно-лужна реакція - це та, при якій іон водню, Н +, переноситься від одного хімічного виду до іншого. Такі реакції мають центральне значення для численних природних і технологічних процесів, починаючи від хімічних перетворень, що відбуваються всередині клітин, озер і океанів, до промислового виробництва добрив, фармацевтичних препаратів та інших речовин, необхідних для суспільства. Тема кислотно-лужної хімії, отже, гідна ретельного обговорення, а повна глава присвячена цій темі далі в тексті.
Для цілей цього короткого вступу розглянемо лише більш поширені види кислотно-лужних реакцій, які протікають у водних розчині. У цьому контексті кислота - це речовина, яка розчиняється у воді з утворенням іонів водню, H 3 O +. Як приклад розглянемо наведене тут рівняння:
\[\ce{HCl}(aq)+\ce{H2O}(aq)\rightarrow \ce{Cl-}(aq)+\ce{H3O+}(aq) \nonumber \]
Процес, представлений цим рівнянням, підтверджує, що хлористий водень є кислотою. При розчиненні у воді іони Н 3 О + виробляються хімічною реакцією, в якій іони Н + переносяться з молекул HCl в молекули Н 2 О (рис.\(\PageIndex{2}\)).
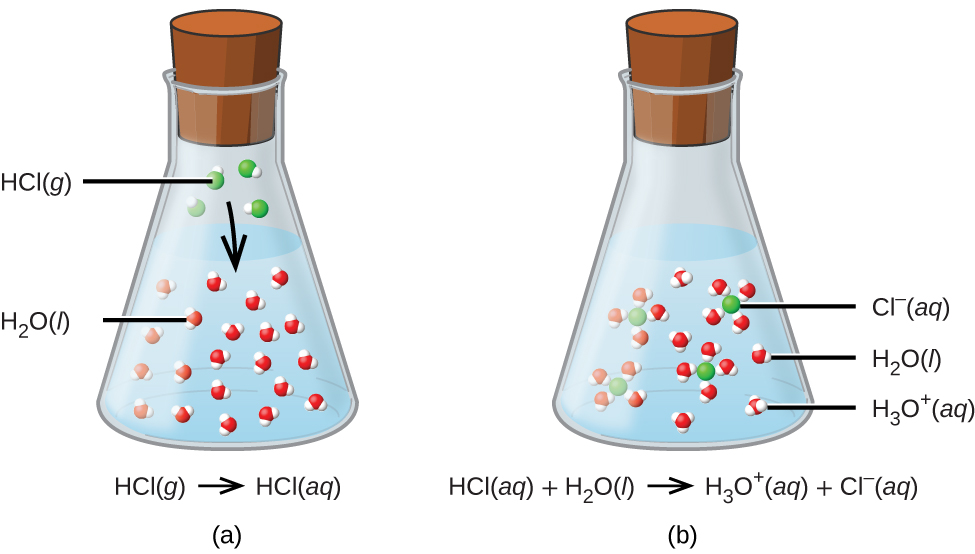
Природа HCl така, що його реакція з водою, як тільки що описано, є по суті 100% ефективною: практично кожна молекула HCl, яка розчиняється у воді, зазнає цієї реакції. Кислоти, які повністю реагують таким чином, називаються сильними кислотами, а HCl є однією лише жменькою поширених кислотних сполук, які класифікуються як сильні (табл.\(\PageIndex{1}\)). Набагато більша кількість сполук поводиться як слабкі кислоти і лише частково реагує з водою, залишаючи переважну більшість розчинених молекул у первісному вигляді і генеруючи відносно невелику кількість іонів гідронію. Слабкі кислоти зазвичай зустрічаються в природі, будучи речовинами, частково відповідальними за гострий смак цитрусових, відчуття укусів комах і неприємні запахи, пов'язані з запахом тіла. Знайомий приклад слабкої кислоти - оцтова кислота, основний інгредієнт харчових оцтів:
\[\ce{CH3CO2H}(aq)+\ce{H2O}(l)\rightleftharpoons \ce{CH3CO2-}(aq)+\ce{H3O+}(aq) \nonumber \]
При розчиненні у воді в типових умовах тільки близько 1% молекул оцтової кислоти присутній в іонізованому вигляді,\(\ce{CH3CO2-}\) (рис.\(\PageIndex{3}\)). (Використання подвійної стрілки в рівнянні вище позначає частковий аспект реакції цього процесу, концепція повністю розглянута в главах про хімічну рівновагу.)
| Формула з'єднання | Назва у водному розчині |
|---|---|
| HBr | бромна кислота |
| HCl | соляна кислота |
| ПРИВІТ | воднева кислота |
| HNO 3 | азотна кислота |
| ХЛО 4 | хлористої кислоти |
| Н 2 ТАК 4 | сірчана кислота |
Основа - це речовина, яка розчиняється у воді з утворенням гідроксидних іонів, ОН −. Найбільш поширеними основами є іонні сполуки, що складаються з катіонів лужних або лужноземельних металів (групи 1 і 2), поєднаних з гідроксидним іоном - наприклад, NaOH і Ca (OH) 2. Коли ці сполуки розчиняються у воді, гідроксидні іони виділяються безпосередньо в розчин. Наприклад, KOH і Ba (OH) 2 розчиняються у воді і повністю дисоціюють з утворенням катіонів (K + і Ba 2 + відповідно) та гідроксидних іонів, OH −. Ці підстави поряд з іншими гідроксидами, які повністю дисоціюють у воді, вважаються міцними підставами.
Розглянемо як приклад розчинення лугу (гідроксиду натрію) у воді:
\[\ce{NaOH}(s)\rightarrow \ce{Na+}(aq)+\ce{OH-}(aq) \nonumber \]
Це рівняння підтверджує, що гідроксид натрію є основою. При розчиненні у воді NaOH дисоціює з утворенням іонів Na + і OH −. Це справедливо і для будь-якого іншого іонного з'єднання, що містить гідроксидні іони. Оскільки процес дисоціації по суті завершений, коли іонні сполуки розчиняються у воді в типових умовах, NaOH та інші іонні гідроксиди класифікуються як міцні основи.
На відміну від іонних гідроксидів, деякі сполуки виробляють гідроксид-іони при розчиненні шляхом хімічної реакції з молекулами води. У всіх випадках ці сполуки вступають в реакцію лише частково і тому класифікуються як слабкі підстави. Ці типи сполук також рясні в природі і важливі товари в різних технологіях. Наприклад, світове виробництво слабкої основи аміаку, як правило, значно перевищує 100 метричних тонн щорічно, широко використовується як сільськогосподарське добриво, сировина для хімічного синтезу інших сполук і активний інгредієнт в побутових очисниках (рис.\(\PageIndex{4}\)). При розчиненні у воді аміак частково реагує на вихід гідроксидних іонів, як показано тут:
\[\ce{NH3}(aq)+\ce{H2O}(l)\rightleftharpoons \ce{NH4+}(aq)+\ce{OH-}(aq) \nonumber \]
Це, за визначенням, кислотно-лужна реакція, в даному випадку пов'язана з перенесенням іонів Н + від молекул води до молекул аміаку. У типових умовах у вигляді\(\ce{NH4+}\) іонів присутній лише близько 1% розчиненого аміаку.

Описані хімічні реакції, при яких кислоти і основи, розчинені у воді, виробляють іони водню і гідроксиду, відповідно, є, за визначенням, кислотно-лужними реакціями. У цих реакціях вода служить і розчинником, і реагентом. Реакція нейтралізації - це специфічний тип кислотно-лужної реакції, при якій реагентами є кислота і основа, продуктами часто є сіль і вода, і жоден реагент не є сама вода:
\[\mathrm{acid+base\rightarrow salt+water} \nonumber \]
Щоб проілюструвати реакцію нейтралізації, розглянемо, що відбувається, коли звичайний антацид, такий як молоко магнезії (водна суспензія твердого Mg (OH) 2), потрапляє всередину, щоб полегшити симптоми, пов'язані з надлишком шлункової кислоти (HCl):
\[\ce{Mg(OH)2}(s)+\ce{2HCl}(aq)\rightarrow \ce{MgCl2}(aq)+\ce{2H2O}(l). \nonumber \]
Відзначимо, що крім води, цю реакцію виробляє сіль, хлорид магнію.
Напишіть збалансовані хімічні рівняння для кислотно-лужних реакцій, описаних тут:
- слабкокислий гіпохлорит водню реагує з водою
- розчин гідроксиду барію нейтралізують розчином азотної кислоти
Рішення
(а) Передбачено два реагенти, HoCl та H 2 O. Оскільки речовина, як повідомляється, є кислотою, її реакція з водою передбачає перенесення H + від HoCl до H 2 O для утворення іонів гідронію, H 3 O + та іонів гіпохлориту, OCl - .
\[\ce{HOCl}(aq)+\ce{H2O}(l)\rightleftharpoons \ce{OCl-}(aq)+\ce{H3O+}(aq) \nonumber \]
У цьому рівнянні доречна подвійна стрілка, оскільки вона вказує на те, що HoCl - це слабка кислота, яка не відреагувала повністю.
(b) Передбачені два реагенти, Ba (OH) 2 та HNO 3. Оскільки це реакція нейтралізації, двома продуктами будуть вода та сіль, що складається з катіону іонного гідроксиду (Ba 2 +) та аніону, що утворюється, коли кислота переносить свій іон водню\(\ce{(NO3- )}\).
\[\ce{Ba(OH)2}(aq)+\ce{2HNO3}(aq)\rightarrow \ce{Ba(NO3)2}(aq)+\ce{2H2O}(l) \nonumber \]
Напишіть чисте іонне рівняння, що представляє нейтралізацію будь-якої сильної кислоти іонним гідроксидом. (Підказка: Враховуйте іони, що утворюються при розчиненні сильної кислоти у воді.)
- Відповідь
-
\[\ce{H3O+}(aq)+\ce{OH-}(aq)\rightarrow \ce{2H2O}(l) \nonumber \]
Дослідіть мікроскопічний вигляд сильних і слабких кислот і підстав.
Окислювально-відновні реакції
Атмосфера Землі містить близько 20% молекулярного кисню, O 2, хімічно реактивного газу, який відіграє важливу роль в метаболізмі аеробних організмів і в багатьох екологічних процесах, що формують світ. Термін окислення спочатку використовувався для опису хімічних реакцій за участю O 2, але його значення еволюціонувало для позначення широкого та важливого класу реакцій, відомого як окислювально-відновні (окислювально-відновні) реакції. Кілька прикладів таких реакцій будуть використані для вироблення чіткої картини цієї класифікації.
Деякі окислювально-відновні реакції включають перенесення електронів між видами реагентів для отримання іонних продуктів, таких як реакція між натрієм та хлором з отриманням хлориду натрію:
\[\ce{2Na}(s)+\ce{Cl2}(g)\rightarrow \ce{2NaCl}(s) \nonumber \]
Корисно розглядати процес стосовно кожного окремого реагенту, тобто представляти долю кожного реагенту у вигляді рівняння, званого напівреакцією:
\[ \begin{align*} \ce{2Na}(s) &\rightarrow \ce{2Na+}(s)+\ce{2e-} \\[4pt] \ce{Cl2}(g)+\ce{2e-} &\rightarrow \ce{2Cl-}(s) \end{align*} \nonumber \]
Ці рівняння показують, що атоми Na втрачають електрони, тоді як атоми Cl (у молекулі Cl 2) отримують електрони, «s» індекси для отриманих іонів, що означають, що вони присутні у вигляді твердого іонного з'єднання. Для окислювально-відновних реакцій такого роду втрати і посилення електронів визначають взаємодоповнюючі процеси, що відбуваються:
\ (\ begin {вирівнювання}
\ textbf {окислення} &=\ textrm {втрата електронів}
\\ textbf {зменшення} &=\ textrm {посилення електронів}
\ end {вирівнювання}\)
У цій реакції, потім, натрій окислюється і хлор піддається відновленню. Розглядаючи з більш активної точки зору, натрій функціонує як відновник (відновник), оскільки забезпечує електрони (або зменшує) хлор. Так само хлор функціонує як окислювач (окислювач), оскільки ефективно видаляє електрони з (окислює) натрію.
\ (\ begin {align}
\ textbf {відновник} &=\ textrm {види, що окислюються}\
\ textbf {окислювач} &=\ textrm {види, які зменшуються}
\ end {вирівнювання}\)
Деякі окислювально-відновні процеси, однак, не передбачають перенесення електронів. Розглянемо, наприклад, реакцію, схожу на ту, що дає\(\ce{NaCl}\):
\[\ce{H2}(g)+\ce{Cl2}(g)\rightarrow \ce{2HCl}(g) \nonumber \]
Продукт цієї реакції - ковалентне з'єднання, тому перенесення електронів в явному сенсі не бере участі. Щоб уточнити схожість цієї реакції з попередньою і дозволити однозначне визначення окислювально-відновних реакцій, визначено властивість, зване окислювальним числом. Число окислення (або ступінь окислення) елемента в сполуці - це заряд, який його атоми мали б, якби сполука була іонною. Наступні вказівки використовуються для присвоєння чисел окислення кожному елементу в молекулі або іоні.
- Число окислення атома в елементарній речовині дорівнює нулю.
- Число окислення одноатомного іона дорівнює заряду іона.
- Номери окислення для поширених неметалів зазвичай присвоюються наступним чином:
- Водень: +1 при поєднанні з неметалами, −1 при поєднанні з металами
- Кисень: −2 у більшості сполук, іноді −1 (так звані пероксиди,\(\ce{O2^2-}\)), дуже рідко\(-\dfrac{1}{2}\) (так звані супероксиди,\(\ce{O2-}\)), позитивні значення при поєднанні з F (значення змінюються)
- Галогени: −1 для F завжди, −1 для інших галогенів, за винятком комбінації з киснем або іншими галогенами (позитивні числа окислення в цих випадках, різні значення)
- Сума чисел окислення для всіх атомів молекули або багатоатомного іона дорівнює заряду на молекулі або іоні.
Примітка: Правильна умова для звітного заряду полягає в тому, щоб спочатку написати номер, а потім знак (наприклад, 2+), тоді як номер окислення записується із зворотною послідовністю, за знаком слідує номер (наприклад, +2). Ця конвенція має на меті підкреслити різницю між цими двома пов'язаними властивостями.
Дотримуйтесь вказівок у цьому розділі тексту, щоб призначити номери окислення всім елементам наступних видів:
- Н 2 С
- \(\ce{SO3^2-}\)
- Na 2 СО 4
Рішення
(а) Відповідно до керівного принципу 1, число окислення для Н становить +1.
Використовуючи це число окислення та формулу сполуки, настанова 4 може бути використана для обчислення числа окислення сірки:
\(\ce{charge\: on\: H2S}=0=(2\times +1)+(1\times x)\)
\(x=0-(2\times +1)=-2\)
(b) Рекомендація 3 передбачає, що число окислення кисню становить −2.
Використовуючи це число окислення та формулу іона, настанова 4 може бути використана для обчислення числа окислення сірки:
\(\ce{charge\: on\: SO3^2-}=-2=(3\times -2)+(1\times x)\)
\(x=-2-(3\times -2)=+4\)
(c) Для іонних сполук зручно призначати номери окислення для катіону та аніону окремо.
Згідно з керівництвом 2, число окислення для натрію дорівнює +1.
Припускаючи звичайне число окислення для кисню (−2 за вказівним принципом 3), число окислення сірки розраховується відповідно до вказівок 4:
\(x=-2-(4\times -2)=+6\)
Призначте стану окислення елементам, атоми яких підкреслені в кожному з наступних з'єднань або іонів:
- К Н О 3
- Аль Н 3
- \(\mathrm{\underline{N}H_4^+}\)
- \(\mathrm{\sideset{ }{_{\large{4}}^{-}}{H_2\underline{P}O}}\)
- Відповідь на
-
П, +5
- Відповідь б
-
Аль, +3
- Відповідь c
-
П, −3
- Відповідь d
-
Р, +5
Використовуючи концепцію окислювальних чисел, встановлено всеохоплююче визначення окислювально-відновної реакції. Окислювально-відновні (окислювально-відновні) реакції - це ті, в яких один або кілька задіяних елементів піддаються зміні числа окислення. Хоча переважна більшість окислювально-відновних реакцій включають зміни числа окислення для двох або більше елементів, існує кілька цікавих винятків з цього правила, як показано нижче\). Визначення взаємодоповнюючих процесів цього класу реакції відповідно переглядаються, як показано тут:
\ [\ begin {вирівнювання}
\ textbf {окислення} &=\ textrm {збільшення числа окислення}\
\ textbf {скорочення} &=\ textrm {зменшення числа окислення}
\ end {вирівнювання}\ nonumber\]
Повертаючись до реакцій, використовуваних для введення цієї теми, тепер вони обидва можуть бути ідентифіковані як окислювально-відновні процеси. У реакції між натрієм і хлором з отриманням хлориду натрію окислюється натрій (число його окислення збільшується з 0 в Na до +1 в NaCl) і зменшується хлор (число його окислення зменшується з 0 в Cl 2 до −1 в NaCl). У реакції між молекулярним воднем і хлором відбувається окислення водень (число його окислення збільшується з 0 в Н 2 до +1 в HCl) і знижується хлор (число його окислення зменшується з 0 в Cl 2 до −1 в HCl).
Розпізнано кілька підкласів окислювально-відновних реакцій, включаючи реакції горіння, в яких відновник (також званий паливом) і окислювач (часто, але не обов'язково, молекулярний кисень) енергійно реагують і виробляють значну кількість тепла, а часто і світла, у вигляді полум'я. Тверді ракетно-паливні реакції, такі як зображена нижче, є процесами горіння. Типова реакція палива, при якій твердий алюміній окислюється перхлоратом амонію, представлена таким рівнянням:
\[\ce{10Al}(s)+\ce{6NH4ClO4}(s)\rightarrow \ce{4Al2O3}(s)+\ce{2AlCl3}(s)+\ce{12H2O}(g)+\ce{3N2}(g) \nonumber \]
Перегляньте коротке відео, що демонструє тестову стрільбу маломасштабного, прототипу, гібридного ракетного двигуна, запланованого до використання в новій системі космічного запуску, що розробляється НАСА. Перші двигуни, що стріляють на 3 с (зелене полум'я), використовують рідку паливо/окислювальну суміш, а другі, більш потужні двигуни, що стріляють на 4 с (жовте полум'я), використовують тверду суміш.
Реакції одного зміщення (заміщення) - це окислювально-відновні реакції, в яких іон в розчині витісняється (або замінюється) шляхом окислення металевого елемента. Одним з поширених прикладів такого типу реакції є кислотне окислення деяких металів:
\[\ce{Zn}(s)+\ce{2HCl}(aq)\rightarrow \ce{ZnCl2}(aq)+\ce{H2}(g) \nonumber \]
Металеві елементи також можуть окислюватися розчинами інших солей металів; наприклад:
\[\ce{Cu}(s)+\ce{2AgNO3}(aq)\rightarrow \ce{Cu(NO3)2}(aq)+\ce{2Ag}(s) \nonumber \]
Таку реакцію можна спостерігати, помістивши мідний дріт в розчин, що містить розчинену сіль срібла. Іони срібла в розчині зводяться до елементарного срібла на поверхні мідного дроту, а отримані іони Cu 2+ розчиняються в розчині для отримання характерного синього кольору (рис.\(\PageIndex{4}\)).

Визначте, які рівняння представляють окислювально-відновні реакції, надаючи назву реакції, якщо це доречно. Для тих реакцій, ідентифікованих як окислювально-відновлювальні, назвіть окислювач і відновник.
- \(\ce{ZnCO3}(s)\rightarrow \ce{ZnO}(s)+\ce{CO2}(g)\)
- \(\ce{2Ga}(l)+\ce{3Br2}(l)\rightarrow \ce{2GaBr3}(s)\)
- \(\ce{2H2O2}(aq)\rightarrow \ce{2H2O}(l)+\ce{O2}(g)\)
- \(\ce{BaCl2}(aq)+\ce{K2SO4}(aq)\rightarrow \ce{BaSO4}(s)+\ce{2KCl}(aq)\)
- \(\ce{C2H4}(g)+\ce{3O2}(g)\rightarrow \ce{2CO2}(g)+\ce{2H2O}(l)\)
S рішення
Окислювально-відновні реакції ідентифікуються за визначенням, якщо один або кілька елементів зазнають зміни числа окислення.
- Це не окислювально-відновна реакція, так як числа окислення залишаються незмінними для всіх елементів.
- Це окислювально-відновна реакція. Галій окислюється, число його окислення збільшується з 0 в Ga (l) до +3 в GaBR 3 (s). Редукуючим агентом є Ga (л). Бром відновлюється, число його окислення зменшується з 0 в Br 2 (l) до −1 в GaBr 3 (s). Окислювачем є Br 2 (л).
- Це окислювально-відновна реакція. Це особливо цікавий процес, оскільки в ньому беруть участь один і той же елемент, кисень, що зазнає як окислення, так і відновлення (так звана реакція диспропорції). Кисень окислюється, число його окислення збільшується від −1 в H 2 O 2 (aq) до 0 в O 2 (g). Кисень також відновлюється, число його окислення зменшується від −1 в H 2 O 2 (aq) до −2 в H 2 O (l). Для реакцій диспропорції одна і та ж речовина функціонує як окислювач і відновник.
- Це не окислювально-відновна реакція, так як числа окислення залишаються незмінними для всіх елементів.
- Це окислювально-відновна реакція (горіння). Вуглець окислюється, число його окислення збільшується від −2 в С 2 Н 4 (г) до +4 в СО 2 (г). Відновлювачем (паливом) є С 2 Н 4 (г). Кисень знижується, число його окислення зменшується з 0 в O 2 (g) до −2 в H 2 O (л). Окислювачем є O 2 (г).
Це рівняння описує отримання хлориду олова (II):
\[\ce{Sn}(s)+\ce{2HCl}(g)\rightarrow \ce{SnCl2}(s)+\ce{H2}(g) \nonumber \]
Це окислювально-відновна реакція? Якщо так, надайте більш конкретну назву реакції, якщо це доречно, та визначте окислювач та відновник.
- Відповідь
-
Так, реакція одноразової заміни. Sn (s) - відновник, HCl (g) - окислювач.
Балансування окислювально-відновних реакцій за допомогою методу напівреакції
Окислювально-відновні реакції, які відбуваються у водних середовищах, часто включають воду, іони гідронію та гідроксидні іони як реагенти або продукти. Незважаючи на те, що ці види не окислюються або не відновлюються, вони беруть участь у хімічній зміні іншими способами (наприклад, забезпечуючи елементи, необхідні для утворення оксианіонів). Рівняння, що представляють ці реакції, іноді дуже важко збалансувати шляхом перевірки, тому розроблені систематичні підходи, щоб допомогти в процесі. Одним з дуже корисних підходів є використання методу напівреакцій, який передбачає наступні етапи:
- Напишіть дві напівреакції, що представляють окислювально-відновний процес.
- Збалансувати всі елементи, крім кисню і водню.
- Балансуйте атоми кисню, додаючи молекули Н 2 О.
- Врівноважте атоми водню, додаючи іони Н +.
- Баланс заряду 1 шляхом додавання електронів.
- При необхідності помножте коефіцієнти кожної половини реакції на найменші цілі числа, щоб отримати однакові числа електронів у кожній.
- Додайте збалансовані напівреакції разом і спростіть, видаливши види, які з'являються з обох сторін рівняння.
- Для реакцій, що протікають в основних середовищах (надлишок гідроксид-іонів), проводять такі додаткові етапи:
- Додайте OH − іони до обох сторін рівняння у числах, рівних кількості іонів H +.
- Збоку рівняння, що містить іони H + та OH −, об'єднати ці іони, щоб отримати молекули води.
- Спростіть рівняння, видаливши будь-які надлишкові молекули води.
- Нарешті, перевірте, щоб побачити, що і кількість атомів, і загальні заряди 2 збалансовані.
Напишіть збалансоване рівняння для реакції між іоном дихромата та залізом (II) з отриманням заліза (III) та хрому (III) у кислому розчині.
\[\ce{Cr2O7^2- + Fe^2+ \rightarrow Cr^3+ + Fe^3+} \nonumber \]
S рішення
Напишіть дві напівреакції.
Кожна напівреакція буде містити один реагент і один продукт з одним спільним елементом.
\(\ce{Cr2O7^2- \rightarrow Cr^3+}\)
Збалансувати всі елементи, крім кисню і водню. Половинна реакція заліза вже збалансована, але напівреакція хрому показує два атоми Cr зліва і один атом Cr праворуч. Змінюючи коефіцієнт в правій частині рівняння на 2, досягається рівновага щодо атомів Cr.
\(\ce{Cr2O7^2- \rightarrow 2Cr^3+}\)
Збалансувати атоми кисню, додаючи молекули H 2 O. Половинна реакція заліза не містить атомів O. Половинна реакція хрому показує сім атомів O зліва і жоден праворуч, тому сім молекул води додаються з правого боку.
\(\ce{Cr2O7^2- \rightarrow 2Cr^3+ + 7H2O}\)
Врівноважте атоми водню, додаючи іони Н +. Половинна реакція заліза не містить атомів Н. Напівреакція хрому показує 14 атомів Н праворуч і жоден ліворуч, тому 14 іонів водню додаються до лівої сторони.
\(\ce{Cr2O7^2- + 14H+ \rightarrow 2Cr^3+ + 7H2O}\)
Балансувати заряд шляхом додавання електронів. Половинна реакція заліза показує загальний заряд 2+ з лівого боку (1 іон Fe 2 +) і 3+ з правого боку (1 Fe 3 + іон). Додавання одного електрона до правого боку доводить загальний заряд цієї сторони до (3+) + (1−) = 2+, і баланс заряду досягається.
Половинна реакція хрому показує загальний заряд (1 × 2−) + (14 × 1+) = 12+ з лівого боку (\(\ce{1 Cr2O7^2-}\)іон та 14 H + іонів). Сумарний заряд з правого боку дорівнює (2 × 3+) = 6 + (2 Cr 3 + іони). Додавання шести електронів до лівої сторони призведе до загального заряду цієї сторони до (12+ + 6−) = 6+, і баланс заряду досягається.
\(\ce{Fe^2+ \rightarrow Fe^3+ + e-}\)
\(\ce{Cr2O7^2- + 14H+ + 6e- \rightarrow 2Cr^3+ + 7H2O}\)
Помножте дві напівреакції так, щоб кількість електронів в одній реакції дорівнювала кількості електронів в іншій реакції. Щоб відповідати збереженню маси та ідеї про те, що окислювально-відновні реакції передбачають передачу (не створення або руйнування) електронів, коефіцієнт напівреакції заліза потрібно помножити на 6.
\(\ce{6Fe^2+ \rightarrow 6Fe^3+ + 6e-}\)
\(\ce{Cr2O7^2- + 6e- + 14H+ \rightarrow 2Cr^3+ + 7H2O}\)
Додайте збалансовані напівреакції та скасуйте види, які з'являються по обидва боки рівняння.
\[\ce{6Fe^2+ + Cr2O7^2- + 6e- + 14H+ \rightarrow 6Fe^3+ + 6e- + 2Cr^3+ + 7H2O} \nonumber \]
Лише шість електронів є надлишковими видами. Видалення їх з кожного боку рівняння дає спрощене, збалансоване рівняння тут:
\[\ce{6Fe^2+ + Cr2O7^2- + 14H+ \rightarrow 6Fe^3+ + 2Cr^3+ + 7H2O} \nonumber \]
Остаточна перевірка балансу атома та заряду підтверджує, що рівняння збалансовано.
| Реагенти | Продукція | |
|---|---|---|
| Fe | 6 | 6 |
| Cr | 2 | 2 |
| O | 7 | 7 |
| Ч | 14 | 14 |
| заряджати | 24+ | 24+ |
У кислому розчині перекис водню реагує з Fe 2 + з отриманням Fe 3 + і H 2 O. Напишіть збалансоване рівняння для цієї реакції.
- Відповідь
-
\[\ce{H2O2}(aq)+\ce{2H+}(aq)+\ce{2Fe^2+} \rightarrow \ce{2H2O}(l)+\ce{2Fe^3+} \nonumber \]
Резюме
Хімічні реакції класифікуються за схожими моделями поведінки. Велика кількість важливих реакцій входить в три категорії: осадження, кислотно-лужна і окислювально-відновна (окислювально-відновна). Реакції опадів передбачають утворення одного або декількох нерозчинних продуктів. Кислотно-лужні реакції передбачають перенесення іонів водню між реагентами. Окислювально-відновні реакції передбачають зміну числа окислення для одного або декількох елементів реагентів. Написання збалансованих рівнянь для деяких окислювально-відновних реакцій, що відбуваються у водних розчині, спрощується за допомогою системного підходу, який називається методом напівреакції.
Виноски
- 1 Вимога «балансу заряду» - це всього лише конкретний тип «балансу маси», в якому розглянутий вид є електронами. Рівняння має представляти рівну кількість електронів на стороні реагенту та продукту, і тому обидва атоми і заряди повинні бути збалансовані.
- 2 Вимога «балансу заряду» - це всього лише конкретний тип «балансу маси», в якому розглянутий вид є електронами. Рівняння має представляти рівну кількість електронів на стороні реагенту та продукту, і тому обидва атоми і заряди повинні бути збалансовані.
Глосарій
- кислота
- речовина, що виробляє Н 3 О + при розчиненні у воді
- кислотно-лужна реакція
- реакція, що передбачає перенесення іона водню між видами реагентів
- база
- речовина, що виробляє OH − при розчиненні у воді
- реакція горіння
- енергійна окислювально-відновна реакція, що виробляє значну кількість енергії у вигляді тепла, а іноді і світла
- напівреакція
- рівняння, яке показує, чи кожен реагент втрачає або отримує електрони в реакції.
- нерозчинний
- відносно низької розчинності; розчинення лише в незначній мірі
- реакція нейтралізації
- реакція між кислотою та основою для отримання солі та води
- окислення
- процес, в якому число окислення елемента збільшується втратою електронів
- окислювально-відновна реакція
- (також окислювально-відновна реакція) реакція, що передбачає зміну числа окислення для одного або декількох елементів реагентів
- число окислення
- (також, ступінь окислення) заряд кожного атома елемента мав би в сполуці, якби сполука була іонною
- окислювач
- (Крім того, окислювача) речовина, яка призводить до окислення іншої речовини, і в процесі стає відновленим
- осадити
- нерозчинний продукт, який утворюється в результаті реакції розчинних реагентів
- реакція опадів
- реакція, яка виробляє один або кілька нерозчинних продуктів; коли реагенти - це іонні сполуки, іноді звані подвійним зміщенням або метатезом
- скорочення
- процес, в якому число окислення елемента зменшується за рахунок посилення електронів
- відновлювач
- (Також, відновник) речовина, яка призводить до відновлення іншої речовини, а в процесі окислюється
- сіль
- іонна сполука, яка може утворитися в результаті реакції кислоти з основою, яка містить катіон і аніон, крім гідроксиду або оксиду
- реакція одного зміщення
- (також заміна) окислювально-відновна реакція, що включає окислення елементарної речовини іонним видом
- розчинний
- відносно високої розчинності; розчинення у відносно великій мірі
- розчинність
- ступінь, в якій речовина може бути розчинена у воді або будь-якому розчиннику
- сильна кислота
- кислота, яка повністю реагує при розчиненні у воді з отриманням іонів водню
- міцна основа
- основа, яка повністю реагує при розчиненні у воді з отриманням гідроксидних іонів
- слабка кислота
- кислота, яка реагує лише в незначній мірі при розчиненні у воді з отриманням іонів водню
- слабке підставу
- основа, яка реагує лише в незначній мірі при розчиненні у воді з отриманням гідроксидних іонів