14.2: Окислювально-відновні реакції
- Page ID
- 22453
- Визначте окислення і відновлення.
- Призначте числа окислення атомам в простих сполуках.
- Розпізнати реакцію як окислювально-відновну реакцію.
Розглянемо цю хімічну реакцію:
\[\ce{Mg(s) + Cl2(g) → MgCl2}\nonumber \]
Реагенти - це два електрично нейтральних елемента; вони мають таку ж кількість електронів, що і протони. Продукт, однак, є іонним; він складається з іонів Mg 2 + та Cl −. Якимось чином окремі атоми Mg втрачають два електрони, щоб зробити іон Mg 2 +, тоді як атоми Cl отримують електрон, щоб стати іонами Cl −. Ця реакція передбачає перенесення електронів між атомами.
Процес втрати і отримання електронів відбувається одночасно. Однак подумки ми можемо розділити два процеси. Окислення визначається як втрата одного або декількох електронів атомом. Зменшення визначається як посилення одного або декількох електронів атомом. Отже, окислення та відновлення завжди відбуваються разом; лише подумки ми можемо їх відокремити. Хімічні реакції, які передбачають перенесення електронів, називаються окислювально-відновними (або окисно-відновними) реакціями.
Окислювально-відновні реакції вимагають, щоб ми відстежували електрони, призначені кожному атому в хімічній реакції. Як нам це зробити? Ми використовуємо окислювальні числа для відстеження електронів в атомах. Числа окислення присвоюються атомам на основі чотирьох правил. Числа окислення не обов'язково дорівнюють заряду на атомі (хоча іноді вони можуть бути); ми повинні тримати поняття чисел заряду і окислення окремо.
Правила присвоєння окислювальних чисел атомам такі:
- Атомам в їх елементарному стані присвоюється окислювальне число 0.
- Атомам в одноатомних (тобто одноатомних) іонам присвоюється число окислення, рівне їх заряду. Окислювальні числа зазвичай пишуться спочатку зі знаком, потім величиною, щоб диференціювати їх від зарядів.
- У сполуках фтору присвоюється число окислення −1; кисню зазвичай присвоюється число окислення −2 (за винятком пероксидних сполук [де це −1] і в бінарних сполуках з фтором [де він позитивний]); а водню зазвичай присвоюється число окислення +1 (крім випадків, коли він існує як іон гідриду [H −], в цьому випадку переважає правило 2).
- У сполуках всім іншим атомам присвоюється число окислення так, що сума чисел окислення на всіх атомах у видах дорівнює заряду на вид (який дорівнює нулю, якщо вид нейтральний).
Ось кілька прикладів для практики. У Н 2 обидва атома Н мають число окислення 0 за правилом 1. У MgCl 2 магній має число окислення +2, тоді як хлор має число окислення −1 за правилом 2. У H 2 O атоми H мають число окислення +1, тоді як атом O має число окислення −2, хоча водню та кисню в цій сполуці не існують як іони (правило 3). На відміну від правила 3, кожен атом Н в пероксиді водню (H 2 O 2) має число окислення +1, тоді як кожен атом O має число окислення −1. Ми можемо використовувати правило 4 для визначення чисел окислення атомів в SO 2. Кожен атом O має число окислення −2; щоб сума чисел окислення дорівнювала заряду на вид (який дорівнює нулю) атому S присвоюється число окислення +4. Чи означає це, що атом сірки має 4+ заряд на ньому? Ні, це означає лише те, що атому S присвоюється число окислення +4 за нашими правилами розподілу електронів між атомами в з'єднанні.
Призначте числа окислення атомам в кожній речовині.
- Сл 2
- ГеО 2
- Са (НІ 32)
Рішення
- Cl 2 є елементарною формою хлору. Правило 1 стверджує, що кожен атом має число окислення 0.
- За правилом 3 кисню в нормі присвоюється число окислення −2. Щоб сума чисел окислення дорівнювала заряду на вид (нуль), атому Ge присвоюється число окислення +4.
- Ca (NO 3) 2 можна розділити на дві частини: іон Ca 2 + та іон NO 3 −. Розглядаючи їх окремо, іон Са 2 + має число окислення +2 за правилом 2. Тепер розглянемо NO 3 − іон. Кисню присвоюється окислювальне число −2, а їх три. Згідно з правилом 4, сума чисел окислення на всіх атомах повинна дорівнювати заряду на видах, тому ми маємо просте алгебраїчне рівняння x + 3 (−2) = −1
де x - число окислення атома N, а −1 представляє заряд на виді. Оцінюючи для х,
х + (−6) = −1 х = +5Таким чином, число окислення на атомі N в іоні NO 3 − становить +5.
Призначте числа окислення атомам в H 3 PO 4.
- Відповідь
-
Ч: +1; О: −2; Р: +5
Всі окислювально-відновні реакції відбуваються з одночасною зміною чисел окислення деяких атомів. Щонайменше два елементи повинні змінювати свої окислювальні числа. Коли число окислення атома збільшується в ході окислювально-відновної реакції, цей атом окислюється. Коли число окислення атома зменшується в ході окислювально-відновної реакції, цей атом зменшується. Окислення і відновлення також можуть бути визначені з точки зору збільшення або зменшення числа окислення відповідно.
Визначте, що окислюється та відновлюється в цій окислювально-відновній реакції.
\[\ce{2Na + Br2 → 2NaBr} \nonumber \nonumber \]Рішення
Обидва реагенти є елементарними формами їх атомів, тому атоми Na і Br мають номери окислення 0. В іонному продукті іони Na + мають число окислення +1, тоді як іони Br − мають число окислення −1.
\[2\underset{0}{Na}+\underset{0}{Br_{2}}\rightarrow 2\underset{+1 -1}{NaBr} \nonumber \nonumber \]
Натрій збільшує число окислення з 0 до +1, тому він окислюється; бром зменшує число окислення з 0 до −1, тому його зменшують:
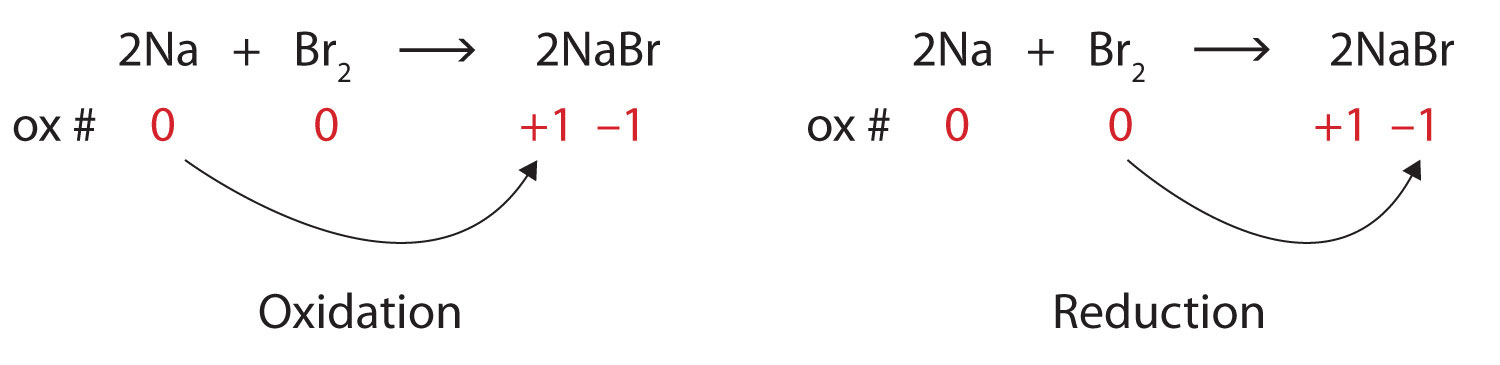
Оскільки числа окислення змінюються, це окислювально-відновна реакція. Загальна кількість електронів, втрачених натрієм (два, один втрачений від кожного атома Na) отримується бромом (два, один отриманий для кожного атома Br).
Визначте, що окислюється та відновлюється в цій окислювально-відновній реакції.
\[\ce{C + O2 → CO2}\nonumber \nonumber \]
- Відповідь
-
C окислюється від 0 до +4; O відновлюється з 0 до −2.
Реакції окислення можуть стати досить складними, про що свідчить наступна окислювально-відновна реакція:
\[6H^{+}(aq)+2\underset{+7}{MnO_{4}^{-}}(aq)+5\underset{-1}{H_{2}O_{2}}(l)\rightarrow 2\underset{+2}{Mn^{2+}}(aq)+5\underset{0}{O_{2}}(g)+8H_{2}O(l)\nonumber \]
Щоб продемонструвати, що це окислювально-відновна реакція, перераховані номери окислення видів, що окислюються та відновлюються; чи можете ви визначити, що окислюється, а що зменшується? Це також приклад чистої іонної реакції; глядачі іони, які не змінюють числа окислення, не відображаються в рівнянні. Зрештою, нам потрібно буде вивчити методи написання правильних (тобто збалансованих) окислювально-відновних реакцій.
Залізо є важливим мінералом у нашому раціоні; залізовмісні сполуки, такі як білок гема в гемоглобіні, не могли функціонувати без нього. Більшість біологічного заліза має форму іона Fe 2 +; залізо з іншими числами окислення майже не має значення в біології людини (хоча організм дійсно містить фермент для зниження Fe 3 + до Fe 2 +, тому Fe 3 + повинен мати деяке біологічне значення, нехай і незначне). Щоб гарантувати, що ми вживаємо достатню кількість заліза, багато продуктів збагачуються залізом. Хоча сполуки Fe 2 + є найбільш логічними речовинами для використання, деякі продукти використовують «знижене залізо» як інгредієнт (хліб та сухі сніданки - найвідоміші приклади). Зниження заліза - це просто залізний метал; залізо додається у вигляді дрібного металевого порошку. Металеве залізо окислюється до Fe 2 + в травній системі, а потім засвоюється організмом, але залишається питання: чому ми вживаємо металеве залізо? Чому б просто не використовувати солі Fe 2 + в якості добавки?

Хоча важко встановити переконливі причини, пошук наукової та медичної літератури передбачає кілька причин. Однією з причин є те, що дрібні залізні стружки не впливають на смак продукту. Розмір порошку заліза (кілька десятків мікрометрів) не помітний при пережовуванні продуктів, доповнених залізом, а мова не виявляє ніяких змін смаку, які можна виявити при вживанні солей Fe 2 +. Сполуки Fe 2+ можуть впливати на інші властивості харчових продуктів під час приготування та приготування їжі, такі як податливість тіста, ріст дріжджів та колір. Нарешті, із загальних речовин заліза, які можуть бути використані, металеве залізо є найменш дорогим. Ці фактори, як видається, є одними з причин, чому металеве залізо є доповненням вибору в деяких продуктах харчування.
Ключові виноси
- Окислювально-відновні (окислювально-відновні) реакції припускають перенесення електронів від одного атома до іншого.
- Окислювальні числа використовуються для відстеження електронів в атомах.
- Існують правила присвоєння окислювальних чисел атомам.
- Окислення - це збільшення числа окислення (втрата електронів); відновлення - зменшення числа окислення (посилення електронів).
