2.4: Хімічні формули
- Page ID
- 22544
- Символізують склад молекул за допомогою молекулярних формул і емпіричних формул
- Представляють зв'язок розташування атомів всередині молекул за допомогою структурних формул
Молекулярна формула - це подання молекули, яка використовує хімічні символи для позначення типів атомів, за якими слідують індекси, щоб показати кількість атомів кожного типу в молекулі. (Індексний індекс використовується лише тоді, коли присутній більше одного атома заданого типу.) Молекулярні формули також використовуються в якості скорочень назв сполук.
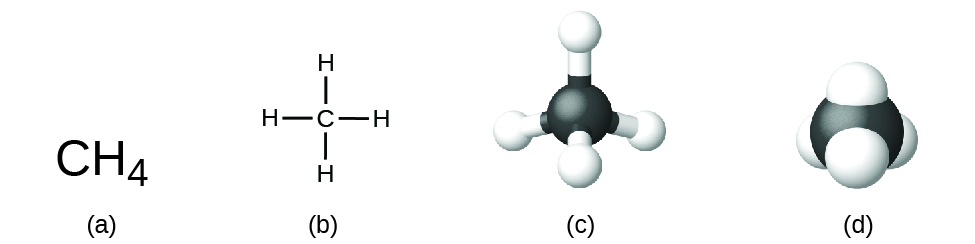
Структурна формула сполуки дає ту ж інформацію, що і його молекулярна формула (типи та номери атомів у молекулі), але також показує, як атоми пов'язані в молекулі. Структурна формула метану містить символи для одного атома С і чотирьох атомів Н, що позначають кількість атомів в молекулі (рис.\(\PageIndex{1}\)). Лінії являють собою зв'язки, які утримують атоми разом. (Хімічний зв'язок - це тяжіння між атомами або іонами, що утримує їх разом у молекулі або кристалі.) Ми обговоримо хімічні зв'язки і подивимося, як передбачити розташування атомів в молекулі пізніше. Наразі просто знайте, що лінії є вказівкою того, як атоми з'єднані в молекулі. Модель з кулькою та палицею показує геометричне розташування атомів з атомними розмірами, які не масштабуються, а модель заповнення простору показує відносні розміри атомів.
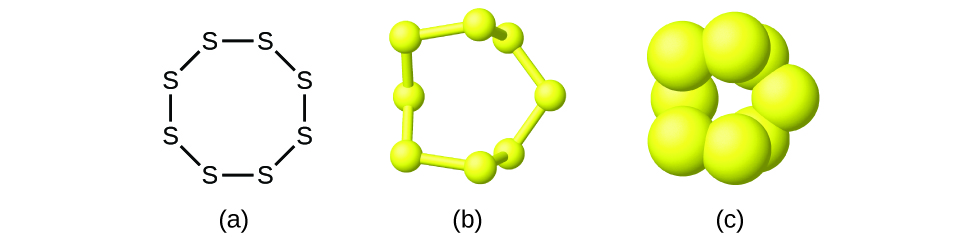
Хоча багато елементів складаються з дискретних окремих атомів, деякі існують як молекули, що складаються з двох або більше атомів елемента, хімічно пов'язаних між собою. Наприклад, більшість зразків елементів водню, кисню та азоту складаються з молекул, які містять два атоми кожен (називається двоатомними молекулами) і, таким чином, мають молекулярні формули H 2, O 2 та N 2 відповідно. Інші елементи, які зазвичай зустрічаються у вигляді двоатомних молекул, - це фтор (F 2), хлор (Cl 2), бром (Br 2) та йод (I 2). Найбільш поширена форма елемента сірка складається з молекул, які складаються з восьми атомів сірки; його молекулярна формула - S 8 (рис.\(\PageIndex{2}\)).
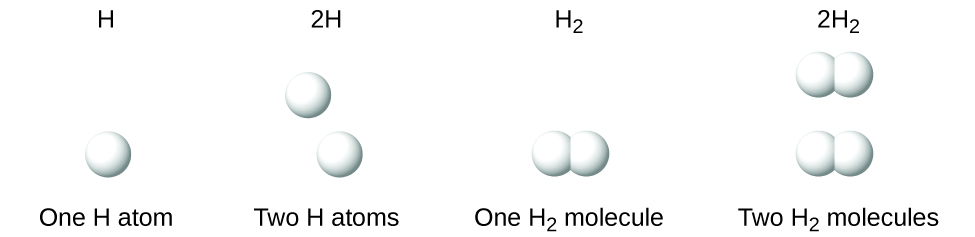
Важливо зазначити, що індекс після символу та число перед символом не представляють одне і те ж; наприклад, H 2 і 2H представляють чітко різні види. Н 2 - молекулярна формула; вона являє собою двоатомну молекулу водню, що складається з двох атомів елемента, які хімічно пов'язані між собою. Вираз 2H, з іншого боку, вказує на два окремих атома водню, які не об'єднані як одиниця. Вираз 2Н 2 являє собою дві молекули двоатомного водню (рис.\(\PageIndex{3}\)).
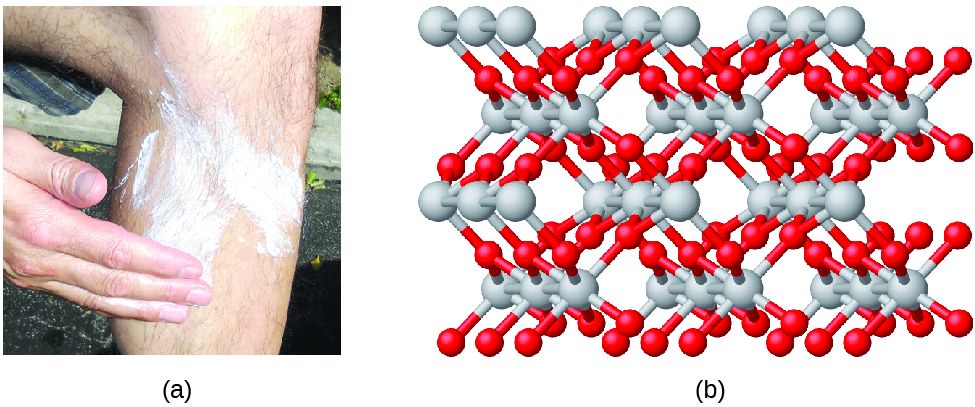
Сполуки утворюються при хімічному з'єднанні двох і більше елементів, в результаті чого утворюються зв'язки. Наприклад, водень і кисень можуть реагувати з утворенням води, а натрій і хлор можуть реагувати з утворенням кухонної солі. Ми іноді описуємо склад цих сполук емпіричною формулою, в якій вказуються типи присутніх атомів і найпростіший цільночисловий співвідношення кількості атомів (або іонів) в з'єднанні. Наприклад, діоксид титану (використовується як пігмент в білій фарбі і в густому, білому, блокуючому типі сонцезахисного крему) має емпіричну формулу TiO 2. Це ідентифікує елементи титану (Ti) і кисень (O) як складові діоксиду титану, і вказує на наявність в два рази більше атомів елемента кисню, ніж атомів елемента титану (рис.\(\PageIndex{4}\)).
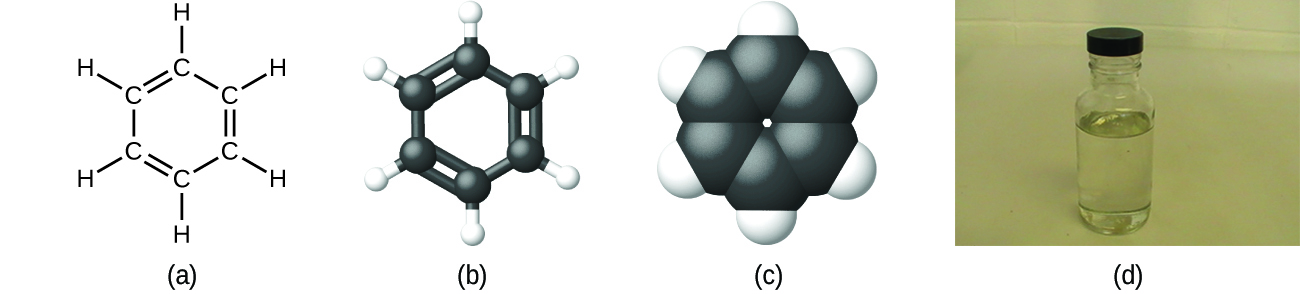
Як обговорювалося раніше, ми можемо описати з'єднання з молекулярною формулою, в якій індекси вказують фактичні числа атомів кожного елемента в молекулі сполуки. У багатьох випадках молекулярна формула речовини виходить з експериментального визначення як його емпіричної формули, так і його молекулярної маси (суми атомних мас для всіх атомів, що складають молекулу). Наприклад, експериментально можна визначити, що бензол містить два елементи, вуглець (С) і водень (Н), і що на кожен атом вуглецю в бензолі припадає один атом водню. Таким чином, емпірична формула - СН. Експериментальне визначення молекулярної маси показує, що молекула бензолу містить шість атомів вуглецю і шість атомів водню, тому молекулярна формула бензолу - C 6 H 6 (рис.\(\PageIndex{5}\)).
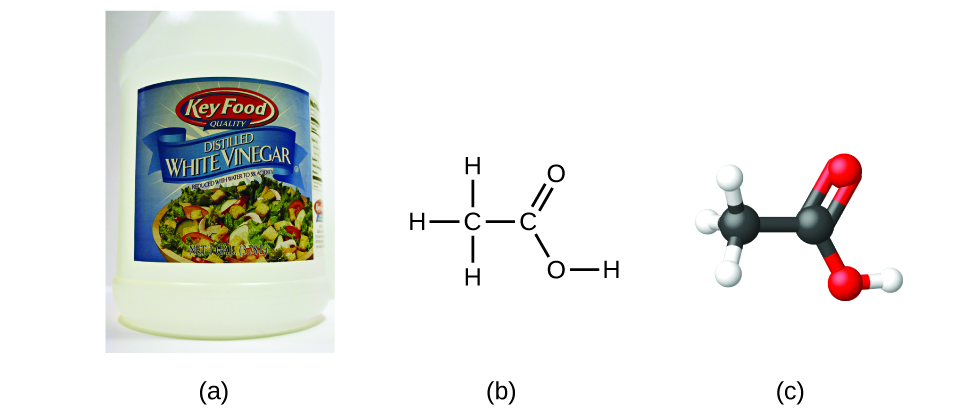
Якщо ми знаємо формулу сполуки, ми можемо легко визначити емпіричну формулу. (Це дещо академічна вправа; зворотна хронологія, як правило, дотримується фактичної практики.) Наприклад, молекулярна формула оцтової кислоти, компонента, що надає оцту його гострий смак, - C 2 H 4 O 2. Ця формула вказує на те, що молекула оцтової кислоти (рис.\(\PageIndex{6}\)) містить два атоми вуглецю, чотири атома водню і два атома кисню. Співвідношення атомів дорівнює 2:4:2. Ділення на найнижчий спільний знаменник (2) дає найпростіший, ціле число співвідношення атомів, 1:2:1, тому емпірична формула - CH 2 O. Зверніть увагу, що молекулярна формула завжди є цілим числом кратним емпіричній формулі.
Молекули глюкози (цукру в крові) містять 6 атомів вуглецю, 12 атомів водню і 6 атомів кисню. Які молекулярні та емпіричні формули глюкози?
Рішення
Молекулярна формула - C 6 H 12 O 6, оскільки одна молекула насправді містить 6 атомів C, 12 H та 6 O. Найпростіше співвідношення цілого числа атомів C до H до O в глюкозі становить 1:2:1, тому емпірична формула - СН 2 О.
Молекула метальдегіду (пестицид, який використовується для равликів і слимаків) містить 8 атомів вуглецю, 16 атомів водню та 4 атоми кисню. Які молекулярні та емпіричні формули метальдегіду?
- Відповідь
-
Молекулярна формула, C 8 H 16 O 4; емпірична формула, C 2 H 4 O
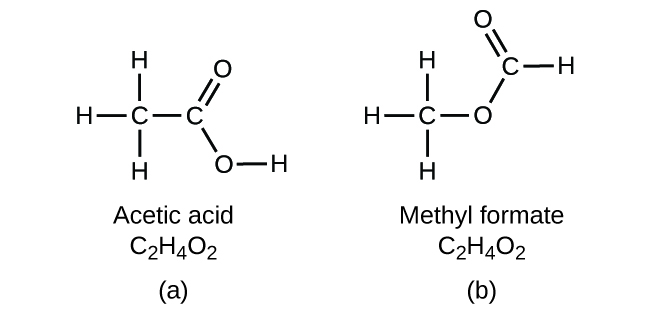
Важливо знати, що однакові атоми можуть бути розташовані по-різному: сполуки з однаковою молекулярною формулою можуть мати різний зв'язок атом-атом і, отже, різну структуру. Наприклад, чи може бути інша сполука з тією ж формулою, що і оцтова кислота, C 2 H 4 O 2? І якщо так, то якою буде будова його молекул?
Якщо передбачити, що інша сполука з формулою C 2 H 4 O 2 може існувати, то ви продемонстрували хорошу хімічну проникливість і правильні. Два атоми С, чотири атоми Н та два атоми O також можуть бути організовані для утворення метилформіату, який використовується у виробництві як інсектицид та для швидковисихаючої обробки. Молекули метилформіату мають один з атомів кисню між двома атомами вуглецю, що відрізняється від розташування в молекулах оцтової кислоти. Оцтова кислота і метилформіат є прикладами ізомерів - сполук з тією ж хімічною формулою, але різної молекулярної структури (рис.\(\PageIndex{7}\)). Зверніть увагу, що ця невелика різниця в розташуванні атомів має великий вплив на їх відповідні хімічні властивості. Ви б точно не хотіли використовувати розчин метилформіату в якості замінника розчину оцтової кислоти (оцту), коли будете робити заправку для салатів.
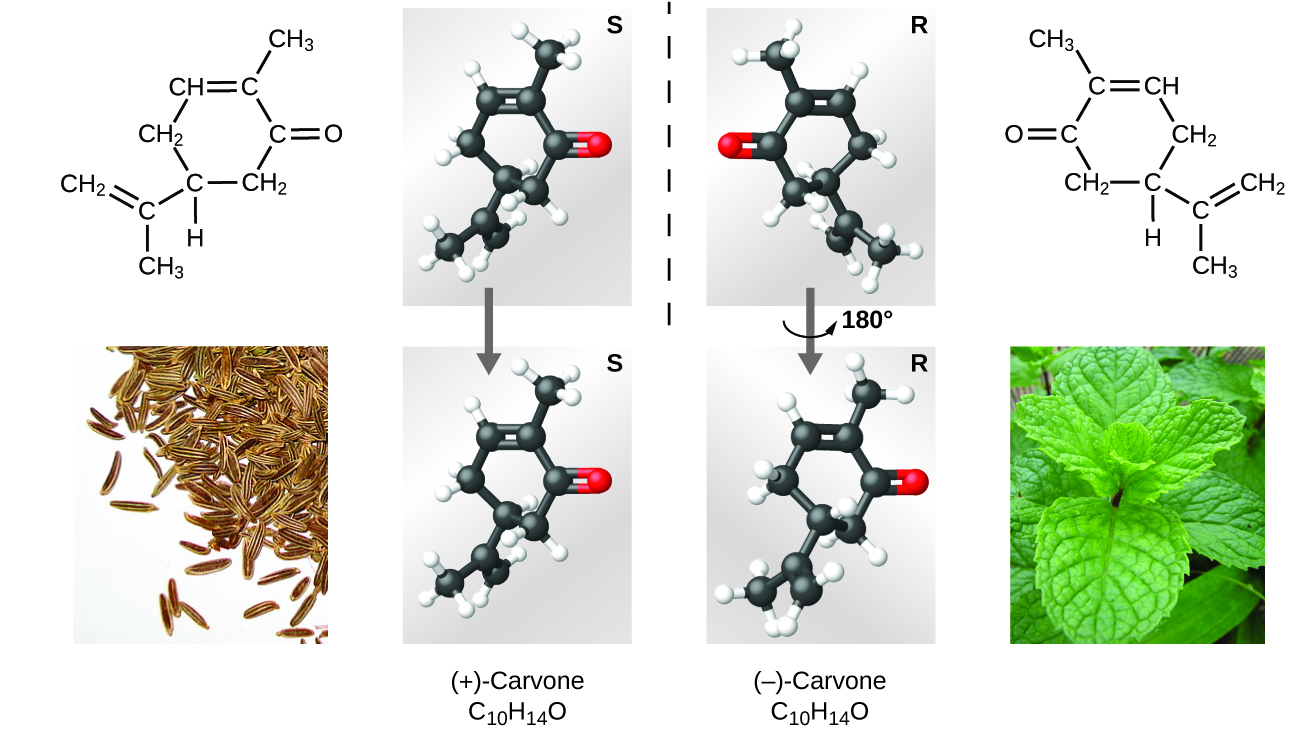
Існує безліч видів ізомерів (рис.\(\PageIndex{8}\)). Оцтова кислота і метилформіат - це структурні ізомери, сполуки, в яких молекули відрізняються тим, як атоми з'єднані між собою. Існують також різні типи просторових ізомерів, у яких відносні орієнтації атомів в просторі можуть бути різними. Наприклад, з'єднання карвона (міститься в кмині, м'яті та шкірці мандаринового апельсина) складається з двох ізомерів, які є дзеркальним відображенням один одного. S - (+) -карвон пахне кмином, а R - (−) -карвоне пахне м'ятою.
Резюме
Молекулярна формула використовує хімічні символи та індекси для позначення точних чисел різних атомів у молекулі або сполуці. Емпірична формула дає найпростіший, ціле число співвідношення атомів в сполуці. Структурна формула вказує на зв'язок розташування атомів в молекулі. Моделі з кулею та палицею та заповненням простору показують геометричне розташування атомів у молекулі. Ізомери - це сполуки з однаковою молекулярною формулою, але різним розташуванням атомів.
Глосарій
- емпірична формула
- формула, що показує склад сполуки, заданої як найпростішого співвідношення цілого числа атомів
- ізомери
- сполуки з однаковою хімічною формулою, але різної структури
- молекулярна формула
- формула, що вказує на склад молекули з'єднання і дає фактичну кількість атомів кожного елемента в молекулі з'єднання.
- просторові ізомери
- сполуки, в яких відносні орієнтації атомів в просторі відрізняються
- структурний ізомер
- одна з двох речовин, які мають однакову молекулярну формулу, але відрізняються фізико-хімічними властивостями, оскільки їх атоми пов'язані по-різному
- структурна формула
- показує атоми в молекулі і як вони пов'язані
