14.3: Молекули як енергоносії та перетворювачі
- Page ID
- 19010
Переконайтеся, що ви добре розумієте наступні основні поняття:
- Опишіть джерела потенційної енергії та кінетичної енергії, що містяться в молекулі.
- Опишіть природу «теплової» енергії, і як вона пов'язана з іншими формами кінетичної енергії і з температурою.
- Поясніть, чому найпростіші молекули (одноатомні і двоатомні) мають меншу теплоємність, ніж багатоатомні молекули.
- Аналогічно поясніть, чому залежність теплоємності від температури різна для одноатомних і багатоатомних молекул.
Всі молекули при температурах вище абсолютного нуля володіють тепловою енергією — рандомізованою кінетичною енергією, пов'язаною з різними рухами, які можуть зазнати молекули в цілому, а також атоми всередині них. Багатоатомні молекули також володіють потенційною енергією у вигляді хімічних зв'язків. Таким чином, молекули є як транспортними засобами для зберігання і транспортування енергії, так і засобом перетворення її з однієї форми в іншу, коли утворення, розрив або перестановка хімічних зв'язків всередині них супроводжується поглинанням або виділенням тепла.
Хімічна енергія: Потенціал+Кі
Купуючи літр бензину для свого автомобіля, кубометр природного газу для обігріву вашого будинку, або невеликий акумулятор для ліхтаря, ви купуєте енергію в хімічному вигляді. У кожному конкретному випадку, до того, як ця енергія може бути виділена і використана, повинна відбутися якась хімічна зміна: паливо необхідно спалити в присутності кисню, або два полюса батареї повинні бути підключені через зовнішній контур (тим самим ініціюючи хімічну реакцію всередині батареї.) І врешті-решт, коли кожна з цих реакцій буде завершена, наше джерело енергії буде вичерпано; паливо буде витрачено, або батарея буде «мертва».
Куди пішла енергія? Він міг піти на підвищення температури продуктів, виконувати роботу по розширенню будь-яких газоподібних продуктів або проштовхувати електрони через ланцюг. Решта буде перебувати в хімічній потенційній енергії, пов'язаної з продуктами реакції.
Хімічні речовини складаються з атомів, або більш загалом, позитивно заряджених ядер, оточених негативно зарядженими електронами. Молекула, така як дигідроген, H 2, утримується разом електростатичними атракціонами, опосередкованими електронами, поділеними між двома ядрами. Загальна потенційна енергія молекули - це сума відштовхувань між подібними зарядами і атракціонами між електронами і ядрами:
\[PE_{total} = PE_{electron-electron} + PE_{nucleus-nucleus} + PE_{nucleus-electron} \label{1-1}\]
Іншими словами, потенційна енергія молекули залежить від усередненого за часом відносного розташування складових її ядер і електронів. Ця залежність виражається звичною кривою потенційної енергії, яка служить важливим описом хімічного зв'язку між двома атомами.
Під перекладом розуміється рух об'єкта як повної одиниці. Поступальні рухи молекул у твердих тілах або рідинях обмежуються дуже короткими відстанями, порівнянними з розмірами самих молекул, тоді як в газах молекули зазвичай подорожують сотнями молекулярних діаметрів між зіткненнями.
Наприклад, у газоподібному водні молекули будуть вільно переміщатися з одного місця в інше; це називається поступальним рухом, і тому молекули мають поступальну кінетичну енергію
\[KE_{trans} = \dfrac{mv^2}{2}\]
в якому\(v\) позначається середня швидкість молекул; ви можете згадати з вашого дослідження газів\(v\), що, а отже\(KE_{trans}\), залежить від температури.
Крім перекладу, молекули, що складаються з двох або більше атомів, можуть володіти іншими видами руху. Оскільки хімічний зв'язок діє як своєрідна пружина, два атоми в H 2 матимуть природну коливальну частоту. У більш складних молекулах стає можливим багато різних режимів вібрації, і всі вони вносять коливальний термін KE vib до загальної кінетичної енергії. Нарешті, молекула може зазнавати обертальних рухів, які породжують третій термін\(KE_{rot}\). Таким чином, загальна кінетична енергія молекули - це сума.
\[KE_{total} = KE_{trans} + KE_{vib} + KE_{rot} \label{1-2}\]
Загальна енергія молекули (її внутрішня енергія U) - це всього лише сума
\[U = KE_{total} + PE_{total} \label{1-3}\]
Хоча ця формула проста і зрозуміла, вона не може зайняти нас дуже далеко в розумінні та прогнозуванні поведінки навіть однієї молекули, не кажучи вже про велику їх кількість. Причиною, звичайно, є хаотичний і непередбачуваний характер молекулярного руху. На щастя, поведінка великої колекції молекул, як і у великої популяції людей, можна описати статистичними методами.
Як молекули зберігають теплову енергію
Як зазначалося вище, теплоємність речовини - це міра того, наскільки чутливо на його температуру впливає зміна теплоємності; чим більше теплоємність, тим менший вплив даний потік тепла q матиме на температуру.
Теплова енергія - це рандомізована кінетична енергія
Ми також зазначили, що температура є мірою середньої кінетичної енергії, обумовленої поступальними рухами молекул. Якщо вібраційні або обертальні рухи також активні, вони також приймуть теплову енергію та зменшать кількість, яка переходить у поступальні рухи. Оскільки температура залежить тільки від останнього, вплив інших видів рухів буде полягати в зменшенні залежності внутрішньої енергії від температури, тим самим підвищуючи теплоємність речовини.
| одноатомний | двоатомний | триатомний | |||
|---|---|---|---|---|---|
| Він | 20.5 | КО | 29.3 | Н 2 О | 33.5 |
| Ne | 20.5 | N 2 | 29.5 | Д 2 О | 34.3 |
| Ар | 20.5 | Ф 2 | 31.4 | СО 2 | 37.2 |
| Кр | 20.5 | Сл 2 | 33.9 | КС 2 | 45.6 |
Тоді як моноатомні молекули можуть володіти лише поступальною тепловою енергією, у багатоатомних молекулах стають можливими два додаткові види рухів.
Лінійна молекула має вісь, яка визначає два перпендикулярних напрямки, в яких можуть відбуватися обертання; кожен являє собою додатковий ступінь свободи, тому вони разом вносять в цілому ½ R теплоємності.
Вібраційні та обертальні рухи неможливі для одноатомних видів, таких як елементи благородного газу, тому ці речовини мають найнижчу теплоємність. Причому, як видно в крайньому лівому стовпчику таблиці 1, теплові потужності у них все однакові. Це відображає той факт, що поступальні рухи однакові для всіх частинок; всі такі рухи можуть бути дозволені в трьох напрямках в просторі, кожен з яких сприяє молекулі один ступінь свободи і ½ R - її теплоємності. (R - газова постійна, 8,314 Дж К — 1).
Подумайте про «ступінь свободи» як свого роду рух, який додає кінетичну енергію молекулі.
Для нелінійної молекули можливі обертання по всіх трьох напрямках простору, тому ці молекули мають обертальну теплоємність 3/2 R. Нарешті, окремі атоми всередині молекули можуть рухатися відносно один одного, виробляючи коливальний рух. Молекула, що складається з атомів N, може вібрувати 3 N -6 різними способами або режимами. Кожен коливальний режим вносить R (а не ½ R) до загальної теплоємності. (Ці результати виходять з передової механіки і не будуть доведені тут.)
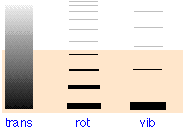
| тип руху → | переклад |
обертання |
вібрації |
|---|---|---|---|
| одноатомний | 3/2 Р | 0 | 0 |
| двоатомний | 3/2 Р | R | R |
| багатоатомний | 3/2 Р | 3/2 Р | 3 Н — 6 |
| поділ між сусідніми рівнями, (кДж моль —1) | 6,0 × 10 —17 Дж (О 2) | 373 Дж (ГСл) | 373 Дж (ГСл) |
Моноатомні молекули мають найменшу теплоємність
Тепер ми в змозі зрозуміти, чому більш складні молекули мають більш високі теплоємності. Загальна кінетична енергія молекули - це сума тих, що обумовлені різними видами рухів:
\[KE_{total} = KE_{trans} + KE_{rot} + KE_{vib} \label{2-1}\]
Коли одноатомний газ поглинає тепло, вся енергія закінчується поступальним рухом і, таким чином, йде на підвищення його температури. У багатоатомному газі, навпаки, поглинена енергія розподіляється між іншими видами рухів; оскільки лише поступальні рухи сприяють температурі, підвищення температури менше, і, таким чином, теплоємність більша. Однак є одне дуже значне ускладнення: класична механіка передбачає, що енергія завжди розподілена однаково між усіма ступенями свободи. Експерименти, однак, показують, що це спостерігається тільки при досить високих температурах. Причина полягає в тому, що всі ці рухи квантуються. Це означає, що для кожного способу руху можливі лише певні приріст енергії, і якщо не буде доступний певний мінімальний обсяг енергії, даний режим взагалі не буде активним і нічого не сприятиме теплоємності.
Рівні поступальної енергії фактично є континуумом
Затінення вказує на середню теплову енергію, доступну при 300 К. Тільки ті рівні, що знаходяться в цьому діапазоні, матимуть значну заповнюваність, про що вказує товщина ліній у двох крайніх правих стовпцях. При 300 К буде активним тільки найнижчий коливальний стан і перші кілька обертальних станів. Більша частина теплової енергії буде обмежена поступальними рівнями, хвилинний інтервал яких (10 —17 Дж) змушує їх з'являтися як континуум.
Теплоємність диводню в залежності від температури. Цей сюжет характерний для інших багатоатомних молекул, і показує практичні наслідки інтервалів різних форм теплової енергії. Таким чином, поступальні рухи доступні практично при будь-яких температурах, але внески в теплоємність обертальними або коливальними рухами можуть розвиватися тільки при температурах, досить великих, щоб збуджувати ці рухи.
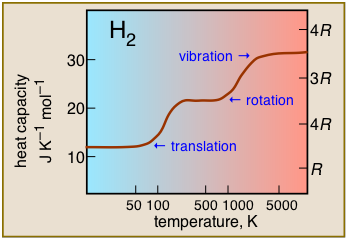
Виходить, що рівні поступальної енергії розташовані настільки близько, що вони ці рухи активні майже до абсолютного нуля, тому всі гази мають теплоємністю не менше 3/2 R при всіх температурах. Обертальні рухи не починаються до проміжних температур, як правило, 300-500К, тому в межах цього діапазону теплові потужності починають збільшуватися з температурою. Нарешті, при дуже високих температурах вібрації починають вносити істотний внесок в теплоємність.
Сильні міжмолекулярні сили рідин і багатьох твердих речовин дозволяють направити тепло в коливальні рухи за участю більше однієї молекули, ще більше збільшуючи теплові потужності. Однією з відомих «аномальних» властивостей рідкої води є її висока теплоємність (75 Дж моль —1 К —1) за рахунок міжмолекулярного водневого зв'язку, що безпосередньо відповідає за помірний вплив великих водойм на прибережний клімат.
Теплоємності металів
Металеві тверді речовини - досить особливий випадок. У металах атоми коливаються щодо своїх рівноважних положень досить рівномірно, що по суті однаково для всіх металів, тому всі вони повинні мати приблизно однакову теплоємність. Те, що це дійсно так, втілено в Законі Дюлонга і Петі. У 19 столітті ці працівники виявили, що молярні теплові потужності всіх досліджуваних ними металевих елементів становили близько 25 Дж моль —1 К —1, що близьке до того, що передбачає класична фізика для кристалічних металів. Це спостереження зіграло важливу роль в характеристиці нових елементів, бо воно забезпечило засіб оцінки їх молярних мас шляхом простого вимірювання теплоємності.
Стандартна зміна ентальпії
За особливих умов, в яких тиск становить 1 атм, а реагенти і продукти знаходяться при температурі 298 К, Δ H стає стандартною зміною ентальпії Δ H°. Хіміки зазвичай називають «зміну ентальпії реакції» просто «ентальпією реакції», а ще простіше «теплотою реакції». Але студентам дозволяється використовувати цей останній ярлик тільки в тому випадку, якщо вони здатні довести, що вони знають значення ентальпії.
Оскільки більшість змін, які відбуваються в лабораторії, на поверхні землі та в організмах піддаються приблизно постійному тиску «однієї атмосфери» і досить цілющим температурам, більшість реакційних нагрівань, наведених в літературі, відносяться до Δ Н°. Але високий тиск і екстремальні температури, часто зустрічаються інженерами-хіміками, геохіміками та практиками хімічної океанографії, часто виключають зручність «стандартних» значень.
Перестановка атомів, що відбувається в хімічній реакції, практично завжди супроводжується звільненням або поглинанням тепла. Якщо мета реакції - служити джерелом тепла, наприклад, при згорянні палива, то ці теплові ефекти представляють прямий і очевидний інтерес. Однак незабаром ми побачимо, що вивчення енергетики хімічних реакцій в цілому може привести нас до більш глибокого розуміння хімічної рівноваги і основи самих хімічних змін.
У хімічній термодинаміці ми визначаємо нуль ентальпії та внутрішньої енергії як енергії елементів, оскільки вони існують у своїх стабільних формах при тиску 298К та 1 атм. Таким чином, ентальпії H Xe (g), O 2 (g) і C (алмаз) всі нульові, як і у H 2 і Cl 2 в реакції
\[H_{2(g)} + Cl_{2(g)} → 2 HCl_{(g)}\]
Ентальпія двох молів HCl менша, ніж у реагентів, тому різниця виділяється у вигляді тепла. Така реакція, як кажуть, екзотермічна. Зворотний момент цієї реакції поглинає таку ж кількість тепла з навколишнього середовища і буде ендотермічним. Порівнюючи внутрішні енергії і ентальпії різних речовин, як ми тут робили, важливо порівнювати рівну кількість родимок, тому що енергія - це велика властивість матерії. Однак теплоти реакції зазвичай виражаються на молярній основі і розглядаються як інтенсивні властивості.
Зміни ентальпії та внутрішньої енергії
Будь-яку хімічну реакцію ми можемо охарактеризувати зміною внутрішньої енергії або ентальпії:
\[ΔH = H_{final} – H_{initial} \label{3-1}\]
Значення цього навряд чи можна перебільшити, оскільки Δ H, будучи функцією стану, повністю не залежить від того, як система переходить від початкового стану до кінцевого стану. Іншими словами, значення Δ H або Δ U для заданої зміни стану не залежить від шляху процесу.
Розглянемо, наприклад, окислення грудки цукру до вуглекислого газу і води:
\[\ce{C12H22O11 + 12 O2(g) → 12 CO2(g) + 11 H2O(l)}\]
Цей процес може здійснюватися різними способами, наприклад, спалюючи цукор на повітрі або вживаючи цукор і дозволяючи своєму тілу здійснювати окислення. Хоча механізми перетворення абсолютно різні для цих двох шляхів, загальна зміна ентальпії системи (атоми вуглецю, водню і кисню, які спочатку знаходилися в цукрі) буде ідентичним, і його можна обчислити, просто шукаючи стандарт ентальпії реагентів і продуктів і розрахунок різниці
\[ΔH = [12 \times H(\ce{CO2})] + [11 \times H(\ce{H2O})] – H(\ce{C12H22O11}) = –5606\, kJ\]
Така ж кількість тепла виділяється незалежно від того, чи цукор спалюється на повітрі або окислюється в серії ферментно-каталізованих кроків у вашому організмі.
Ентальпія збільшується з температурою
При підвищенні температури речовини воно поглинає тепло. Ентальпія системи збільшується з температурою на величину\(ΔH = C_p ΔT\). Визначальне відношення
\[ΔH = ΔU + P ΔV\]
говорить нам, що в цій зміні переважає внутрішня енергія, за умови невеликої корекції для роботи, пов'язаної зі зміною обсягу. Нагрівання речовини змушує його розширюватися, роблячи Δ V позитивним і викликаючи збільшення ентальпії трохи більше, ніж внутрішня енергія. Фізично це означає, що якщо температура підвищується, утримуючи постійний тиск, потрібно витратити додаткову енергію, щоб відштовхнути зовнішню атмосферу, поки система розширюється. Різниця між залежністю U і H від температури тільки дійсно істотна для газів, так як коефіцієнти теплового розширення рідин і твердих тіл дуже малі.
Ентальпія фазових змін
Ділянка ентальпії системи в залежності від її температури називається діаграмою ентальпії. Нахил лінії задається С п. Діаграма ентальпії чистої речовини, такої як вода, показує, що ця ділянка не є однорідною, але переривається різкими розривами, при яких значення С р, мабуть, нескінченне, що означає, що речовина може поглинати або втрачати тепло, не зазнаючи жодної зміни температури взагалі. Це, звичайно, саме те, що відбувається, коли речовина зазнає фазової зміни; ви вже знаєте, що температура води, кипляча в чайнику, ніколи не може перевищувати 100, поки вся рідина не випарується, і в цей момент температура пари буде підвищуватися, оскільки більше тепла надходить в систему.
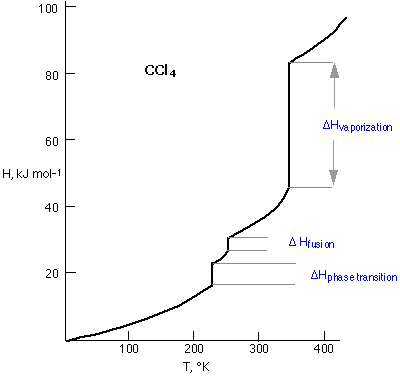
Графік ентальпії тетрахлорметану як функції його температури дає стислий погляд на його теплову поведінку. Ухил лінії задається теплоємністю С р. Всі H -vs. - Графіки С показують різкі розриви, при яких значення С р, мабуть, нескінченне, що означає, що речовина може поглинати або втрачати тепло, не зазнаючи жодної зміни температури взагалі. Це, звичайно, саме те, що відбувається, коли речовина зазнає фазової зміни; ви вже знаєте, що температура води, що кипить у чайнику, ніколи не може перевищувати 100° C, поки вся рідина не випарується, і в цей момент температура (пари) буде підвищуватися, оскільки більше тепла надходить у система.
Найнижчетемпературний розрив на діаграмі CcL 4 відповідає фазовому переходу твердо-тверде тіло, пов'язаному з перестановкою молекул в кристалічному твердому тілі.
