10.7: Кислотно-лужна галерея
- Page ID
- 19277
Переконайтеся, що ви добре розумієте наступні основні ідеї, які були представлені вище. Особливо важливо, щоб ви знали точні значення всіх виділених термінів в контексті даної теми.
- Опишіть деякі особливі властивості сірчаної кислоти, які роблять її особливо важливою як в лабораторії, так і в промисловості.
- Назвіть основні кислоти та основи, які важливі для промисловості добрив
- Назвіть природні джерела будь-яких трьох основних органічних кислот.
- Що таке жирні кислоти? Яким основним чином відрізняються фізичні властивості насичених і ненасичених жирних кислот?
- Опишіть загальну структуру амінокислоти та вкажіть, чому вони важливі.
Кислоти та основи цікаві не тільки хімічно схильним, вони відіграють важливу роль у нашому сучасному індустріальному суспільстві — тому кожен, хто бере участь у ньому, або хто цікавиться його історією та розвитком, повинен щось знати про них. П'ять основних кислот і основ потрапляють в «Топ-20» промислових хімікатів, вироблених в світі. Наступна таблиця показує показники за 2000 рік для США:
| виклик і ранг |
Сірчана кислота - 1 |
Лайм (СаО) |
Фосфорна кислота - 4 |
Аміак |
Гідроксид натрію - 9 |
Азотна кислота - 11 |
|---|---|---|---|---|---|---|
| виробництво в 10, 9 кг | 40 | 20 | 16 | 15 | 11 | 8 |
| основне використання | хімікалії | цемент | добрива | добрива | хімікалії | хімікалії |
Мінеральні кислоти
Цей термін відноситься до будь-якої неорганічної кислоти, але її загальне використання зазвичай обмежується основними сильними кислотами плюс фосфорною кислотою. Основні мінеральні кислоти - сірчана, азотна та соляна - відомі ще з середньовічних часів. Їх відкриття зазвичай приписують перському алхіміку Абу Мусі Джабіру ібн Хайяну, відомому на Заході своїм латиноамериканським ім'ям Гебер. Джабір також винайшов аква регія, суміш азотної та соляної кислот, яка має унікальну здатність розчиняти золото.
Сірчана кислота
Виробляється більше сірчаної кислоти, ніж будь-яка інша промислова хімічна речовина, і це найдешевша промислова кислота у всьому світі. Він безперервно виробляється в США з 1793 року і в Європі набагато довше.

Що ви повинні знати про це
- Чистий безводний H 2 SO 4 являє собою щільну в'язку рідину, яка плавиться при 10,4° C і кипить при температурі близько 300° C, розкладаючись назад на складові, H 2 O і SO 3.
- Кислота піддається автопротолізу
2 Н 2 СО 4 → Н 3 СО 4 + ГСО 4 —
Н 2 СО 4 + 2 NaCl → 2 Na+ SO 4 2— + HCl (г)
С 12 Н 22 О 11 (и) → 12 С (и) + 11 Н 2 О
Н 2 СО 4 + Н 2 СО 4 → ГС 2 О 7 — + Н 3 О +
- Його висока температура кипіння робить кислоту ідеальною для виготовлення інших кислот, таких як азотна та соляна, які є більш летючими; видалення газоподібного продукту призводить реакцію вправо, як передбачено принципом Ле Шательє:
- Сірчана кислота має ненажерливий апетит до води, а значить, є відмінним зневоднюючим засобом. Це видно найбільш ефектно, якщо деяку концентровану кислоту заливають на невелику купу столового цукру; через короткий час виникає енергійна реакція, що призводить до купи пористого, що парить вуглецю
- Сірчана кислота може навіть зневоднювати себе! , деякі з яких були виявлені на поверхні Місяця Юпітера Європи.
- Завдяки описаним вище реакціям автопротолізу та самодегідратації «чиста» сірчана кислота містить щонайменше шість видів меншин на додаток до H 2 SO 4.

Як це робиться
Триоксид сірки, ангідрид сірчаної кислоти, є безпосереднім попередником. Газоподібний SO 3 енергійно реагує з водою, виділяючи багато тепла в процесі:
\[SO_{3(g)} + H_2O_{(l)} → H_2SO_{4(l)}\]
Промислове виробництво кислоти починається з діоксиду сірки, отриманого з спалювання елементарної сірки або отриманого в якості побічного продукту при випалюванні сульфідних руд. Окислення SO 2 до SO 3 виглядає просто
\[SO_{2(g)} + ½ O_{2(g)} → SO_{3(g)}\]
але є кілька ускладнень:
- Всі хімічні реакції протікають швидше при більш високих температурах, але оскільки ця реакція відрізняється високою екзотермічністю, підвищення температури знижує вихід.
- Через зменшення об'єму (1,5 моль газів до 1 моль) підвищення тиску збільшить вихід, тому реакцію проводять при температурі нижче 600°С, але при дуже високому тиску.
- Для прискорення реакції при цих більш низьких температурах використовуються спеціалізовані каталізатори.
- Розчинення SO 3 безпосередньо у воді вивільняло б велику кількість тепла, створюючи туман дрібних крапель кислоти, який би виходив у атмосферу. SO 3 замість цього розчиняється в сірчаній кислоті з утворенням піросірчаної кислоти або олеуму, іноді відомого як димлення сірчаної кислоти:
\[H_2SO_{4(l)} + SO_{3(g)} → H_2S_2O_{7(l)}\]
\[H_2S_2O_{7(l)} + H_2O_{(l)} → 2 H_2SO_{4(l)}\]
- Потім олеум обробляють водою з утворенням промислової (96-98%) сірчаної кислоти:
Для чого він використовується
Сірчана кислота має широкий спектр промислового використання, а річний тоннаж досить тісно слідує за економічним циклом.
- Шістдесят відсотків світового продукту йде на виробництво фосфорної кислоти H 3 PO 4, яка використовується для виготовлення фосфорних добрив і побутових миючих засобів на фосфатній основі.
- Важливе азотне добриво, сульфат амонію (NH 4) 2 SO 4, виготовляється шляхом взаємодії сірчаної кислоти з аміаком, останній часто отримується при термічному розкладанні вугілля.
- Сірчана кислота є основним компонентом травильної кислоти, яка використовується для видалення поверхневої оксидної окалини зі сталі, перш ніж вона виготовляється в сталевий продукт для автомобільної та інших галузей промисловості.
- Сульфат алюмінію (виготовлений з бокситів Al 2 O 3 з H 2 SO 4) широко використовується в паперовій промисловості для коагуляції целюлозних волокон, виробляючи гладку тверду поверхню паперу. Іншим основним застосуванням є виготовлення гідроксиду алюмінію, який використовується для фільтрації твердих частинок у водоочисних спорудах.
- Звична свинцево-кислотна акумуляторна батарея використовує сірчану кислоту в якості електроліту. У міру розряду акумулятора концентрація сірчаної кислоти в електроліті зменшується, оскільки сульфат-іони приймаються як PbSO 4. Завдяки високій щільності кислоти стан заряду акумулятора можна виміряти за допомогою ареометра.
Сірчана кислота в навколишньому середовищі
Acid Rain - спалювання викопних палив, які містять органічні сполуки сірки, виділяє SO 2 в атмосферу. Фотохімічне окислення цієї сполуки до SO 3, яке швидко забирає вологу, призводить до утворення Н 2 SO 4, основного компонента кислотних дощів.
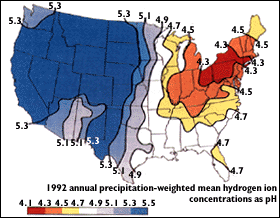
Кислотний дренаж шахти призводить до того, що опади дуже поширеного залізного піриту FeS2 піддаються впливу повітря і окислюються:
ФеС 2 (и) + 7/2 О 2 + Н 2 О → Фе 2 + 2 СО 4 2— + 2 Н +
подальше окислення заліза до Fe 3 + призводить до додаткових реакцій. Отримана дренажна рідина часто має оранжево-коричневий колір і може мати рН нижче нуля.
Азотна кислота
Безводний HNO 3 - це безбарвна рідина, що киплять при 82,6° C, але «чистий» HNO 3 існує лише як тверда речовина, яка плавиться при -41,6° C У рідкому та газоподібному станах кислота завжди частково розкладається на діоксид азоту:
2 ХНО 3 → 2 НЕ 2 + ½ О 2 + Н 2 О
Ця реакція, яка каталізується світлом, припадає на коричневий колір розчинів HNO 3.
Що ви повинні знати про це
- HNO 2 піддається автопротолізу більшою мірою, ніж будь-яка інша рідина. Подальші реакції кон'югатної кислоти H 2 NO 3 + з HNO 3 призводять до складної суміші видів в рідині.
- Розбавлену азотну кислоту можна концентрувати дистиляцією максимум до 68%, в цей момент вона утворює постійно-киплячу (азеотропну) суміш з водою. Більш високі концентрації вимагають зневоднення сірчаною кислотою; результатом є димлення азотної кислоти.
- «Концентрована азотна кислота» продається у вигляді 70% розчину у воді, що відповідає концентрації близько 16М.
- Азотна кислота є дуже сильним окислювачем, який додає її корозійної поведінки з органічними матеріалами, включаючи, звичайно, шкіру, яка жовтіє внаслідок реакції з білком кератином. Реакції з багатьма органічними сполуками дуже екзотермічні і часто бурхливі. Добре відома реакція азотної кислоти з металевою міддю виробляє велику кількість коричневого газу двоокису азоту.

Як це робиться
Найпростішим методом, який застосовувався промислово до 1900 року, була обробка нітратом натрію («Чилійська селітра», NaNO 3) сірчаною кислотою. Безпосередній синтез кислоти з атмосферного азоту і кисню термодинамічно сприятливий
½ Н 2 + 5/4 О 2 + ½ Н 2 О → ХНО 3
але кінетично перешкоджає надзвичайно висока енергія активації, факт, за який ми можемо бути найбільш вдячними (див. Бічна панель.) Перший промисловий процес фіксації азоту, розроблений в 1903 році, використовував цю реакцію для отримання азотної кислоти, але він вимагав використання електричної дуги для подачі енергії активації і тому був занадто енергоємним, щоб бути економічним.
Примітка
Якби не висока енергія активації, необхідна для підтримки цієї реакції, весь кисень в атмосфері споживався б, а океани були б розбавленим розчином азотної кислоти.
Сучасний процес Оствальда передбачає каталітичне окислення аміаку до оксиду азоту NO, який окислюється на подальшій стадії до NO 2; реакція останнього з водою дає HNO 3. Цей маршрут, вперше розроблений в 1901 році, не став практичним до масштабного виробництва аміаку процесом Хабер-Бош в 1910 році.
Для чого він використовується
Основними промисловими видами використання азотної кислоти є виробництво добрив аміачної селітри, а також у виробництві вибухових речовин. У значно невеликих масштабах кислота використовується при травленні металів, травленні напівпровідників і електронних друкованих плат, а також у виробництві акрилових волокон.
У лабораторії кислота знаходить застосування в самих різних ролей.
У навколишньому середовищі
Високотемпературні процеси згоряння (в двигуні внутрішнього згоряння, електростанціях та спалювальних установках) можуть окислювати атмосферний азот до оксиду азоту (NO) та інших оксидів («NO x «); потім NO фотоокислюється до NO 2, який реагує з водою з утворенням HNO 3 який є основним компонентом кислотних дощів. NO 2 є основним попередником фотохімічного смогу.
Соляна кислота
На відміну від інших основних кислот, немає такої речовини, як «чиста» соляна кислота; те, що ми називаємо «соляною кислотою», є лише водним розчином хлористого водню (bp -84°C). Але в якомусь сенсі вона більш «чиста», ніж розглянуті вище кислоти, так як немає автопротолізу; іони гідроній і хлорид є єдиними значущими видами в розчині. Соляна кислота зазвичай продається у вигляді 32-38% (12M) розчину HCl у воді; концентрації, більші за це, відомі як димлення соляної кислоти.
Примітка
Соляна кислота до сих пір іноді продається під своєю давньою назвою соляна кислота для чищення цегли та інших побутових цілей. Назва походить від того ж кореня, що і морський, відображаючи його приготування з солі.
Кислота була відома хімікам (і алхімікам), і використовується в промислових цілях ще з середньовіччя. Свій склад HCl був продемонстрований Хамфрі Деві в 1816 році.
Що ви повинні знати про це
- Соляна кислота є найменш небезпечною з сильних мінеральних кислот для роботи, оскільки на відміну від інших, вона не є окислювачем. Зазвичай це кислота вибору для титрування та інших операцій, в яких основною вимогою є просто сильне джерело іонів водню.
- Концентрована кислота закипає при 48°С, при тривалому кипінні втрачає HCl і температура кипіння підвищується до 109°С, після чого залишається постійно-киплячий (азеотропний) розчин, що складається з 20,2% HCl.

Для чого він використовується
Використання соляної кислоти занадто багато, щоб перерахувати окремо, але виділяються наступні:
- Основним промисловим застосуванням є видалення поверхневої окалини із заліза або сталі («травлення») перед тим, як вона буде оброблена в листи або інші форми, або оцинкована або покрита.
- Виробництво хлорованих органічних хімічних речовин, зокрема вінілхлориду, поліуретанів та інших будівельних полімерів, споживає величезну кількість HCl.
- Кислота широко використовується для контролю рН води, включаючи нейтралізацію стічних потоків, і для регенерації іонообмінних пом'якшувачів води.
Як це робиться
Стародавній метод обробки солі сірчаною кислотою для виділення HCl вже давно витіснився більш ефективними процесами, в тому числі прямим синтезом шляхом «спалювання» водневого газу в хлорі:
\[H_{2(g)} + Cl_{2(g)} \rightarrow 2 HCl_{(g)}\]
Більшість виробництва соляної кислоти в даний час відбувається з регенерації побічного продукту хлористого водню з інших процесів, особливо пов'язаних з виробництвом промислових органічних сполук.
2 Лужні метали
Термін луг зазвичай означає основну сіль групи 1 або 2 («луг» або «лужноземельний») металу. Всі луги, звичайно, є основами, але останній термін є набагато більш загальним, чи визначається відповідно до концепцій Арренія, Бронстеда-Лоурі або Льюїса. Слово луг походить від арабського al-qali, що відноситься до золи, з якої гідроксиди натрію і калію (поташ, «попіл, що залишився в горщику», і походження назви елемента калій) були витягнуті як крок у виготовленні мила.
Гідроксид натрію
Чистий гідроксид натрію являє собою біле тверде тіло, що складається з Na+ і OH — іонів в кристалічній решітці. Незважаючи на те, що він широко розглядається як іонне тверде тіло, сили ван дер Ваальса вносять істотний внесок у його стабільність.
Що ви повинні знати про це
- Завдяки його розпливу (здатності вбирати вологу) і схильності реагувати з вуглекислим газом тверде речовина повинна зберігатися в закритій тарі.
- У промисловості гідроксид натрію широко відомий як каустична сода або просто як їдкий; NaOH, що продається для побутових цілей, зазвичай відомий як луг.
- Гідроксид натрію повільно атакує скло з утворенням силікату натрію. Скляні посудини, що використовуються для зберігання концентрованих розчинів, поступово утворюють каламутне покриття зсередини.
- Деякі метали, зокрема алюміній, цинк і титан, реагують з сильно лужними розчинами, але залізо і мідь несприйнятливі до такого роду атак.
- Високолужні розчини також пом'якшують і розчиняють шкіру, враховуючи слизьке відчуття, пов'язане з міцними основами. Гідроксид натрію колись використовувався для утилізації тушок тварин, перетравлюючи їх у легко одноразову рідку форму.
Як це робиться
Гідроксид натрію в даний час виробляється електролізом розсольних розчинів, і поряд з хлором, є одним з двох основних продуктів хлорлужної промисловості.
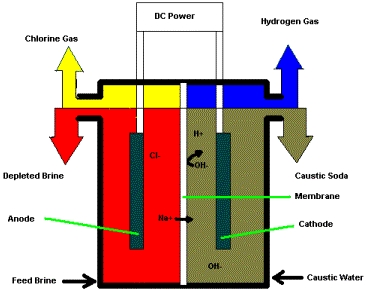
Електроліз водного NaCl виробляє Cl 2 на аноді, але оскільки H 2 O може бути відновлений легше, ніж Na +, вода розкладається до Н 2 і ОН — на катоді, залишаючи розчин NaOH. Старіший процес ртутних клітин зменшує Na + до Na в межах ртутної амальгами (сплаву), а металевий натрій потім поєднується з водою для отримання NaOH та водню. Чиста реакція на крок зменшення однакова для обох методів:
\[2 Na^+ + 2 H_2O + 2e^– \rightarrow H_{2(g)] + 2 NaOH\]
Отриманий розчин зазвичай випарюють до такої високої концентрації, що він твердне при звичайних температурах. Зазвичай його відвантажують у залізничних вагонів або баржах, які можна нагрівати парою для розрідження суміші для видалення. (Очевидно, неекономічно доставляти велику кількість води по всій країні!)
Для чого він використовується
- Гідроксид натрію є одним з найрізноманітніших промислових хімічних речовин з точки зору його застосування. Більшість домогосподарів знають його як активний інгредієнт засобів для чищення зливу.
- Величезні кількості споживаються целюлозно-паперовою промисловістю, що, мабуть, є її єдиним найбільшим специфічним промисловим застосуванням. Він використовується для видалення лігнінового компонента деревної маси з целюлози, щоб остання могла бути перероблена в папір.
- Близько половини виробництва NaOH йде на виробництво найрізноманітніших інших промислових хімічних речовин, а також на знежирення сталевих барабанів та інших промислових поверхонь.
- «Луг» відіграє певну роль у переробці багатьох видів харчових продуктів, включаючи шоколад, оливки, кренделі та кукурудзяні продукти «мамалиги» та «крупи», що використовуються на півдні США.

Економічний поштовх і тяга їдкого і хлору
На відміну від надзвичайно різноманітного застосування гідроксиду натрію, що робить попит на цей товар відносно несприйнятливим до підйомів і падінь економічного циклу, споживання хлору безпосередньо залежить від економіки, що відображається в попиті на полівінілхлоридні продукти, які зараз широко використовується в будівельній та побутовій промисловості. Оскільки хлор, будучи газом, дорогий для зберігання, випуск хлорлужної промисловості в значній мірі регулюється попитом на цей товар. Коли часи хороші, це не представляє жодних проблем; їдкий матеріал є значною мірою побічним продуктом і може бути легко накопичений, якщо пропозиція перевищує попит. Але під час економічного спаду попит на хлор знижується, обмежуючи його виробництво разом з їдким. Але оскільки попит на їдкий, як правило, знижується набагато менше, він стає дефіцитним, а його ціна зростає, таким чином, як правило, загнати промислову економіку в ще глибші неприємності.
Карбонат натрію
Ця сполука відома промислово як кальцинована сода, а всередині країни - як промивна сода. Поширеною формою є гептагідрат, Na 2 CO 3 ·7 H 2 O. Білі кристали цієї речовини мимовільно втрачають воду (висоли) при впливі повітря, утворюючи моногідрат.
Для чого він використовується
- Хоча карбонати є набагато слабшими основами, ніж гідроксиди, розчин карбонату натрію все ще може мати рН 11 або близько того, досить високий, щоб дозволити йому замінити гідроксид натрію в багатьох додатках - особливо коли ціна їдкого є високою.
- Єдиним найважливішим застосуванням кальцинованої соди є виготовлення скла, де вона служить для зниження температури плавлення основного компонента, SiO 2.
- Іншим новим основним застосуванням є нейтралізація викидів SO 2 електростанцій, що спалюють викопне паливо.
- Більш давнє використання карбонату натрію в якості миючого засобу (звідси і назва промивної соди) було засновано частково на здатності його лужних розчинів емульгувати жир, але головним чином як засіб осадження нерозчинних карбонатів кальцію і магнію перед цими іонами (зазвичай присутні в жорсткій воді) могли утворюватися небажані осади з милом. Використання сучасних миючих засобів багато в чому усунуло цей колись важливий ринок.

Як це робиться
Більша частина світового карбонату натрію виробляється за допомогою аміачно-содового процесу «Solvay», розробленого в 1861 році бельгійським хіміком Ернестом Солвеєм (1838-1922), патенти якого зробили його великим промисловцем і багатим філантропом. Цей процес включає в себе набір простих реакцій, які по суті перетворюють вапняк (CaCo 3), аміак NH 3 і розсіл (NaCl) в бікарбонат натрію NaHCO 3 і врешті-решт Na 2 CO 3, переробляючи кілька проміжних продуктів геніальним способом.

Незначним джерелом кальцинованої соди (але досить значним у деяких країнах, таких як США) є видобуток природних випаровувачів (залишків стародавніх озер), таких як трона, знайдена в Південній Каліфорнії.
Аміак
Аміак NH 3, звичайно, не є справжнім лугом, але його зручно включати в цей розділ для обговорення. Більшість людей знайомі з різким запахом цього газу, який можна виявити при концентраціях до 20-50 проміле.
Традиція вмирає повільно: неіснуюча хімічна речовина, доступне в пляшках!
Що ви повинні знати про це
- Виготовляється більше родимок аміаку, ніж будь-якого іншого промислового хімікату.
- Аміак надзвичайно розчинний у воді. Водний розчин аміаку все ще іноді називають в торгівлі як «гідроксид амонію», але цей термін більше не підтримується хіміками, тому що жодна така сполука, як NH 4 OH, ніколи не було показано, що існує. При нейтральному рН близько 99% аміаку у воді існує у вигляді іонів NH 4 +.
- Аміак є кінцевим продуктом азотного обміну в більшості організмів. Одним з джерел, який може бути знайомий батькам немовлят, є бактеріальне розкладання вмісту підгузників.
- Рідкий аміак (bp -33° C) часто використовується як іонізуючий лабораторний розчинник.
Для чого він використовується
- Основне використання аміаку (близько 80%) - це добриво, найчастіше як безводний аміак (газ вводиться безпосередньо в грунт) або після перетворення в (NH 4) 2 SO 4, NH 4 NO 3 або сечовину O-C (NH 3) 2.
- Аміак використовується у виробництві численних полімерів, в тому числі нейлонів і поліуретанів.
- На виробництво вибухових речовин припадає близько 5% виробництва аміаку.
- Крім них, є сотні незначних застосувань, в тому числі як побутової миючий засіб (аква аміак). холодоагент, і як лабораторний реагент.
Як це робиться
Аміак виробляється шляхом безпосереднього синтезу з елементів:
\[N_{2(g)} + 3 H_{2(g)} \rightarrow 2 NH_{3(g)}\]
... проста на вигляд реакція, але така, яка потребувала дуже творчої роботи для реалізації; процес Хабера-Босха вважається найважливішим хімічним синтезом 20-го століття.
3 Деякі важливі органічні кислоти
Більшість кислот є органічними - їх мільйони. Кисла функція, як правило, є гідроксильною групою, з'єднаною з вуглецем, який пов'язаний з атомом кисню, що відводить електрон; комбінація є відомою карбоксильною групою, —COOH. Ось декілька, які є частиною життя кожного.
оцтова кислота
Це поруч з мурашиною кислотою в тому, що є найпростішою з органічних кислот, а у вигляді оцту (5-8% розчин у воді) її характерний запах відомий кожному. Чиста кислота - це безбарвна рідина вище 16,7° C; нижче цієї температури вона утворює кристалічну тверду речовину, звідси і термін «льодовикова оцтова кислота», який зазвичай застосовується до чистої речовини. Назва кислоти походить від acetum, латинського слова оцту.

Що ви повинні знати про це
- Чиста кислота, хоча і досить слабка в протонно-донорському сенсі, досить корозійна, а її пари дуже дратують.
- 1,0 М розчин кислоти має рН близько 2,4, що відповідає лише чотирьом з кожної тисячі молекул CH 3 COOH, що дисоціюються.
Для чого він використовується
Трохи менше половини світового виробництва оцтової кислоти йде на виробництво полімерів. Кінцевим продуктом, видимим для більшості людей, будуть гнучкі пластикові пляшки, в яких продається питна вода. Інші види використання пов'язані здебільшого з виробництвом інших хімічних речовин, головним чином оцтового ангідриду, але також включаючи аспірин.

Як це робиться
Бактеріальне бродіння цукрів було джерелом оцту з давніх часів, і до цих пір припадає більшість харчової оцтової кислоти та оцту, але зараз вона становить лише близько 10% від загального виробництва оцтової кислоти:
С 6 Ч 12 О 6 → 3 СН 3 КУН
Існує кілька важливих синтетичних шляхів до виробництва оцтової кислоти, але основним з них є обробка метанолу чадним газом:
СН 3 ОН + СО → СН 3 СООН

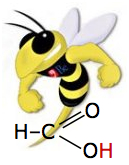 Мурашина кислота
Мурашина кислота Щавлева кислота
Щавлева кислота

 Тут немає карбоксильних груп, але вуглець групи —OH один від подвійного зв'язку все ще досить кислий. Один з його геометричних ізомерів, L-аскорбінова кислота, більш широко відомий як вітамін С; відкриття важливої ролі цієї речовини у запобіганні цинги хвороби (від якої походить її назва) дало дві Нобелівські премії в 1937 році. Більшість тварин здатні синтезувати власний вітамін С, але примати (разом з морськими свинками), схоже, втратили необхідний ген десь по дорозі, тому ми повинні залежати від фруктів і овочів для нашого постачання. (Оскільки аскорбінова кислота розчинна у воді, вона, як правило, вилуговується з овочів, коли вони варяться, тому їх набагато здоровіше парити.)
Тут немає карбоксильних груп, але вуглець групи —OH один від подвійного зв'язку все ще досить кислий. Один з його геометричних ізомерів, L-аскорбінова кислота, більш широко відомий як вітамін С; відкриття важливої ролі цієї речовини у запобіганні цинги хвороби (від якої походить її назва) дало дві Нобелівські премії в 1937 році. Більшість тварин здатні синтезувати власний вітамін С, але примати (разом з морськими свинками), схоже, втратили необхідний ген десь по дорозі, тому ми повинні залежати від фруктів і овочів для нашого постачання. (Оскільки аскорбінова кислота розчинна у воді, вона, як правило, вилуговується з овочів, коли вони варяться, тому їх набагато здоровіше парити.)
 Сама кислота виявилася трохи занадто великим подразником слизової оболонки шлунка, тому німецька фірма Bayer почала продавати приручену версію, ацетилсаліцилову кислоту (ASA) під назвою Аспірин в 1899 році, і з тих пір вона йде сильною. Цікаво, що детальна хімія його дії, що переживає біль і лихоманку, не була виявлена до 1970 року.
Сама кислота виявилася трохи занадто великим подразником слизової оболонки шлунка, тому німецька фірма Bayer почала продавати приручену версію, ацетилсаліцилову кислоту (ASA) під назвою Аспірин в 1899 році, і з тих пір вона йде сильною. Цікаво, що детальна хімія його дії, що переживає біль і лихоманку, не була виявлена до 1970 року.
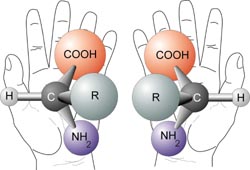
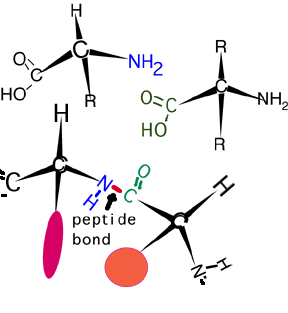 Частина карбонової кислоти однієї амінокислоти може реагувати з амінною частиною іншої, утворюючи пептидний зв'язок (амідний зв'язок), показаний тут.
Частина карбонової кислоти однієї амінокислоти може реагувати з амінною частиною іншої, утворюючи пептидний зв'язок (амідний зв'язок), показаний тут.