10.4: Кислотно-лужні реакції
- Page ID
- 19269
Особливо важливо, щоб ви знали точні значення всіх виділених термінів в контексті даної теми.
- Намалюйте протонну енергетичну діаграму для сильної кислоти, слабкої кислоти або основи, а також для міцної основи.
- Опишіть, як рН впливає на відносні концентрації кон'югатної кислотно-лужної пари.
Чи буде ця кислота реагувати з цією основою? І якщо так, то в якій мірі? На ці питання можна відповісти кількісно, провівши докладні розрахунки рівноваги, про які ви дізнаєтеся в іншому уроці. Однак сучасна кислотно-лужна хімія пропонує кілька простих принципів, які можуть дати можливість прийняти якісне рішення з першого погляду. Що ще важливіше, ідеї, які ми розробляємо в цьому розділі, гарантовано дадуть вам набагато краще концептуальне розуміння кислотно-лужних реакцій на основі протонів загалом.
На яку основу потрапляє протон?
Чи реагує кислота ГК з основою B? Вище ми заявляли, що результат будь-якої кислотно-лужної реакції залежить від того, наскільки добре дві різні основи можуть конкурувати в перетягуванні каната за протон.
\[A^– \leftarrow H^+\rightarrow B^– \label{9.4.1}\]
Протон завжди буде йти на більш міцну основу. Деяке розуміння цього можна мати, думаючи про протон як про різні потенційні енергії, коли він пов'язаний з різними акцепторами. Можна провести корисну аналогію з електронами в атомі, які, нагадаєте, завжди будуть потрапляти на найбільш низькопотенційні енергетичні орбіталі доступні, заповнюючи їх знизу вгору. Аналогічним чином протони будуть «потрапляти» в найменш енергетичні порожні місця (бази), які вони можуть знайти.
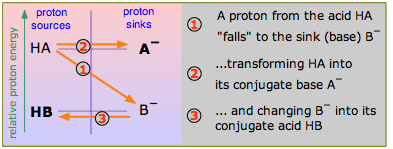
Розглянемо наведену тут схему, на якій зображені дві гіпотетичні спряжені пари кислотно-лужних. Уважно зверніть увагу на маркування цієї діаграми: кислоти HA та HB є джерелами протонів, а сполучені основи A - і B - є протонами. Ця термінологія «джерело-раковина» є синонімом мови «донор-акцептор», яку нас навчив Бронстед, але вона також має на увазі відносні енергії протона, оскільки він існує в двох молекулах HA та HB. Якщо, як зазначено тут, протон має більш високу «потенційну енергію», коли він знаходиться у формі ГК, ніж у HB, реакція HA + B - → HB + A - буде сприятлива порівняно зі зворотним процесом HB + A - → HA + B -, що вимагатиме підняття протона до A — рівень. У цьому прикладі ГК є сильнішою кислотою, оскільки її протон може впасти до нижчої потенційної енергії, коли він з'єднується з B - утворюючи НВ.
Ми будемо називати діаграми, такі як на малюнку,\(\PageIndex{1}\) як «діаграми протонної енергії», що не зовсім правильно, але ми не хочемо потрапляти в термодинаміку в цей момент. (Якщо ви вже знаєте щось про хімічну термодинаміку, ми дійсно маємо на увазі енергію Гіббса. )
Звідси випливає, що якщо ми зможемо розташувати всі загальні кислотно-лужні сполучені пари за такою шкалою, ми можемо передбачити напрямок будь-якої простої кислотно-лужної реакції, не вдаючись до чисел. Це буде проілюстровано далі, але для того, щоб все було просто, давайте розглянемо кілька діаграм протонної енергії, які ілюструють деякі кислотно-лужні хімії, які ми обговорювали в попередньому розділі.
Сильні кислоти і слабкі кислоти
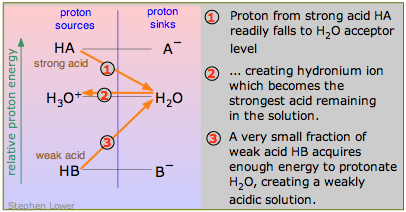
Іон гідронію є ділильної лінією; сильна кислота, ви згадаєте, - це та, кон'югатна основа якої А — програє «сильнішому» підставі Н 2 О в конкуренції за протон:
\[A^– \leftarrow H^+ \rightarrow H_2O \label{9.4.2}\]
Кислота, яка є сильнішим донором протонів, ніж іон гідронію, є «сильною» кислотою; якщо вона є слабшим донором протонів, ніж H 3 O +, це за визначенням «слабкий». Це найбільш чітко видно на діаграмі тут, яка контрастує сильну кислоту ГК зі слабкою кислотою HB. HB «дисоціює» лише в крихітній мірі, оскільки енергетично несприятливо просувати свій протон до рівня H 2 O-H 3 O + (процес 3 на діаграмі).
Сильні кислоти і вирівнювання
Сильна кислота, ви згадаєте, та, кон'югатна основа якої А — програє «більш сильній» основі Н 2 О в конкуренції за протон:
\[A^- ← H^+→ H_2O \label{9.4.3}\]
Тому що реакція
\[HA + H_2O \rightarrow A^–+ H_3O^+ \label{9.4.4}\]
для будь-якої сильної кислоти ГК практично повна, всі сильні кислоти виявляються однаково сильними у воді (вирівнюючий ефект).
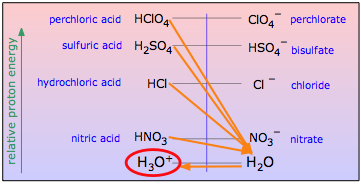
З точки зору протонної енергії сильна кислота - це та, в якій енергія протона значно більша при приєднанні до аніону А - ніж коли він прикріплений до Н 2 О. Додавання сильної кислоти HA до води поставить його в контакт з величезною протонною раковиною, яка стікає з протонів. з будь-якої такої кислоти, залишаючи кон'югатну основу А — поряд з іоном гідронію, найсильнішою кислотою, яка може існувати у воді.
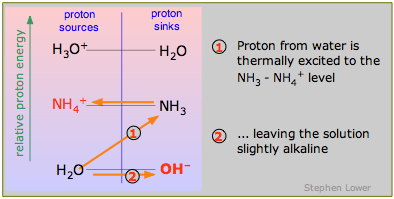
слабкі підстави
Кон'югатні підстави слабких кислот схильні приймати протони з води, залишаючи невеликий надлишок ОН — іонів і, таким чином, лужний розчин. Як видно на схемі, слабке підставу аміаку приймає протон з води:
\[NH_3 + H_2O \rightarrow NH_4^+ + OH^– \label{9.4.6}\]
«Слабкість» такої основи є наслідком енергетично несприятливого процесу (1), при якому протон повинен підніматися вгору з низько лежачого Н 2 О-ОН — рівня. З точки зору колонки «протонові джерела» зліва можна вважати це схожим на ситуацію для слабких кислот, про яку ми говорили вище; це можна вважати окремим випадком, в якому слабкою кислотою є Н 2 О.
Найслабша кислота і найсильніша основа
Дуже довго хіміки вважали метан СН 4 найслабшою кислотою, що робить метид-іон СН 3 - (який також є найпростішим карбоніоном) найміцнішою основою. Метан все ще утримує свою позицію як найслабша кислота, але в 2008 році іон LiO - виявився ще сильнішою основою, ніж CH 4 -. Оскільки обидві ці основи спостерігаються лише у газовій фазі, ці факти мають мало очевидного імпорту на хімію водного розчину.
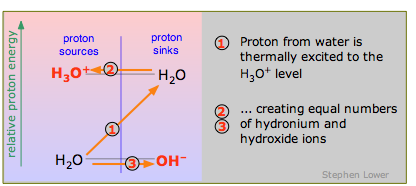
Автопротоліз
Оскільки вода амфіпротична, одна молекула H 2 O може пожертвувати протон іншій, як пояснювалося вище. У цьому випадку протон повинен придбати значну енергію, щоб зробити стрибок (1) з H 2 O-OH - рівня H 3 O + -H 2 O, тому реакція
\[2 H_2O \rightarrow H_3O^++ OH^– \label{9.4.7}\]
відбувається лише хвилинною мірою. Подумайте про це як про особливий випадок «найслабшої» кислоти H 2 O, що вступає в реакцію з «найслабшою» основою Н 2 О.
Міцні підстави
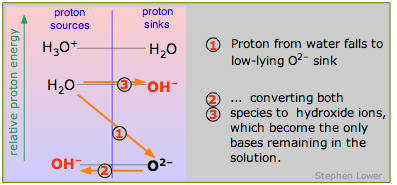
Нарешті, що таке сильна основа? Подібно до того, як сильна кислота лежить вище рівня H 3 O + -H 2 O, так і сильна основа лежить нижче рівня H 2 O-OH -. І з тієї ж причини, що Н 3 О + є найсильнішою кислотою, яка може існувати у воді, ОН — це найсильніша основа, яка може існувати у воді. Приклад оксидного іона O 2— показаний тут. Оксид натрію Na 2 O - білий порошок, який розчиняється у воді, даючи оксидні іони, які негайно розкладаються на гідроксидні іони.
\[O^{2–} + H_2O \rightarrow 2 OH^– \label{9.4.8}\]
Склавши все разом, і значення рН
Ця таблиця об'єднує поширені приклади, що охоплюють весь спектр кислотно-лужних сильних сторін, від сильних до дуже слабких. Енергетична шкала зліва дає вам деяке уявлення про відносні рівні протонної енергії для кожної сполученої пари; зверніть увагу, що нуль довільно встановлений на нуль пари H 3 O + -H 2 O.
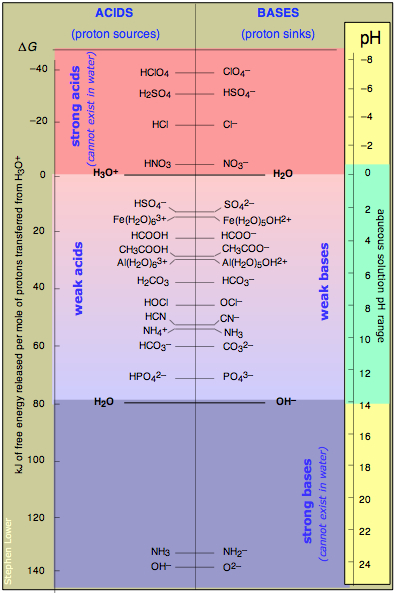
Більше значення має шкала рН справа. РН, який відповідає будь-якій кон'югатній парі, - це рН, при якому рівні концентрації цієї пари знаходяться в їх кислотній та базовій формах. Наприклад, оцтова кислота СН 3 СООН «наполовину іонізується» при рН 4,7. Якщо додати іншу сильну кислоту, таку як HCl, щоб зменшити рН, частка ацетатного іона зменшується, тоді як якщо додати гідроксид натрію, щоб змусити рН вище, більша частка оцтової кислоти буде «дисоційована».
Це ілюструє ще один аспект рН: на його найбільш фундаментальному рівні рН є зворотною мірою «інтенсивності протонів» в розчині. Чим нижче рН, тим вище інтенсивність протонів, і тим більшою буде частка заселених рівнів протонів вищої енергії - що означає більш високі співвідношення концентрації кислоти до кон'югатної основи. Легко зрозуміти, чому кислоти, такі як H 2 SO 4 та основи, такі як амід-іон NH 2 - не можуть існувати у водному розчині; рН повинен бути на неможливому рівні -6 для першого та +23 для останнього!
Чому кислоти титруються гідроксид-іоном
Коли ви титруєте кислоту основою, ви хочете, щоб практично кожна молекула кислоти реагувала з основою. У випадку слабкої кислоти, такої як хлорноватиста, реакція буде
\[HOCl + OH^– \rightarrow OCl^– + H_2O \label{9.4.9}\]
Оскільки рівень протонів у HoCl значно перевищує рівень H 2 O, титрування розчином NaOH забезпечить з'їдання кожного останнього протона іоном гідроксиду. Якщо замість цього ви використовували аміак NH 3 як титрант, близькість двох рівнів протонів призведе до того, що реакція буде неповною, що дасть менш виразну точку еквівалентності. І, звичайно, титрування основою, яка слабша, ніж іон гіпохлориту (наприклад, бікарбонат натрію) було б безнадійним.
Як практичне питання, зазвичай можна оцінити, що коли рН відрізняється більш ніж на дві одиниці від значення, яке відповідає кон'югат-парі для монопротової кислоти, концентрація несприятливих видів знизиться приблизно в 1000 разів.
