4.4: Хімічні рівняння та стехіометрія
- Page ID
- 19238
Переконайтеся, що ви добре розумієте наступні основні ідеї
- З огляду на формули реагентів і продуктів, напишіть збалансоване хімічне рівняння для реакції.
- З огляду на відносні розчинності, написати збалансоване чисте іонне рівняння для реакції між водними розчинами двох іонних сполук.
- Напишіть відповідні хімічні коефіцієнти перетворення для розрахунку маси всіх компонентів хімічної реакції, коли маса будь-якого окремого компонента вказана в будь-якій системі одиниць. і знайти маси всіх присутніх компонентів, коли реакція завершена.
- Опишіть спосіб, яким поняття граничного реагенту відноситься до горіння та фізичних вправ людини.
Хімічне рівняння виражає чисту зміну складу, пов'язану з хімічною реакцією, показуючи кількість молів реагентів і продуктів. Але оскільки кожен компонент має свою молярну масу, рівняння також неявно визначають спосіб спорідненості мас продуктів та реагентів. У цьому підрозділі ми зосередимося на розумінні та використанні цих масових відносин.
При хімічній реакції один або кілька реагентів перетворюються в продукти:
реагенти → продукти
Мета хімічного рівняння - висловити це співвідношення за формулами фактичних реагентів і продуктів, що визначають ту чи іншу хімічну зміну. Наприклад, реакція ртуті з киснем для отримання оксиду ртуті була б виражена рівнянням
Hg + О 2 → ГГо 2
Іноді для зручності бажано вказати фізичний стан (газовий, рідкий або твердий) одного або декількох видів відповідними скороченнями:
Hg (л) + O 2 (г) → HgO (2 с)
С (графіт) + O 2 (г) → СО 2 (г)
С (алмаз) + О 2 (г) → СО 2 (г)
Однак це завжди необов'язково.
Як читати і писати хімічні рівняння
Хімічне рівняння - це констатація факту: воно виражає чисту зміну, що відбувається в результаті хімічної реакції. При цьому він повинен відповідати закону збереження маси:

У контексті звичайної хімічної реакції збереження маси означає, що атоми ні створюються, ні руйнуються. Ця вимога легко задовольняється, переконавшись, що по обидва боки рівняння є рівні числа всіх атомів.
Коли ми збалансуємо рівняння, ми просто робимо його узгодженим із спостережуваним фактом, що окремі атоми зберігаються в хімічних змінами. Не існує встановленого «рецепту» для балансування звичайних хімічних рівнянь; найкраще почати з ретельного вивчення обраних прикладів, таких як наведені нижче.
Напишіть збалансоване рівняння для згоряння пропану С 3 Н 8 в кисні O 2. Продукцією є вуглекислий газ СО 2 і вода Н 2 О.
Рішення
Почніть з написання незбалансованого рівняння
\[C_3H_8 + O_2 → CO_2 + H_2O \nonumber\]
Зазвичай найкраще почати з балансування сполук, що містять найменш рясний елемент, тому спочатку збалансуємо рівняння для вуглецю:
С 3 Н 8 + О 2 → 3 СО 2 + Н 2 О
Врівноважуючи кисень, ми бачимо, що немає ніякого способу, щоб парна кількість молекул O 2 зліва могла дати нерівномірну кількість атомів O, показаних праворуч. Не турбуйтеся про це now— просто використовуйте відповідний дробовий коефіцієнт:
С 3 Н 8 + 3 ½ О 2 → 3 СО 2 + Н 2 О
Нарешті, ми збалансуємо водні, додаючи більше води праворуч:
С 3 Н 8 + 7/2 О 2 → 3 СО 2 + 4 Н 2 О
Ах, але тепер кисень знову вимкнений - фіксація цього також дозволяє нам позбутися фракції з лівого боку:
С 3 Н 8 + 5 О 2 → 3 СО 2 + 4 Н 2 О
Однак часто трапляється, що ми закінчуємо дробовим коефіцієнтом, як у цьому варіанті наведеного вище прикладу.
Напишіть збалансоване рівняння для згоряння етану С 2 Н 6 в кисні O 2. Продукцією є вуглекислий газ СО 2 і вода Н 2 О.
Рішення
Почніть з написання незбалансованого рівняння
С 2 Н 6 + О 2 → СО 2 + Н 2 О
... тоді збалансуйте вуглець:
С 2 Н 6 + О 2 → 2 СО 2 + Н 2 О
Давайте збалансуємо водень далі:
С 2 Н 6 + О 2 → 2 СО 2 + 3 Н 2 О
... але тепер нам потрібно неінтегральне число молекул диоксигену зліва:
С 2 Н 6 + 7/2 О 2 → 2 СО 2 + 3 Н 2 О
Моя перевага полягає в тому, щоб просто залишити його в такому вигляді; немає нічого поганого в 7/2 = 3 ½ молі O 2, і мало що можна отримати, множивши кожен член на два - не якщо тільки ваш вчитель є справжнім наклейником для того, щоб зробити це «за книгою», і в цьому випадку вам краще написати
2 С 2 Н 6 + 7 О 2 → 4 СО 2 + 6 Н 2 О
Чисті іонні рівняння
Іонні сполуки зазвичай дисоціюються у водному розчині; таким чином, якщо ми поєднуємо розчини нітрату срібла AgNO 3 та хлориду натрію NaCl, ми дійсно поєднуємо чотири різні види: катіони (позитивні іони) Ag + і Na + та аніони ( негативні іони) NO 3 - і Cl -. Буває, що при зведенні іонів Ag + і Cl — вони об'єднаються, утворюючи нерозчинний осад хлориду срібла. Чисте рівняння для цієї реакції
\[Ag^+_{(aq)} + Cl^–_{(aq)} → AgCl_{(s)}\]
Зауважте, що
- іони NO 3 — і Cl — не беруть безпосередньої участі в цій реакції; рівняння виражає лише чисту зміну, яка полягає у видаленні іонів срібла і хлориду з розчину з утворенням нерозчинного твердого тіла.
- символ (aq) означає, що іони знаходяться у водному розчині, і, таким чином, гідратовані, або прикріплені до молекул води.
- символ (и) вказує на те, що речовина AgCl існує у вигляді твердого тіла. Коли тверда речовина утворюється в реакції, яка протікає в розчині, вона відома як осад. Про утворення осаду часто вказує підкреслення.
З наведеного вище прикладу за участю хлориду срібла зрозуміло, що значуще чисте іонне рівняння можна записати тільки в тому випадку, якщо два іони об'єднуються, утворюючи нерозчинну сполуку. Щоб зробити це визначення, допомагає знати правила розчинності - які всі студенти хімії колись повинні були запам'ятати, але в даний час зазвичай отримують з таблиць, таких як наведена нижче.
| Аніон (негативний іон) | Катіон (позитивний іон) | Розчинна? |
|---|---|---|
| будь-який аніон | іони лужних металів (Li +, Na +, K + та ін.) |
так
|
| нітрат, NO 3 — | будь-який катіон |
так
|
| ацетат, СН 3 СОО — | Будь-який катіон, крім Ag + |
так
|
| галогенідні іони Cl —, Br —, або I — | Аг +, Пб 2 +, Хг 2 2 +, Су 2 + |
ні
|
| галогенідні іони Cl —, Br —, або I — | будь-який інший катіон |
так
|
| сульфат, SO 4 2— | Са 2 +, Ср 2 +, Ба 2 +, Аг +, Пб 2 + |
ні
|
| сульфат, SO 4 2— | будь-який інший катіон |
так
|
| сульфід, S 2 — | іони лужних металів або NH 4 + |
так
|
| сульфід, S 2 — | Бути 2 +, Мг 2 +, Са 2 +, Ср 2 +, Ба 2 +, Ра 2 + |
так
|
| сульфід, S 2 — | будь-який інший катіон |
ні
|
| гідроксид, ОН — | іони лужних металів або NH 4 + |
так
|
| гідроксид, ОН — | Ср 2 +, Ба 2 +, Ра 2 + |
злегка
|
| гідроксид, ОН — | будь-який інший катіон |
ні
|
| фосфат, PO 4 3—, карбонат CO 3 2— | іони лужних металів або NH 4 + |
так
|
| фосфат, PO 4 3—, карбонат CO 3 2— | будь-який інший катіон |
ні
|
Напишіть чисті іонні рівняння для того, що відбувається при поєднанні водних розчинів наступних солей:
- ПБКЛ 2 + К 2 СО 4
- К 2 СО 3 + Ср (НІ 3) 2
- ЛаКЛ 3 + АСО 4
- Na 3 ПО 4 + СаСл 2
Скористайтеся таблицею правил розчинності (вище), щоб знайти нерозчинні комбінації:
- Пб 2 + (ак) + СО 4 2— (ак) → ПбСО 4 (и)
- Ср 2 + (ак) + СО 3 2— (ак) → СрКо 3 (с)
- немає чистої реакції
- 3 Са 2 + (ак) + 2 ПО 4 3— (ак) → 3 Са 3 (РО 4) 2 (с)
Зверніть увагу на необхідність балансування електричних зарядів
Масові відносини в хімічних рівняннях
Збалансоване хімічне рівняння виражає відносну кількість молів кожного компонента (продукту або реагента), але оскільки кожна формула в рівнянні передбачає певну масу речовини (його молярну масу), рівняння також передбачає, що між компонентами існують певні вагові відносини. Наприклад, рівняння, що описує згоряння чадного газу до вуглекислого газу
\[2 CO + O_2 → 2 CO_2\]
має на увазі наступні відносини:
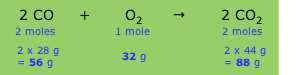
Показані в нижньому рядку відносні маси встановлюють стехіометрію реакції, тобто відносини між масами різних компонентів. Оскільки ці маси змінюються прямо пропорційно один одному, ми можемо визначити, що становить коефіцієнт перетворення (іноді його називають хімічним фактором), який пов'язує масу будь-якого одного компонента з масою будь-якого іншого компонента.
Оцініть хімічний фактор і коефіцієнт перетворення, який пов'язує масу вуглекислого газу з масою СО, споживаного в реакції.
Рішення
З наведеної вище коробки масове співвідношення СО 2 до СО в цій реакції становить 88/56 = 1,57; це хімічний фактор перетворення СО в СО 2. Коефіцієнт перетворення становить лише 1,57/1 з явно вказаними одиницями маси:
\[\dfrac{1.57\; g\; CO_2}{ 1\; g\; CO} = 1\]
- Скільки тонн СО 2 можна отримати при спалюванні 10 т СО?
- Скільки кг СО потрібно спалити, щоб отримати 20 кг СО 2?
Рішення
- (1,57 Т СО 2/1 Т СО) × (10 Т СО) = 15,7 Т СО 2
- Зверніть увагу, що відповідь на це потрібно посилатися на чадний газ, а не CO 2, тому пишемо коефіцієнт перетворення в зворотному порядку:
(1 кг СО/1,57 кг СО 2) × (20 кг СО 2) = (20/1,57) г СО = 12,7 кг СО.
Чи розумна ця відповідь? Та тому що маса СО завжди повинна бути меншою, ніж у СО 2 в цій реакції.
Більше масово-масових проблем
Не чекайте пройти хімію, якщо ви не зможете впоратися з такими проблемами, як наведені нижче; вони часто виникають у всіх контекстах.
Руда FeS 2 може бути перетворена в важливу промислову хімічну сірчану кислоту H 2 SO 4 за допомогою ряду процесів. Якщо припустити, що перетворення завершено, скільки літрів сірчаної кислоти (щільність 1,86 кг L —1) можна зробити з 50 кг руди?
Рішення
Як і у більшості проблем, це розпадається на кілька більш простих. Починаємо з відпрацювання стехіометрії з припущення, що вся сірка в або закінчується як H 2 SO 4, що дозволяє нам писати
ФеС 2 → 2 Н 2 СО 4
збалансований щодо двох складових, що цікавлять, і це все, що нам потрібно тут. Молярні маси двох компонентів складають 120,0 і 98 г моль —1 відповідно, тому рівняння можна інтерпретувати через маси як[120 одиниць маси] FeS 2 → [2 × 98 одиниць маси] H 2 SO 4
При цьому 50 кг руди вийде (50 кг) × (196/120) = 81,7 кг продукту.
[Перевірте: чи розумна ця відповідь? Та тому що коефіцієнт (196/120) близький до (200/120) = 5/3, тому маса продукту повинна бути трохи менше, ніж в два рази більше маси споживаної руди.]
З інформації про щільність знаходимо, що обсяг рідини H 2 SO 4 дорівнює
(81,7 кг) ÷ (1,86 кг Л —1) = 43,9 л
[Перевірте: чи розумна ця відповідь? Та тому що щільність говорить нам про те, що кількість літрів кислоти буде трохи більше половини її ваги.]
Хлорид барію утворює кристалічний гідрат, BaCl 2 ·xH 2 O, в якому х молекули води включені в кристалічну тверду речовину для кожної одиниці BaCl 2. Ця вода може бути вигнана теплом; якщо 1,10 г гідратованої солі нагріти і перезважувати кілька разів, поки не відбудеться подальша втрата ваги (тобто втрати води), кінцева вага зразка становить 0,937 г Яке значення х у формулі гідрату?
Рішення
Насамперед необхідно знайти кількість молей BaCl 2 (молекулярна маса 208,2) з маси зневодненого зразка.
(0,937 г)/(208,2 г моль —1) = 0,00450 моль
Тепер знайдіть родимки Н 2 О (молекулярна маса 18), втрачені при висушуванні зразка:
(1,10 — 937) г/(18 г моль —1) = 0,0905 моль
Допускаючи розумну кількість похибки вимірювання, очевидно, що мольне співвідношення BaCl 2: H2O = 1:2. Формула гідрату - BaCl 2 ·2H 2 O.
Обмежувальні реагенти
Більшість хімічних реакцій, які відбуваються в реальному світі, починаються з більш-менш довільних кількостей різних реагентів; нам зазвичай доводиться докласти особливих зусиль, якщо хочемо забезпечити об'єднання стехіометричних кількостей реагентів. Це означає, що один або кілька реагентів зазвичай будуть присутні в надлишку; там буде більше присутніх, ніж може реагувати, а деякі залишаться після закінчення реакції. У той же час один реагент буде повністю витрачений; ми називаємо це граничним реагентом, оскільки кількість цієї присутньої речовини контролюватиме або обмежує кількість інших реагентів, які споживаються, а також кількість вироблених продуктів.
Обмежувальні проблеми реагентів обробляються так само, як і звичайні проблеми стехіометрії, з одним додатковим попереднім кроком: спочатку потрібно визначити, який з реагентів є limiting— тобто який буде повністю витрачений. Щоб почати, розглянемо наступний дуже простий приклад
Для гіпотетичної реакції 3 A + 4 B → [продукти] визначаємо, який реагент буде повністю витрачений при об'єднанні
- рівномолярні величини А і В;
- 0,57 моль А і 0,68 моль В.
Рішення
а) Простий огляд рівняння чітко показує, що потрібно більше молів B, тому цей компонент буде споживатися (і, таким чином, є граничним реагентом), залишаючи після себе ¾ стільки ж родимок А.
б) Скільки родимок В буде реагувати з 0,57 моль А? Відповідь буде
(4/3 × 0,57 моль). Якщо це доходить до менш ніж 0,68 моль, то B буде граничним реагентом, і ви повинні продовжувати проблему виходячи з кількості присутнього В. Якщо граничним реагентом є А, то всі 0,57 моль А відреагують, залишаючи частину В надлишку. Опрацюйте це!
Сірка і мідь при нагріванні разом реагують з утворенням сульфіду міді (I), Cu 2 S. Скільки грам Cu 2 S можна зробити з 10 г сірки і 15 г міді?
Рішення
З атомних ваг Cu (63,55) і S (32.06) ми можемо інтерпретувати реакцію he 2 Cu+ S → Cu 2 S як
[2 × 63,55 = 127,1 одиниць маси] Cu + [32.06 одиниць маси] S
→ [159.2 одиниці маси] Cu 2 S
Таким чином, 10 г S зажадає
(10 г S) × (127,1 г Куб)/(32.06 г S) = 39,6 г у.о.
... що набагато більше, ніж доступно, тому мідь тут є обмежуючим реагентом.
[Перевірте: чи розумна ця відповідь? Так, тому що хімічний фактор (127/32) працює приблизно до 4, вказуючи на те, що сірка реагує приблизно в чотири рази більше ваги міді.]
Маса утвореного сульфіду міді буде визначатися масою наявної міді:
(15 г Cu) × (159,2 г Cu 2 S)/(127,1 г Cu) = 18,8 г у.о. 2 S
[Перевірте: чи розумна ця відповідь? Так, тому що хімічний фактор (159.2/127.1) трохи більше одиниці, що вказує на те, що маса продукту буде трохи перевищувати масу споживаної міді.]
Концепція обмеження реагентів зачіпає всіх нас у нашому повсякденному житті - і як ми покажемо в другому прикладі нижче, навіть у підтримці самого життя!
Співвідношення повітря до палива при згорянні
Горіння - це екзотермічний процес, при якому паливо поєднується з киснем; повне згоряння вуглеводневого палива, такого як метан або бензин, дає вуглекислий газ і воду:
СН 4 + 2 О 2 → СО 2 + 2 Н 2 О (г)
Розрахуйте співвідношення маси СН 4 до О 2, необхідне для повного згоряння.
Рішення
Це всього лише відношення молярної маси СН 4 (16 г) до співвідношення двох молів диоксигену (2 х 32 г)
Таким чином (64 г)/(16 г) = 4/1 = 4,0.

Неповне згоряння, як правило, небажано, оскільки воно витрачає паливо, виробляє менше тепла та виділяє забруднюючі речовини, такі як вуглецева сажа. Енергоутворюючі процеси горіння завжди повинні працювати в режимі, обмеженому паливом.
У звичайних процесах горіння джерелом кисню є повітря. Оскільки лише близько 20 відсотків молекул в сухому повітрі складаються з O 2, обсяг повітря, який повинен подаватися, в п'ять разів більше, ніж потрібно для чистого O 2. Розрахунок співвідношення маси повітря до палива («співвідношення A/F»), що застосовується інженерами спалювання, ускладнюється різними молярними масами диоксигену та повітря. Для спалювання метану співвідношення A/F виходить приблизно до 17,2Співвідношення A/F, які перевищують стехіометричні значення, вважаються худими, тоді як ті, в яких повітря стає граничним компонентом, характеризуються як багаті. Для того щоб забезпечити повне згоряння, звичайною практикою є підтримка злегка худий суміші. Кількість так званого надлишкового повітря, що зазвичай допускається до пальників, варіюється від 5-10% для природного газу до 100% для певних марок вугілля.
Для двигунів внутрішнього згоряння, що працюють на бензині (приблизно еквівалентно C 7 H 14), стехіометричне співвідношення A/F становить 15:1. Однак практичні міркування обумовлюють необхідність різних співвідношень на різних етапах експлуатації. Типові значення варіюються від багатого співвідношення для запуску або прискорення до трохи нахилених коефіцієнтів для звичайного водіння. Ці співвідношення встановлюються карбюратором, з додатковим управлінням комп'ютером двигуна і датчиком кисню вихлопної лінії в сучасних транспортних засобах, або ручним дроселем в більш ранніх.
Аеробне і анаеробне дихання
Наші тіла потребують постійного постачання енергії для того, щоб підтримувати нервову активність, синтезувати білки та інші необхідні біохімічні компоненти, замінити клітини та підсилювати м'язову дію. «Паливо» — носій хімічної енергії — глюкоза, простий цукор, який при необхідності виділяється з крохмалеподібного полімерного глікогену, форми, в якій зберігається енергія, яку ми отримуємо з їжі. Артеріальна кров переносить розчинену глюкозу разом з гемоглобін-зв'язаним диоксигеном до окремих клітин, які є місцями «згоряння» глюкози:
\[C_6H_{12}O_6 + 6 O_2 → 6 CO_2 + 6 H_2O\]
Чиста реакція і кількість виділеної енергії такі ж, як якщо б глюкоза спалювалася на відкритому повітрі, але всередині клітин реакція протікає в ряд крихітних кроків, які захоплюють більшу частину цієї енергії для використання організмом, звільняючи лише невелику частку її як теплову енергію (тепло). Оскільки цей процес використовує кисень з повітря, яким ми дихаємо, він відомий як аеробне дихання. І як і в будь-якому ефективному процесі горіння, глюкоза є обмежуючим реагентом тут.
Однак бувають випадки, коли енергійна фізична активність змушує м'язи споживати глюкозу зі швидкістю, що перевищує здатність крові доставляти необхідну кількість кисню. При цих умовах клітинне дихання переходить на альтернативний анаеробний режим:
\[C_6H_{12}O_6 → 2 CH_3CH(OH)COOH\]
Як видно з цього рівняння, глюкоза лише частково розщеплюється (на молочну кислоту), і таким чином тільки частина її хімічної енергії захоплюється організмом. Існують численні переваги для здоров'я аеробних вправ, включаючи підвищену здатність організму підтримувати аеробний стан. Але якщо ви перебуваєте в бігу на короткі відстані (спринтинг) або переслідуєте тигра, знижена ефективність анаеробних вправ може бути невеликою ціною, яку потрібно заплатити.
