4.3: Формули та їх значення
- Page ID
- 19246
Переконайтеся, що ви досконально розумієте наступні основні поняття, які були представлені вище.
- Поясніть, чому символ елемента часто відрізняється від формули елемента..
- Визначте іон, і поясніть значення його формули.
- Знайдіть найпростішу («емпіричну») формулу речовини з більш складної молекулярної формули. Поясніть значення формули іонного твердого речовини, такого як NaCl.
- Визначте молекулярну масу, масу формули та молярну масу. Обчисліть будь-який з них з будь-якої хімічної формули.
- З огляду на хімічну формулу, виражають мольні співвідношення будь-яких двох елементів, або моль фракції одного з його елементів.
- Знайдіть процентний склад сполуки з його формули.
- Обчисліть масове співвідношення будь-яких двох елементів, присутніх в з'єднанні, з його формули.
- Знайдіть емпіричну формулу двійкового з'єднання з мольного співвідношення двох його елементів, вираженого у вигляді десяткового числа.
- Знайдіть емпіричну формулу бінарного з'єднання з масового співвідношення двох його елементів.
- Знайдіть емпіричну формулу з'єднання з його масово- або процентного складу.
В основі хімії лежать речовини — елементи або сполуки — які мають певний склад, який виражається хімічною формулою. У цьому блоці ви навчитеся писати і інтерпретувати хімічні формули як з точки зору молей і мас, так і йти в зворотному напрямку, в якому ми використовуємо експериментальну інформацію про склад сполуки для вироблення формули.
Формула сполуки визначає кількість кожного виду атома, присутнього в одній молекулярній одиниці сполуки. Оскільки кожне унікальне хімічна речовина має певний склад, кожне подібне речовина має описуватися хімічною формулою.
Відомий спиртовий етанол складається з молекул, що містять два атоми вуглецю, п'ять атомів водню та один атом кисню. Яка його молекулярна формула?
Рішення
Просто напишіть символ кожного елемента, слідуючи за індексом із зазначенням кількості атомів, якщо присутній більше одного. Таким чином: С 2 Н 5 О
Зверніть увагу, що:
- Число атомів кожного елемента в молекулярній формулі записується у вигляді індексу;
- Коли присутній лише один атом елемента в молекулярній формулі, індекс опущений.
- У випадку з органічними (вуглецевмісними) сполуками прийнято розміщувати в формулі позначення елементів С, Н, (а якщо є) O, N в такому порядку.
Формули елементів і іонів
Символ елемента - це одно- або дволітерна комбінація, яка представляє атом конкретного елемента, такого як Au (золото) або O (кисень). Символ може використовуватися як абревіатура від імені елемента (простіше написати «Mb» замість «молібден»!) При більш формальному хімічному використанні символ елемента також може стояти для одного атома, або, залежно від контексту, для одного моля атомів елемента.
Деякі з неметалевих елементів існують у вигляді молекул, що містять два і більше атомів елемента. Ці молекули описуються такими формулами, як N 2, S 6 і P 4. Деякі з цих елементів можуть утворювати більше одного виду молекул; найвідомішим прикладом цього є кисень, який може існувати як O 2 (загальна форма, що становить 21% молекул у повітрі), а також як O 3, нестабільна і високореактивна молекула, відома як озон. Футбольно-кулькові молекули вуглецю, які іноді називають бакіболами, мають формулу C 60.
Аллотропи
Різні молекулярні форми одного і того ж елемента (такі як\(\ce{O_2}\) і\(\ce{O_3})\) називаються аллотропами).
Іони - це атоми або молекули, які несуть електричний заряд. Ці заряди представлені у вигляді надписів в іонних формулах. Таким чином:
| \(\ce{Cl^{-}}\) | хлорид-іон, з одним негативним зарядом на атом |
| \(\ce{S^{2-}}\) | сульфідний іон несе два негативних заряду |
| \(\ce{HCO3^{2–}}\) | карбонатний іон— молекулярний іон |
| \(\ce{NH4^{+}}\) | іон амонію |
Зверніть увагу, що кількість зарядів (в одиницях заряду електронів) завжди має передувати позитивному або негативному знаку, але це число опускається, коли заряд становить ±1.
Формули розширених твердих тіл
У твердих CdCl 2 атоми Cl і Cd організовані в аркуші, які поширюються на невизначений термін. Кожен атом оточений шістьма атомами протилежного роду, тому можна довільно вибрати будь-який Cl—Cd - Cl як «молекулярну одиницю». Одна така одиниця CdCl 2 позначається двома зв'язками червоного кольору на діаграмі, але вона не є дискретною «молекулою» CdCl 2.
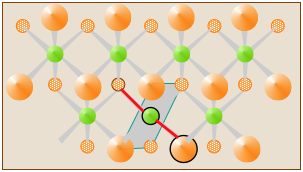
Багато очевидно «простих» твердих речовин існують лише як іонні тверді речовини (наприклад, NaCl) або як розширені тверді речовини (наприклад, CuCl 2), в яких не можуть бути ідентифіковані дискретні молекули. Формули, які ми пишемо для цих сполук, просто виражають відносні числа різних видів атомів у сполуці в найменших можливих цілих числах. Вони ідентичні емпіричним або «найпростішим» формулам, які ми обговорюємо далі.
Багато мінералів і більшість гірських порід містять різні співвідношення певних елементів і можуть бути точно охарактеризовані тільки на структурному рівні. Оскільки це, як правило, не чисті речовини, «формули», умовно використовувані для їх опису, мають обмежені значення. Наприклад, звичайний гірський олівін, який можна вважати твердим розчином Mg 2 SiO 4 і Fe 2 SiO 4, може бути представлений (Mg, Fe) 2 SiO 4. Це означає, що відношення металів до SiO 4 є постійним, і що магній зазвичай присутній у більшій кількості, ніж залізо.
Емпіричні формули
Емпіричні формули дають відносні числа різних елементів у вибірці сполуки, виражені в найменших можливих цілих числах. Термін емпіричний відноситься до того, що формули такого роду визначаються експериментально; такі формули також прийнято називати емпіричними формулами.
Глюкоза («паливо», на якому працює ваш організм) складається з молекулярних одиниць, що мають формулу C 6 H 12 O 6. Що таке емпірична формула глюкози?
Рішення
Молекула глюкози містить вдвічі більше атомів водню, ніж вуглець або кисню, тому ми ділимо через 6, щоб отримати CH 2 O.
Примітка: ця емпірична формула, яка застосовується до всіх 6-вуглецевих цукрів, вказує на те, що ці сполуки «складаються» з вуглецю та води, що пояснює, чому цукру відомі як вуглеводи.
Деякі тверді сполуки не існують як дискретні молекулярні одиниці, але будуються як розширені дво- або тривимірні решітки атомів або іонів. Склади таких з'єднань зазвичай описуються їх емпіричними формулами. У дуже поширеному випадку іонних твердих тіл така формула також виражає мінімальну кількість позитивних і негативних іонів, необхідних для отримання електрично нейтральної одиниці, як в NaCl або CuCl 2.
- Напишіть формулу броміду заліза, враховуючи, що іон заліза (залізо-III) дорівнює Fe 3 +, а іон броміду несе єдиний негативний заряд.
- Напишіть формулу сульфіду вісмуту, що утворюється при об'єднанні іонів Bi 3 + і S 2—.
Рішення:
- Три Br — іони необхідні для збалансування трьох позитивних зарядів Fe 3 +, звідси і формула FeBr 3.
- Єдиний спосіб отримати рівні числа протилежних зарядів - це мати шість кожного, тому формула буде Bi 2 S 3.
Які формули нам не говорять
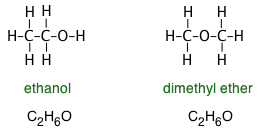
Формули, які ми зазвичай пишемо, не передають ніякої інформації про структуру сполуки — тобто порядку, в якому атоми з'єднані хімічними зв'язками або розташовані в тривимірному просторі. Це обмеження особливо значуще в органічних сполуках, в яких сотні, якщо не тисячі різних молекул, можуть поділяти одну емпіричну формулу. Наприклад, і етанол, і диметиловий ефір мають емпіричну формулу C 2 H 6 O, однак структурні формули виявляють дуже різну природу цих двох молекул:
Більш складні формули
Часто корисно писати формули таким чином, щоб передати хоч якусь інформацію про структуру сполуки. Наприклад, формула твердого речовини (NH 4) 2 CO 3 відразу ідентифікується як карбонат амонію, і, по суті, з'єднання іонів амонію і карбонату в співвідношенні 2:1, тоді як найпростіша або емпірична формула N 2 H 8 CO 3 затьмарює цю інформацію.
Аналогічно, різниця між етанолом і диметиловим ефіром може бути зроблена шляхом написання формул як C 2 H 5 OH і CH 3 —O—CH 3 відповідно. Хоча жодна з цих формул не визначає структури точно, кожен, хто вивчав органічну хімію, може їх розробити і негайно розпізнає групу —OH (гідроксил), яка є визначальною характеристикою великого класу органічних сполук, відомих як спирти. —O— атом, що зв'язує два вуглеці, є аналогічно визначальною особливістю ефірів.
Для вираження маси однієї молі речовини використовується кілька родинних термінів.
- Молекулярна маса: Це аналогічно атомній масі: це відносна вага однієї формульної одиниці сполуки, заснованої на шкалі вуглець-12. Молекулярна маса знаходить шляхом додавання атомних ваг всіх атомів, присутніх у формульній одиниці. Молекулярні ваги, як і атомні ваги, безрозмірні; тобто вони не мають одиниць.
- Вага формули: Те ж саме, що і молекулярна маса. Цей термін іноді використовується в зв'язку з іонними твердими речовинами та іншими речовинами, в яких дискретних молекул не існує.
- Молярна маса: Маса (в грамах, кілограмах або будь-якій іншій одиниці) одного моля частинок або формульних одиниць. При вираженні в грамах молярна маса чисельно збігається з молекулярною масою, але вона повинна супроводжуватися одиницею маси.
- Розрахуйте формулу ваги хлориду міді (II),\(\ce{CuCl2}\).
- Як би ви висловили таку саму величину, як молярна маса?
Рішення
- Атомні ваги Cu і Cl складають відповідно 63,55 і 35,45; сума кожного атомного ваги, помножена на числа кожного виду атома в одиниці формули, дає:\[ 63.55 + 2(25.35) = 134.45.\]
- Маси одного моля атомів Cu і Cl складають відповідно 63,55 г і 35,45 г; маса одного моля одиниць CuCl 2 становить:\[(63.55 g) + 2(25.35 g) =134.45 g.\]
Інтерпретація формул в терміні мольних співвідношень і мольних дробів
Інформація, що міститься в формулах, може бути використана для порівняння складів споріднених сполук, як у наступному прикладі:
Співвідношення водню до вуглецю часто викликає інтерес при порівнянні різних видів палива. Розрахуйте ці співвідношення для метанолу (СН 3 ОН) і етанолу (C 2 H 5 OH).
Рішення
Співвідношення H:C для двох спиртів складають 4:1 = 4,0 для метанолу та 6:2 (3,0) для етанолу.
Крім того, іноді використовується моль дробів, щоб висловити те ж саме. Мольна частка елемента M в з'єднанні - це всього лише кількість атомів М, поділене на загальну кількість атомів у формулі одиниці.
Обчисліть мольну частку і моль-відсоток вуглецю в етанолі (С 2 Н 5 ОН).
Рішення
Одиниця формули містить дев'ять атомів, два з яких - вуглець. Мольна фракція вуглецю в з'єднанні становить 2/9 = ,22. Таким чином, 22 відсотки атомів в етанолі є вуглецем.
Інтерпретація формул через маси елементів
Оскільки формула з'єднання виражає співвідношення чисел складових його атомів, формула також передає інформацію про відносні маси елементів, які вона містить. Але для того, щоб зробити цей зв'язок, нам потрібно знати відносні маси різних елементів.
Знайти маси вуглецю, водню і кисню в одному молі етанолу (С 2 Н 5 ОН).
Рішення
Використовуючи атомні ваги (молярні маси) цих трьох елементів, ми маємо
- вуглець: (2 моль) (12,0 г моль —1) = 24 г С
- водень: (6 моль) (1,01 г моль —1) = 6 г Н
- кисень: (1 моль) (16,0 г моль —1) = 16 г О
Масова частка елемента в з'єднанні - це всього лише відношення маси цього елемента до маси всієї формульної одиниці. Масові частки завжди знаходяться в межах від 0 до 1, але часто виражаються у відсотках.
Знайти масову частку і масовий відсоток кисню в етанолі (С 2 Н 5 ОН)
Рішення
Використовуючи інформацію, розроблену в попередньому прикладі, молярна маса етанолу становить (24 + 6 + 16) г моль —1 = 46 г моль —1. З цього 16 г припадає на кисень, тому його масова частка в з'єднанні становить (16 г)/(46 г) = 0,35, що відповідає 35%.
Знаходження процентного складу сполуки за його формулою - це фундаментальний розрахунок, який ви повинні освоїти; техніка точно така, як показано вище. Знаходження масової частки часто є першим кроком у вирішенні суміжних видів проблем:
Скільки тонн калію міститься в 10 т KCl?
Рішення
Масова частка К в КСл становить 39,1/74,6 = 0,524; 10 т КСл містить (39,1/74,6) × 10 т К, або 5,24 т К. (Атомні ваги: К = 39,1, Cl = 35,5.)
Зверніть увагу, що немає необхідності мати справу з кротами, які вимагали б перетворення тонн в кг.
Скільки грам KCl буде містити 10 г калію?
Рішення
Масове співвідношення ККл/К становить 74,6 ÷ 39,1; 10 г калію буде присутній в (74,6/39,1) × 10 грамах КСл, або 19 грам.
Масові співвідношення двох елементів в з'єднанні можна знайти безпосередньо з мольних співвідношень, які виражаються в формулах.
Розплавлений хлорид магнію (MgCl 2) може розкладатися на його елементи, пропускаючи через нього електричний струм. Скільки кг хлору буде виділятися при утворенні 2,5 кг магнію? (Мг = 24,3, Кл = 35,5)
Рішення
Масове співвідношення Cl/Mg становить (35,5 × 2) /24,3, або 2,9; таким чином 2,9 кг хлору буде вироблятися на кожен кг Mg, або (2,9 × 2,5) = 7,2 кг хлору на 2,5 кг Mg. (Зверніть увагу, що не обов'язково знати формулу елементарного хлору (Cl 2), щоб вирішити цю проблему.)
Емпіричні формули з експериментальних даних
Як було пояснено вище, емпірична формула (емпірична формула) - це та, в якій відносні числа різних елементів виражаються в найменших можливих цілих числах. Хлорид алюмінію, наприклад, існує у вигляді структурних одиниць, що мають склад Al 2 Cl 6; емпірична формула цієї речовини - AlCl 3. Деякі методи аналізу дають інформацію про відносні числа різних видів атомів у сполуці. Процес знаходження формули сполуки з аналізу його складу залежить від вашої здатності розпізнавати десяткові еквіваленти загальних цілих співвідношень, таких як 2:3, 3:2, 4:5 і т.д.
Аналіз з'єднання алюмінію показав, що 1,7 моль Al поєднується з 5,1 моль хлору. Напишіть емпіричну формулу цього з'єднання.
Рішення
Формула Al 1.7 Cl 5.1 виражає відносні числа молів двох елементів в сполуці. Його можна перетворити в емпіричну формулу, розділивши обидва індекси на менший, отримуючи AlCl 3.
Найчастіше виявляється, що довільна маса з'єднання містить певні маси його елементів. Вони повинні бути перетворені в родимки, щоб знайти формулу.
У студентському лабораторному експерименті було встановлено, що 0,5684 г магнію горить на повітрі з утворенням 0,9426 г оксиду магнію. Знайдіть емпіричну формулу цієї сполуки. Атомні ваги: Мг = 24,305, О = 16,00.
Рішення
Висловлюють це співвідношення як 0,375 г С до 1,00 г О.
- молі вуглецю: (.375 г)/(12 г/моль) = 0,03125 моль С;
- родимки кисню: (1,00 г)/(16 г/моль) = 0,0625 моль О
- моль співвідношення С/О = 0,03125/0,0625 = 0,5;
це відповідає формулі C 0.5 O, яку ми виражаємо цілими числами як СО 2.
Виявлено, що 4,67 г зразка сполуки алюмінію містить 0,945 г Al і 3,72 г Cl. Знайдіть емпіричну формулу цієї сполуки. Атомні ваги: Al = 27,0, Cl=35,45.
РішенняЗразок містить (0,945 г)/(27,0 г моль —1) = 0,035 моль алюмінію і (3,72 г) (35,45) = 0,105 моль хлору. Формула Al .035 Cl .105 виражає відносні числа родимок двох елементів в сполуці. Його можна перетворити в емпіричну формулу, розділивши обидва індекси на менший, отримуючи AlCl 3.
Склад бінарного (двоелементного) з'єднання іноді виражається у вигляді масового співвідношення. Найпростіший підхід тут - трактувати числа, що виражають співвідношення, як маси, таким чином перетворюючи задачу в вид, описаний відразу вище.
З'єднання, що складається тільки з вуглецю і кисню, містить ці два елементи в масовому співвідношенні C:H 0,375. Знайдіть емпіричну формулу.
Рішення
Висловлюють це співвідношення як 0,375 г С до 1,00 г О.
- молі вуглецю: (.375 г)/(12 г/моль) = 0,03125 моль С;
- родимки кисню: (1,00 г)/(16 г/моль) = 0,0625 моль О
- моль співвідношення С/О = 0,03125/0,0625 = 0,5;
це відповідає формулі C 0.5 O, яку ми виражаємо цілими числами як СО 2.
Склад по масі з'єднання найчастіше виражається у вигляді вагового відсотка (грам на 100 грам з'єднання). Перший крок полягає в тому, щоб знову перетворити їх у відносні числа молів кожного елемента в фіксовану масу з'єднання. Хоча ця фіксована маса абсолютно умовна (немає нічого особливого близько 100 грам!) , Співвідношення мольних кількостей різних елементів не є довільними: ці співвідношення повинні бути вираженими як цілі числа, оскільки вони представляють співвідношення інтегральних чисел атомів.
Знайдіть емпіричну формулу з'єднання, що має наступний масово-процентний склад. Атомні ваги наведені в дужках: 36,4% Mn (54,9), 21,2% S (32.06), 42.4% O (16,0)
Рішення100 г цієї сполуки містить:
- Мн: (36,4 г)/(54,9 г моль —1) = 0,663 моль
- S: (21,2 г)/(32.06 г моль —1) = 0,660 моль
- O: (42,4 г)/(16,0 г моль —1) = 2,65 моль
Формула Mn .663 S .660 O 2.65 виражає відносні числа молів трьох елементів в сполуці. Його можна перетворити в емпіричну формулу, розділивши всі індекси на найменший, отримуючи Mn 1.00 S 1.00 O 4.01, який ми пишемо як MnSO 4.
Примітка: оскільки експериментально визначені маси схильні до невеликих похибок, зазвичай доводиться нехтувати невеликими відхиленнями від цілих значень.
Знайдіть емпіричну формулу з'єднання, що має наступний масово-процентний склад. Атомні ваги наведені в дужках: 27,6% Mn (54,9), 24,2% S (32.06), 48,2% O (16,0).
Рішення
Попередню формулу на основі 100 г цієї сполуки можна записати як
або
Чоловік: 0,503 с 7,54 з 3.01
Ділення через найменший індекс дає Mn 1 S 1.5 O 6. Перевірка цієї формули дозволяє припустити, що множення кожного індексу на 2 дає цілочисельну формулу Mn 2 S 3 O 12.
Примітки щодо експериментальних методів
Однією з найбільш фундаментальних операцій в хімії є розщеплення сполуки на її елементи (процес, відомий як аналіз), а потім визначення емпіричної формули з відносних кількостей кожного виду атома, присутнього в сполуці. Лише в дуже небагатьох випадках практично здійснювати такий процес безпосередньо: таким чином нагрівання сульфіду ртуті (II) призводить до її безпосереднього розкладання:
\[\ce{2 HgS -> 2Hg + O2}.\]
Аналогічним чином електроліз води виробляє гази Н 2 і О 2 в об'ємному співвідношенні 2:1.
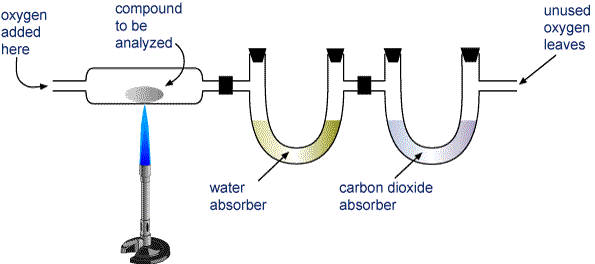
Однак більшість елементарних аналізів повинні проводитися опосередковано. Найбільшого поширення з цих методів традиційно отримав аналіз горіння органічних сполук. Невідомий вуглеводень C a H b O c може бути охарактеризований нагріванням його в потоці кисню так, що він повністю розкладається на газоподібні СО 2 і Н 2 О. Ці гази пропускаються через трубки, що містять речовини, які поглинають кожен газ вибірково. При ретельному зважуванні кожної трубки до і після процесу горіння можна розрахувати значення a і b для вуглецю і водню відповідно. Індексит c для кисню знаходять шляхом віднімання розрахункових мас вуглецю та водню з маси вихідного зразка.
Починаючи з 1970-х років, можна було проводити аналізи горіння за допомогою автоматизованого обладнання. За цим можна також визначити азот і сірку:
Вимірювання маси або ваги вже давно є основним інструментом для кількісного розуміння хімічних змін. Ваги і вагові ваги використовувалися в комерційних і фармацевтичних цілях з початку записаної історії, але цим приладам не вистачало точності 0,001 г, необхідної для кількісної хімії та елементного аналізу, проведеного в лабораторних масштабах.
Лише в середині 18 століття шотландський хімік Джозеф Блек винайшов рівноручний аналітичний баланс. Ключовою особливістю цього винаходу була легка жорстка балка, що спирається на опору з ножовим краєм; додаткові ножові кромки підтримували вагові каструлі. Краї ножа значно зменшили тертя, що обмежувало чутливість попередніх конструкцій; невипадково точні вимірювання об'єднання ваг і атомних ваг почалися приблизно в цей час.
Аналітичні ваги укладені в скляний корпус, щоб уникнути перешкод від повітряних потоків, а калібровані гирі обробляються щипцями для запобігання адсорбції вологи або масел з оголених пальців.
Той, хто був зарахований до загальної хімії на рівні коледжу до 1960-х років, нагадає про навчання (і нудно), пов'язане з цими пристроями. Вони можуть читати безпосередньо до 1 міліграм і дозволяють оцінити ± 0,1 мг. Пізніше технічні вдосконалення додали магнітне демпфування розгойдування променя, гальма та вбудовані набори ваги, керовані ручками. Найкращі залишки дослідницького класу досягли точності 0,001 мг.
Починаючи з 1970-х років, електронні ваги набули широкого використання, особливо популярні однопанельні типи. Однопанельний баланс усуває необхідність порівняння ваги зразка з вагою каліброваних ваг. Додавання зразка до каструлі викликає зміщення тензодатчика, який створює компенсуюче електромагнітне поле достатньої величини, щоб підняти каструлю в початкове положення. Струм, необхідний для цього, відчувається і перетворюється на вимірювання ваги. Найкращі електронні ваги наукового класу можуть читати до 1 мікрограма, але чутливість 0,1 мг є більш поширеними для студентського лабораторного використання.
