4.1: Атоми, елементи та ядро
- Page ID
- 19239
Переконайтеся, що ви добре розумієте наступні основні ідеї:
- Дайте хімічне визначення елементу та прокоментуйте відмінність між термінами атом і елементом.
- Слід знати імена та символи більш поширених елементів, включаючи ті, чиї символи походять від їх латинських назв.
- Опишіть, своїми словами, закони хімічних змін: збереження маси, постійний склад і множинні пропорції.
- Поясніть, як ці закони випливають з атомної теорії Далтона.
- Опишіть експеримент Резерфорда з розсіювання альфа-променів і те, як це призвело до нинішньої моделі атома.
- Визначте атомний номер і масове число, і поясніть зв'язок між ними.
- Визначте ізотоп і нуклід і запишіть символ нукліду заданого елемента із заданою кількістю нейтронів.
- Поясніть призначення мас-спектрометра і його загальний принцип роботи.
- Опишіть атомну шкалу ваги.
- Знайдіть молекулярну масу або формулу ваги t з хімічної формули.
- Визначте уніфіковану одиницю атомної маси і випишіть масові числа протона, нейтрона та електрона.
Паралельні поняття елемента і атома складають самі основи хімічної науки. Таким чином, поняття елемента є макроскопічним, яке стосується світу, який ми можемо спостерігати своїми почуттями. Атом - це мікроскопічна реалізація цієї концепції; тобто це фактична фізична частка, яка є унікальною для кожного хімічного елемента. Їх дуже малий розмір давно заважав атомам спостерігати прямим шляхом, тому їх існування не було загальноприйнятим до кінця 19-го століття. Той факт, що ми все ще чуємо згадку про «атомної теорії матерії», не повинен означати, що зараз є будь-які сумніви щодо існування атомів. Мало теорій в історії науки були настільки ретельно перевірені і так добре зрозумілі.

Хоча слово атом зазвичай відноситься до певного виду частинок (наприклад, «атом магнію»), наше повсякденне використання елемента має тенденцію бути більш загальним, маючи на увазі не тільки речовину, що складається з певного типу атома («бром - один з небагатьох елементів які є рідинами кімнатної температури»), але і атомам в колективному сенсі («магній - один з елементів, що мають два електрони у зовнішній оболонці»).
Основна концепція атомів як основних будівельних блоків речовини існує вже давно. Ще в 600 році до н.е. Гуджараті (індійський) філософ Ачарья Канад писав, що "Кожен об'єкт творіння складається з атомів, які, в свою чергу, з'єднуються між собою, утворюючи молекули». Через пару століть у 460 році до н.е. грецький філософ Демокріт міркував, що якщо ви продовжуєте розбивати шматок матерії на менші та менші фрагменти, буде якийсь момент, коли шматки не можна зробити меншими. Він назвав ці «основні частинки матерії» — іншими словами, атоми. Але це була лише філософія; вона не стала б наукою до 1800 року, коли Джон Далтон показав, як атомна концепція природним чином слідувала за результатами кількісних експериментів, заснованих на вимірюваннях ваги.
Елементи
Елемент є основоположною одиницею хімічної ідентичності. Поняття про стихію дуже давнє. Він був розроблений у багатьох різних цивілізаціях, намагаючись раціоналізувати різноманітність світу та зрозуміти природу змін, наприклад, зміни, що відбуваються, коли шматок дерева гниє або спалюється для отримання деревного вугілля або попелу. Найбільш відомими нам є чотири елементи «земля, повітря, вогонь і вода», які були популяризовані грецькими філософами (головним чином Емпедоколом і Аристотелем) у період 500-400 до н.е.
До них ведичні (індуїстські) філософи Індії додали простір, тоді як стародавня китайська концепція Ву Сін розглядала землю, метал, дерево, вогонь і воду як фундаментальні. Ці основні елементи, як правило, не вважалися існуючими як фактичні матеріали, які ми знаємо як земля, вода тощо, а скоріше представляють «принципи» чи сутності, які елементи передавали різним видам матерії, з якими ми стикаємося у світі.
Зрештою, практичний досвід (багато в чому пов'язаний з видобутком металів з руд) і початок наукових експериментів у XVIII столітті привели до нашої сучасної концепції хімічного елемента. Елемент - це речовина: найпростіша форма, до якої будь-яке інше хімічна речовина може бути відновлено шляхом відповідної термічної або хімічної обробки. «Найпростіший», в контексті експериментів в той час, був визначений з точки зору ваги; кінавар (сульфід ртуті) може бути розбитий на дві речовини, ртуть і сірку, які самі по собі не можуть бути зведені до будь-яких більш легких форм.

Хоча Лавуазьє отримав багато з цих прав, йому вдалося включити кілька речей, які не зовсім вписуються в наше сучасне уявлення про те, що являє собою хімічний елемент. Є дві такі помилки у верхній частині таблиці, що ви повинні бути в змозі визначити, навіть якщо ваш французький менше, ніж tip-top— ви можете знайти їх?
Інше неправильне призначення Лавуазьє елементів у нижній частині насправді не було його провиною. Крейда, магнезія, барити, оксид алюмінію та кремнезем - це високостабільні кисневмісні сполуки; високі температури, необхідні для їх руйнування, не могли бути досягнуті за часів Лавуазьє (магнезія - це те, з чого виготовляється вогнева цегла). Правильна класифікація цих речовин затягувалася до тих пір, поки подальші експерименти не виявили їх справжню природу. Десять хімічних елементів були відомі з давніх часів і ще п'ять були виявлені через 17 століття.
Деякі часто задаються питання про елементи
- Скільки елементів там? Дев'яносто два елементи були знайдені в природі. Ще близько 25 були зроблені штучно, але всі вони розпадаються на більш легкі елементи, причому деякі з них зникають за хвилини або навіть секунди.
- Звідки беруться елементи? Нинішнє переконання полягає в тому, що гелій і кілька інших дуже легких елементів утворилися протягом приблизно трьох хвилин після «великого вибуху», і що наступні 23 елементи (вгору через залізо) утворюються в основному процесами ядерного синтезу всередині зірок, в яких більш легкі ядра об'єднуються в послідовно важчі елементи. Елементи важче заліза не можуть утворюватися таким чином, і виробляються тільки під час катастрофічного колапсу масивних зірок (вибухів наднових).
- Як змінюються елементи в достатку? Досить помітно, і зовсім по-різному в різних тілах в космосі. Більшість атомів у Всесвіті все ще складаються з водню, причому гелій є далекою секундою. На Землі найбільше поширені кисень, кремній та алюміній. Ці профілі служать корисними напрямними для побудови моделей для формування землі та інших планетарних тіл. Система символів елементів, яку ми використовуємо сьогодні, була встановлена шведським хіміком Йонсом Якобом Берцеліусом в 1814 році. До цього часу використовувалися графічні алхімічні символи, які згодом були модифіковані і популяризовані Джоном Далтоном. На щастя для англомовних, символи більшості елементів служать мнемонікою для їх імен, але це не вірно для семи металів, відомих з давнини, чиї символи походять від їх латинських назв. Іншим винятком є вольфрам (назва походить від шведського), символ якого W відображає німецьке ім'я, яке більш широко використовується.
- Як організовані елементи? Два загальних принципи організації, розроблені в 19 столітті: один базувався на збільшенні відносної ваги (атомних ваг) елементів, даючи список, який починається таким чином:
H He Li Be B C N O F Na Na Mg Al Si P S Cl Ar K Ca...
Атоми стають реальними
Протягом більшої частини історії ідея про те, що матерія складається з дрібних частинок, нудилася як філософська абстракція, відома як атомізм, і чіткого зв'язку між цими «атомами» та хімічними «елементами» не було встановлено. Це почало змінюватися на початку 1800-х років, коли розробка балансів, які дозволили досить точні вимірювання змін ваги, пов'язаних з хімічними реакціями, відкрило нову і плідну еру експериментальної хімії. Це призвело до визнання кількох законів хімічних змін, які заклали основу для атомної теорії речовини.

Закони хімічних змін
Нагадаємо, що «закон», в контексті науки, - це лише відносини, виявлені шляхом експериментів, які досить добре встановлені, щоб розглядатися як не підлягають сумніву для більшості практичних цілей. Оскільки це природа вчених ставити під сумнів «безперечне», іноді трапляється, що винятки дійсно виникають, і в цьому випадку закон повинен зазнати відповідної зміни.
Збереження масової енергії зазвичай вважається найфундаментальнішим із закону природи. Це також хороший приклад закону, який довелося змінити; він був відомий просто як Збереження маси, поки Ейнштейн не показав, що енергія та маса взаємозамінні. Однак старіший термін цілком прийнятний в області звичайної хімії, в якій енергетичні зміни занадто малі, щоб мати вимірний вплив на масові відносини. У контексті хімії збереження маси можна розглядати як «збереження атомів». Хімічна зміна просто перемішує їх навколо в нові домовленості.
Масове збереження мало особливе значення в розумінні хімічних змін за участю газів, які протягом деякого часу взагалі не завжди розглядалися як реальна матерія. (Через їх дуже малих щільностей, проведення фактичних вимірювань ваги на газах зробити досить складно, і було далеко за межами можливостей ранніх експериментаторів.) Таким чином, коли метал магнію спалюється на повітрі, вага твердого продукту завжди перевищує вагу оригінального металу, маючи на увазі, що процес - це той процес, в якому метал поєднується з тим, що, можливо, вважалося «невагомим» компонентом повітря, який ми тепер знаємо як кисень.

Що ще важливіше, цей експериментальний результат говорить нам щось дуже важливе про масу атома кисню відносно маси атома магнію.
Закон певних пропорцій, також відомий як закон постійного складу, стверджує, що частка за вагою елемента, присутнього в будь-якому чистому речовині, завжди однакова. Це дозволяє нам узагальнити відносини, які ми проілюстрували вище.
Скільки кілограмів металевого магнію теоретично можна було б отримати, розклавши 0,400 кг оксиду магнію на його елементи?
Рішення
Масове співвідношення Mg до O в цій сполуці становить
\ [\ drac {1} {1.66} = 0.602 \ номер\]
так 0,400 кг оксиду містить
\ [(0,400\; кг)\ раз 0,602 = 0,241\;\ текст {кг мг} \ nonномер.\]
Той факт, що нас турбує зворотна реакція, наведена вище, не має значення.
Закон множинних пропорцій стосується того факту, що Багато комбінацій елементів можуть реагувати, утворюючи більше однієї сполуки. У таких випадках цей закон стверджує, що ваги одного елемента, які поєднуються з фіксованою вагою іншого з цих елементів, є цілими числами, кратними один одному. Це легко сказати, але, будь ласка, переконайтеся, що ви розумієте, як це працює. Азот утворює дуже велику кількість оксидів, п'ять з яких показані тут.
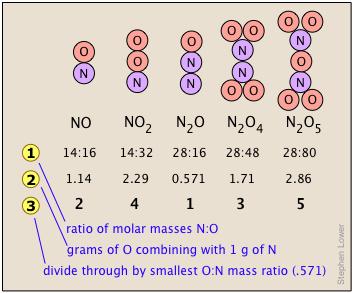
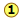 Рядок показує співвідношення відносних ваг двох елементів у кожному з'єднанні. Ці співвідношення були розраховані шляхом простого взяття молярної маси кожного елемента і множення на кількість атомів цього елемента на моль сполуки. Таким чином, для NO 2 ми маємо (1 × 14): (2 × 16) = 13:32. (Ці числа не були відомі в перші дні хімії, оскільки атомні ваги (тобто молярні маси) більшості елементів не були достовірно відомі.)
Рядок показує співвідношення відносних ваг двох елементів у кожному з'єднанні. Ці співвідношення були розраховані шляхом простого взяття молярної маси кожного елемента і множення на кількість атомів цього елемента на моль сполуки. Таким чином, для NO 2 ми маємо (1 × 14): (2 × 16) = 13:32. (Ці числа не були відомі в перші дні хімії, оскільки атомні ваги (тобто молярні маси) більшості елементів не були достовірно відомі.)- Числа в рядку
 - це лише масові співвідношення O: N, знайдені шляхом ділення відповідних співвідношень у рядку 1. Але хтось, хто залежить виключно від експерименту, буде працювати їх, знайшовши масу O, яка поєднується з одиницею маси (1 г) азоту.
- це лише масові співвідношення O: N, знайдені шляхом ділення відповідних співвідношень у рядку 1. Але хтось, хто залежить виключно від експерименту, буде працювати їх, знайшовши масу O, яка поєднується з одиницею маси (1 г) азоту. - Рядок отримують шляхом ділення цифр попереднього рядка на найменший коефіцієнт O:N у рядку вище, який є одним для N 2 O. Зверніть увагу, що так само, як говорить закон кратних пропорцій, вага кисню, який поєднується з одиничною масою азоту, виходить до малих цілих чисел.
- Звичайно, ми так само легко могли б проілюструвати закон, розглядаючи масу азоту, який поєднується з одним грамом кисню; це працює в обох напрямках!
Азот і водень утворюють багато сполук, деякі з яких включають інші елементи, а також. Маса водню, який з'єднується з 1,00 г азоту з утворенням трьох з цих сполук: сечовина, 0,1428 г; аміак, 0,0714 г; хлорид амонію, 0,2857 м Показують, що ці дані відповідають Закону множинних пропорцій.
Рішення
«Фіксована вага», яку ми тут розглядаємо, - це азот. Перевірка наведених вище цифр показує, що аміак містить найменший ваговий коефіцієнт H:N = 0,0714, тоді як вагове співвідношення H:N в сечовині вдвічі більше, а що в хлориді амонію в чотири рази 0,0714. Таким чином, співвідношення H:N самі по собі стоять у співвідношенні 2:1:4 відповідно, і Закон підтверджується.
Інтерпретація Далтона встановлена атомна теорія
Ідея про те, що матерія складається з крихітних «атомів» якогось роду, існувала щонайменше 2000 років. Досягненням Дальтона було ідентифікація атомів з фактичними хімічними елементами.

Якби Нобелівські премії існували на початку 1800-х років, вчитель англійської шкіли/метеоролог/хімік Джон Далтон (1766-1844), безумовно, виграв би одну за те, що показував, як експериментальна інформація, наявна на той час, як втілена в законі хімічних змін, які ми щойно описали, повністю узгоджуються з гіпотезою, що атоми є найменшими одиницями хімічної ідентичності. Ці пункти атомної теорії Дальтона дали задовільні пояснення всіх законів хімічних змін, зазначених вище:
Пояснення Далтона Закону збереження маси полягало в тому, що це дійсно наслідок «збереження атомів», які, як вважають, незнищуються хімічними засобами. У хімічних реакціях атоми просто переставляються, але ніколи не руйнуються.
Пояснення Дальтона закону постійного складу полягало в тому, що якщо сполуки складаються з певних чисел атомів, кожен з яких має свою характерну масу, то відносна маса кожного елемента в з'єднанні завжди повинна бути однаковою. При цьому елементи завжди повинні бути присутніми в чистому зразку з'єднання в однакових пропорціях по масі.
Заданий набір елементів зазвичай може утворювати два або більше сполук, в яких кількість атомів деяких елементів відрізняється. Тому що ці числа повинні бути цілими числами (ви не можете мати «половину» атома!) , Маса одного елемента, поєднаного з фіксованою масою будь-яких інших елементів в будь-яких двох таких з'єднаннях, може відрізнятися тільки цілими числами. Таким чином, для ряду азотно-водневих сполук, наведених у прикладі задачі вище, ми маємо наступні співвідношення:
| З'єднання | Формула | співвідношення ваги Н: Н | співвідношення до 0.0714 |
|---|---|---|---|
|
сечовина
|
СО (Н 2) 2
|
0,1428
|
2
|
|
нашатирний спирт
|
NH 3
|
0.0714
|
1
|
|
хлорид амонію
|
NH 4 Кл
|
0,2857
|
4
|
Хоча атомна теорія Далтона відразу була визнана корисним інструментом для організації хімічних знань, пройшов деякий час, перш ніж вона стала прийнятою як справжнє уявлення про світ. Так, ще в 1887 році один коментатор спостерігав
«Атоми - це круглі шматочки дерева, винайдені містером Далтоном».
Ці дерев'яні кульки перетворилися на зображення, створені комп'ютером, отримані з атомно-силового мікроскопа (AFM), вишукано чутливого електромеханічного пристрою, в якому відстань між кінчиком субмікроскопічного дротяного зонда та поверхнею безпосередньо під ним записується, коли зонд рухається вздовж поверхню, до якої адсорбуються атоми. Загальний принцип роботи АСМ досить простий, але його реалізація в реальному пристрої може здатися дещо лякаючою! Цей вузькоспеціалізований атомно-силовий мікроскоп є одним з декількох подібних пристроїв, описаних у цій Аргоннській національній лабораторії.
Відносні маси
Атомна теорія Далтона негайно призвела до усвідомлення того, що хоча атоми занадто малі, щоб їх вивчати безпосередньо, їх відносні маси можна оцінити, спостерігаючи за вагами елементів, які об'єднуються, утворюючи подібні сполуки. Ці ваги іноді називають комбінованими вагами. Однак є одна складність: нам потрібно знати формули сполук, які ми розглядаємо, щоб зробити достовірні порівняння. Наприклад, ми можемо знайти відносні маси двох атомів X і Y, які поєднуються з киснем, тільки якщо припустити, що значення n в двох формулах\(XO_n\) і\(YO_n\) однакові. Але самі відносні маси, які ми намагаємося знайти, повинні бути відомі для того, щоб визначити ці формули.
Спосіб обійти це полягав у тому, щоб зосередитись на бінарних (двоелементних) сполуках, які, як передбачалося, мають прості співвідношення атомів, такі як 1:1, 1:2 тощо, і сподіватися, що буде знайдено достатньо сполук 1:1, щоб забезпечити відправну точку для порівняння різних пар комбінованих ваг. Сполуки кисню, відомі як оксиди, зіграли тут особливо важливу роль, почасти тому, що майже всі хімічні елементи утворюють сполуки з киснем, і більшість з них дійсно мають дуже прості формули.
—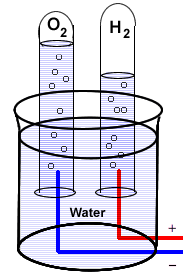
Першим доказом того, що вода складається з водню та кисню, було через відкриття в 1800 році, що електричний струм може розкласти воду на ці елементи. Зверніть увагу на обсяги 2:1 двох газів, що витісняють воду у верхній частині труб.
З цих сполук кисню широко вивчалася одна з воднем - звичайна вода. Раніше досліди дали склад води 87,4 відсотка кисню і 12,6 відсотка водню за вагою. Це означає, що якщо формула води приймається [неправильно] HO, то масове співвідношення двох видів атомів має бути О:Н = 87,4/12,6 = 6,9. Пізніше робота виправляла цю цифру до 8, але неправильне припущення про формулу води залишиться чумної хімії майже п'ятдесят років, поки дослідження обсягів газу не довели, що вода - Н 2 О.
Дальтон повністю визнав орієнтовний характер вагових співвідношень на основі передбачуваних простих формул, таких як HO для води, але, тим не менш, зміг скласти в 1810 році список відносних ваг атомів деяких досліджуваних ним елементів, спостерігаючи за змінами ваги в хімічних реакціях.
|
водню
|
азоту
|
вуглець
|
кисень
|
фосфор
|
сірки
|
залізо
|
цинку
|
мідь
|
свинець
|
|---|---|---|---|---|---|---|---|---|---|
|
1
|
5
|
5.4
|
7
|
9
|
13
|
50
|
56
|
56
|
95
|
Оскільки водень є найлегшим елементом, йому присвоєно відносну вагу одиниці. Привласнюючи певні відносні маси атомам різних елементів, Дальтон дав реальність поняттю атома і встановив зв'язок між атомом і елементом. Після того, як стали відомі правильні хімічні формули більшої кількості сполук, більш точні дослідження комбінованої ваги врешті-решт призвели до відносної ваги атомів, які ми знаємо сьогодні як атомні ваги, про які ми обговорюємо далі.
Ядерний атом
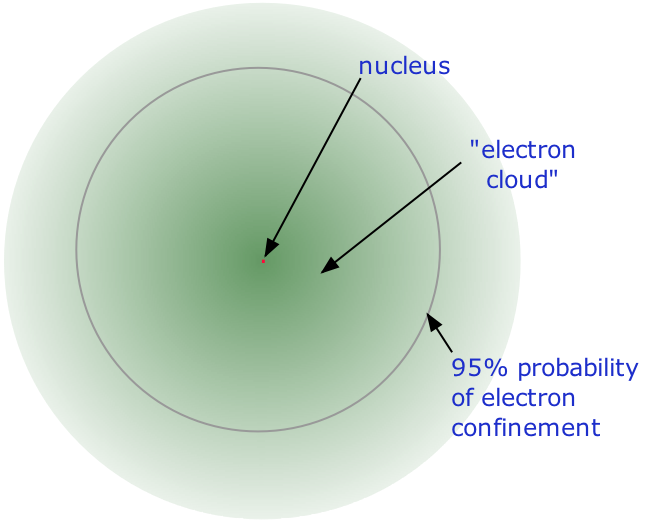
Точна фізична природа атомів нарешті виникла в результаті серії елегантних експериментів, проведених між 1895 і 1915 роками. Найбільш помітним з цих досягнень став знаменитий експеримент Ернеста Резерфорда з розсіювання альфа-променів 1911 року, який встановив, що
 •
•
- Майже вся маса атома міститься в крихітному (і тому надзвичайно щільному) ядрі, яке несе позитивний електричний заряд, значення якого ідентифікує кожен елемент і відоме як атомний номер елемента.
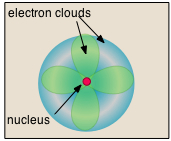
- Майже весь обсяг атома складається з порожнього простору, в якому проживають електрони, основні носії негативного електричного заряду. Надзвичайно мала маса електрона (1/1840 маса водневого ядра) змушує його вести себе як квантова частинка, а це означає, що його розташування в будь-який момент неможливо вказати; найкраще, що ми можемо зробити, це описати його поведінку з точки зору ймовірності його прояву в будь-якій точці простору. Загальноприйнято (але дещо оманливе) описувати обсяг простору, в якому електрони атома мають значну ймовірність бути виявленими як електронна хмара. Останній не має певної зовнішньої межі, так само як і атом. Радіус атома повинен бути визначений довільно, наприклад, межа, в якій електрон може бути знайдений з 95% ймовірністю. Атомні радіуси зазвичай становлять 30-300 вечора.
Протони і нейтрони
Саме ядро складається з двох видів частинок. Протони є носіями позитивного електричного заряду в ядрі; протонний заряд точно такий же, як і електронний заряд, але протилежного знака. Це означає, що в будь-якому [електрично нейтральному] атомі кількість протонів в ядрі (часто його називають ядерним зарядом) врівноважується однаковою кількістю електронів поза ядром.
Іони
Оскільки електрони атома контактують із зовнішнім світом, можна втратити один або кілька електронів або додати деякі нові. Отриманий електрично заряджений атом називається іоном.
Інша ядерна частка - це нейтрон. Як випливає з назви, ця частинка не несе електричного заряду. Маса його майже така ж, як і у протона. Більшість ядер містять приблизно однакові числа нейтронів і протонів, тому можна сказати, що ці дві частинки разом складають майже всю масу атома.
Атомний номер (Z)
Який єдиний параметр однозначно характеризує атом даного елемента? Це не відносна маса атома, як ми побачимо в розділі про ізотопи нижче. Це, скоріше, кількість протонів в ядрі, яке ми називаємо атомним номером і позначимо символом Z. Кожен протон несе електричний заряд +1, тому атомний номер також вказує електричний заряд ядра. У нейтральному атомі протони Z всередині ядра врівноважуються Z-електронами поза ним.

Мозлі шукав вимірювану властивість кожного елемента, яка лінійно збільшується з атомним номером. Він знайшов це в класі рентгенівських променів, випромінюваних елементом, коли він бомбардується електронами. Частоти цих рентгенівських променів унікальні для кожного елемента, і вони рівномірно збільшуються в послідовних елементах. Мозлі виявив, що квадратні корені цих частот дають пряму лінію при нанесенні на Z; це дозволило йому сортувати елементи в порядку збільшення атомного номера.
Ви можете думати про атомний номер як своєрідний порядковий номер елемента, починаючи з 1 для водню і збільшуючи на одиницю для кожного наступного елемента. Хімічна назва елемента і його символ однозначно пов'язані з атомним номером; таким чином символ «Sr» розшифровується як стронцій, атоми якого всі мають Z = 38.
Масове число (A)
Це всього лише сума чисел протонів і нейтронів в ядрі. Він іноді представлений символом А, тому
\[A = Z + N\]
в якому Z - атомний номер, а N - число нейтронів.
Нукліди та їх символи
Термін нуклід просто відноситься до будь-якого конкретного виду ядра. Наприклад, ядро атомного номера 7 - це нуклід азоту. Будь-нуклід характеризується парою чисел (Z, A). Символ елемента залежить тільки від Z, тому символ 26 Mg використовується для вказівки маси-26 нукліду магнію, назва якого передбачає Z = 12. Більш явним способом позначення певного виду ядра є додавання атомного номера в якості індексу. Звичайно, це дещо надмірно, оскільки символ Mg завжди має на увазі Z = 12, але іноді це зручність при обговоренні декількох нуклідів.
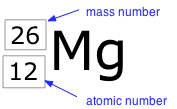
Два нукліди, що мають однаковий атомний номер, але різні масові номери, відомі як ізотопи. Більшість елементів зустрічається в природі у вигляді сумішей ізотопів, але двадцять три з них (включаючи берилій і фтор, наведені в таблиці) є моноізотопними. Наприклад, існує три природних ізотопу магнію: 24 Mg (79% всіх атомів Mg), 25 Mg (10%) і 26 Mg (11%); всі три присутні у всіх з'єднаннях магнію приблизно в цих же пропорціях.
Приблизно 290 ізотопів зустрічається в природі. Два важких ізотопи водню особливо важливі - настільки, що вони мають власні імена та символи:

На дейтерій припадає лише близько 15 з кожного мільйона атомів водню. Тритій, який є радіоактивним, ще менш рясний. Весь тритій на землі є побічним продуктом розпаду інших радіоактивних елементів.
Атомні ваги
Атоми, звичайно, занадто малі, щоб їх можна було зважувати безпосередньо; вимірювання ваги можна проводити лише на масивних (але невідомих) числах атомів, які спостерігаються в хімічних реакціях. Ранні комбіновані вагові експерименти Дальтона та інших встановили, що водень є найлегшим з атомів, але грубий характер вимірювань і невизначеності щодо формул багатьох сполук ускладнювали розробку надійної шкали відносних ваг атомів. Навіть найвибагливіші вимірювання ваги, які ми можемо зробити сьогодні, схильні до експериментальних невизначеностей, які обмежують точність до чотирьох значущих цифр в кращому випадку.
Зважування атомів: мас-спектрометрія
Альтернативний спосіб дослідження поведінки окремих атомних частинок став очевидним у 1912 році, коли Джей Джей Томсон і Ф.У.Астон показали, що потік газоподібних атомів неону, розбитих за допомогою електричного розряду, дає два види субатомних частинок, що мають протилежні електричні заряди, як виявлено за їх прогинами в зовнішньо прикладених магнітних і електростатичних полах. (Самі прогини можна було спостерігати за плямами, зробленими частинками, коли вони потрапили на фотографічну пластину.) Це в поєднанні з висновком, зробленим роком раніше Вільгельмом Віном про те, що ступінь відхилення частинки в цих полах пропорційна відношенню її електричного заряду до її маси, відкрило шлях до характеристики цих інакше невидимих частинок.
Нейтральні атоми, не маючи заряду, не можуть бути прискорені по шляху так, щоб утворити промінь, а також не можуть бути відхилені. Однак їх можна змусити придбати електричні заряди, направляючи на них електронний пучок, і це було основою першого мас-спектрометра, розробленого колишнім студентом Томсона Ф.У.Астоном (1877-1945, 1922 Нобелівська премія) в 1919 році. Це дозволило йому швидко ідентифікувати 212 з 287 природних ізотопів.
Мас-спектрометр став одним з найбільш широко використовуваних лабораторних приладів. Мас-спектрометрія в даний час в основному використовується для ідентифікації молекул. Іонізація зазвичай розбиває молекулу на фрагменти, що мають різне співвідношення заряду до маси, кожна молекула призводить до унікального «відбитка пальця» частинок, походження яких можна вивести за допомогою головоломки, подібної реконструкції. Протягом багатьох років «mass-spec» обмежувалася малими молекулами, але з розвитком нових способів створення іонів з молекул вона тепер стала основним інструментом для аналізу матеріалів і великих біомолекул, включаючи білки.
Шкала відносних ваг (атомна шкала ваги), яку ми зараз використовуємо, заснована на\(\ce{^{12}_6C}\), відносна маса якої визначена як рівно 12. Атомні ваги - це відношення ваг елемента до ваги ідентичного числа\(\ce{^{12}_6C}\) атомів. Будучи співвідношеннями, атомні ваги безрозмірні.
З 1850 по 1961 рік була визначена шкала атомної ваги щодо кисню = 16.
Певне число (називають його «один мільйон») атомів кисню важить 1.200 м Якою буде вага рівного числа атомів літію?
Рішення
З таблиці атомної ваги співвідношення маси Li/O = 6,94/16,00, тому вага одного мільйона атомів літію буде
\ [(1.200\; г)\ раз\ dfrac {6.94} {16.00} = 0.570\; г \ nonчисло\]
Ви можете візуалізувати масштаб атомної ваги як довгий рядок чисел, що триває від 1 до близько 280. Початок шкали виглядає так:
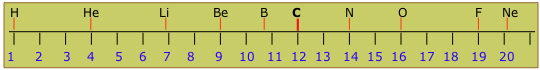
Ви помітите, що відносні маси різних елементів (показані у верхній частині) - це не всі цілі числа. Якщо всі ядра відрізняються інтегральними числами протонів і нейтронів, які мають практично однакові маси, ми очікуємо, що атомні ваги будуть цілими числами. Деякі з них дуже близькі до цілих чисел (причина, що вони не зовсім інтегральні, буде пояснено в наступному розділі), але багато з них ніде не близькі до інтеграла. Це загадкове спостереження в кінцевому підсумку призвело до поняття ізотопів.
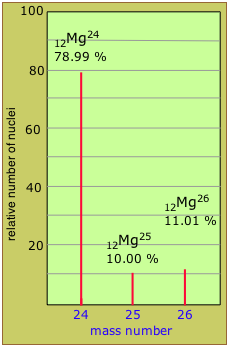
Оцініть середню атомну масу магнію за даними ізотопної чисельності, показаними на наведеному вище графіку мас-спектрометрії.
Рішення
Ми просто візьмемо середньозважене по масі чисел:
(0,7899 × 24) + (0,1000 × 25) + (0,1101 × 26) = 24,32
Примітка: Виміряна атомна маса Mg (24.305) трохи менша, ніж ця, оскільки атомні маси ядерних компонентів не є строго адитивними, як буде пояснено далі нижче.
Коли є лише два значно рясних ізотопів, можна оцінити відносні ряси з масових чисел і середньої атомної маси. Нижче наведено улюблену проблему іспиту:
Середня атомна маса хлору становить 35,45, а елемент має два стабільних ізотопи\(\ce{^{35}_{17}Cl}\) і\(\ce{^{37}_{17}Cl}\). Оцініть відносну кількість цих двох ізотопів.
Рішення
Тут ви, нарешті, отримаєте, щоб поставити свою алгебру середньої школи на роботу! Якщо ми дозволимо х представляти дріб\(\ce{^{35}Cl}\), то (1- х) дає дріб\(\ce{^{37}Cl}\). Тоді середньозважена атомна вага
35 х + 37 (1 х) = 35,45
Розв'язування для х дає 2 х = 1,55, х = 0,775, тому достатки складають 77,5% Cl 35 і 22,5% Cl 37.
Елементарний хлор, Cl 2, складається з двох ізотопів, згаданих у попередньому прикладі. Скільки піків ви очікували б спостерігати в масовому спектрі Cl 2?
Рішення
Мас-спектрометр виявить пік для кожної можливої комбінації двох ізотопів у дихлорі: 35 Cl- 35 Cl, 35 Cl- 37 Cl та 37 Cl- 37 Cl.
Таблиці атомних ваг
оновлюються кожні кілька років, оскільки кращі дані стають доступними.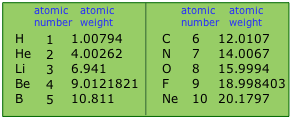
Однією з особливостей, яку ви можете помітити, є те, що кількість значущих фігур змінюється від елемента до елемента. Він має тенденцію бути найвищим для моноізотопних елементів, як ви можете бачити тут для берилію та фтору. Для деяких елементів кількість ізотопних різниться незначно, залежно від джерела; ця дисперсія зменшує корисну точність значення.
Атомні ваги, молекулярні ваги та формульні ваги
Молекули складаються з атомів, тому молекулярна маса - це лише сума атомних ваг елементів, які вона містить.
Яка молекулярна маса сірчаної кислоти,\(H_2SO_4\)?
Рішення
Атомні ваги водню і кисню складають 1,01 і 16,00 відповідно (ці загальні значення повинні бути запам'ятовані.) З таблиці можна виявити, що атомна маса сірки дорівнює 32.06. Склавши все, у нас є
\[(2 \times 1.01) + 32.06 + (4 \times 16.00) = 98.08\]
Оскільки деякі тверді речовини не складаються з дискретних молекул (хлорид натрію, NaCl та кремнезем, SiO 2 є поширеними прикладами), термін вага формули часто використовується замість молекулярної маси. Загалом, терміни молекулярна маса і вага формули взаємозамінні.
Ізотопна фракціонування
Ізотопи даного елемента настільки схожі за своєю хімічною поведінкою, що те, які невеликі відмінності можуть існувати, можна вважати незначними для більшості практичних цілей. Однак важчі ізотопи мають тенденцію реагувати або випаровуватися трохи повільніше, ніж легші, так що, враховуючи достатньо часу, різні геохімічні процеси можуть призвести до збагачення одного ізотопу над іншим, ефект, відомий як геохімічне ізотопне фракціонування.
Які відмінності існують найбільш очевидні в більш легких елементах, і особливо у водні, три ізотопи якого відрізняються за масою порівняно великими кількостями. Таким чином, «важка вода», D 2 O (2 H 2 O) розкладається електролізом не так швидко, як 1 Н 2 О, тому вона збагачується в нерозкладеної частини води в електролізному апараті. Його температура кипіння становить 101,7° C і замерзає при 3,8°. Тварини загинуть, якщо будуть пити важку воду замість звичайної води.
Хвилинні відмінності між поведінкою більшості ізотопів є неоціненним інструментом для досліджень у галузі геохімії. Наприклад, крихітна частка молекул води, що містять O 18, випаровується повільніше, ніж легша (і набагато більш рясна) H 2 O 16. А ось співвідношення О 18 до О 16 у воді, яка випаровується, залежить від температури, при якій відбувається цей процес. Спостерігаючи це співвідношення в льодовикових ядрах льоду і в морських карбонатних відкладах, можна визначити середню температуру землі в різний час минулого.
Атомні маси
Ось знову початок шкали атомної ваги, яку ви бачили вище:

Ви вже розумієте, що атомні ваги - це відносні ваги, засновані на шкалі, визначеній 6 C 12 = 12. Але який абсолютна вага атома, виражений в грамах або кілограмах? Іншими словами, яку фактичну масу представляє кожна одиниця на атомній шкалі ваги?
Відповідь - 1,66053886 × 10 —27 кг. Ця величина (значення якої вам не потрібно запам'ятовувати) відома як уніфікована одиниця атомної маси, що позначається абревіатурою u або amu. Уніфікована одиниця атомної маси визначається як 1/12 маси одного атома вуглецю-12. На щастя, вам не потрібно запам'ятовувати це значення, тому що ви можете легко обчислити його значення з числа Авогадро, N A, яке ви, як очікується, дізнаєтеся:
\[1\, u = \dfrac{1}{N_A} \;g = \dfrac{1}{1000\; N_A} \;Kg\]
Примітка: Визначення одиниці атомної маси
Уніфікована одиниця атомної маси визначається як 1/12 маси одного атома вуглецю-12.
Маси субатомних частинок
Атоми складаються з протонів, нейтронів і електронів, властивості яких наведені нижче:
|
частинки
|
маса, г
|
маса, у
|
заряджати
|
символ
|
|---|---|---|---|---|
| електрон | 9 1093897 × 10 — 28 | 5 48579903 × 10 - 4 | 1— | \(\ce{_{–1}^{0}e}\) |
| протона | 1,67 26231 × 10 - 24 | 1,007276470 | 1+ | \(\ce{_1^0H^{+}}\)або\(\ce{_1^0p}\) |
| нейтрон | 1,67 49286 × 10 - 24 | 1,008664904 | 0 | \(\ce{_1^0n}\) |
З таблиці слід зазначити два важливих моменти\(\PageIndex{1}\):
- Маса електрона незначна порівняно з масою двох ядерних частинок;
- Протон і нейтрон мають маси, які майже, але не точно ідентичні.
Ядерні маси
Як ми вже згадували в одному з прикладів проблеми вище, маса ядра завжди трохи відрізняється від мас нуклонів (протонів і нейтронів), з яких воно складається. Різниця, відома як дефект маси, пов'язана з енергією, пов'язаною з утворенням ядра через знамениту формулу Ейнштейна e = mc 2. Це єдиний приклад в хімії, в якому необхідно враховувати збереження масової енергії, а не тільки маси. Але немає необхідності, щоб ви переймалися цим в цій частині курсу.
Для всіх практичних цілей, поки ви не прийдете до розділу курсу з ядерної хімії, можна вважати, що протон і нейтрон мають маси близько 1 u, і що маса атома (в u) - це всього лише сума чисел нейтронів і протонів.
