4.2: Число Авогадро і кріт
- Page ID
- 19231
Переконайтеся, що ви добре розумієте наступні основні ідеї:
- Визначте число Авогадро і поясніть, чому це важливо знати.
- Визначаємо родимку. Вміти розрахувати кількість молів в заданій масі речовини, або масу, відповідну заданому числу молей.
- Визначте молекулярну масу, масу формули та молярну масу; поясніть, чим остання відрізняється від перших двох.
- Вміти знайти кількість атомів або молекул в заданій вазі речовини.
- Знайдіть молярний обсяг твердої речовини або рідини, враховуючи його щільність і молярну масу.
- Поясніть, як молярний об'єм металевого твердого тіла може призвести до оцінки атомного діаметра.
Хімічні зміни, які ми спостерігаємо, завжди включають дискретні числа атомів, які переставляються на нові конфігурації. Ці цифри HUGE— занадто великі за величиною для нас, щоб підрахувати або навіть візуалізувати, але вони все ще числа, і ми повинні мати спосіб мати справу з ними. Нам також потрібен міст між цими числами, які ми не можемо виміряти безпосередньо, і вагами речовин, які ми вимірюємо і спостерігаємо. Концепція крота забезпечує цей міст і є центральним для всієї кількісної хімії.
Підрахунок атомів: число Авогадро
Через їх крихітні розміри атоми і молекули не можуть бути підраховані прямим спостереженням. Але так само, як ми робимо при «підрахунку» бобів в банку, ми можемо оцінити кількість частинок у зразку елемента або з'єднання, якщо маємо деяке уявлення про обсяг, зайнятий кожною частинкою, і об'ємі контейнера. Після того, як це буде зроблено, ми знаємо кількість одиниць формули (щоб використовувати найзагальніший термін для будь-якої комбінації атомів, які ми хочемо визначити) у будь-якій довільній вазі речовини. Число, звичайно, буде залежати як від формули речовини, так і від ваги зразка. Однак якщо розглядати вагу речовини, яка така ж, як і його формула (молекулярна) маса, виражена в грамах, нам потрібно знати лише одне число: число Авогадро.
Номер Авогадро
Число Авогадро відомо десятьма значущими цифрами:
\[N_A = 6.022141527 \times 10^{23}.\]
Однак знати його потрібно лише до трьох значущих цифр:
\[N_A \approx 6.02 \times 10^{23}. \label{3.2.1}\]
Так\(6.02 \times 10^{23}\) з чого? Ну, з чого завгодно: яблука, зірки на небі, буріто. Однак єдиним практичним застосуванням\(N_A\) є більш зручний спосіб вираження величезної кількості крихітних частинок, таких як атоми або молекули, з якими ми маємо справу в хімії. Число Авогадро - це збірне число, точно так само, як і десяток. Студенти можуть думати про\(6.02 \times 10^{23}\) «аптечну десятку».
Перш ніж використовувати номер Авогадро в проблемах, знайдіть хвилинку, щоб переконати себе в міркуваннях, втілених у наступних прикладах.
Атомарні ваги кисню і вуглецю складають 16,0 і 12,0 одиниць атомної маси (\(u\)) відповідно. Наскільки важчий атом кисню по відношенню до вуглецю?
Рішення
Атомні ваги представляють відносні маси різних видів атомів. Це означає, що атом кисню має масу, яка
\[\dfrac{16\, \cancel{u}}{12\, \cancel{u}} = \dfrac{4}{3} ≈ 1.33 \nonumber\]
настільки ж велика, як маса атома вуглецю.
Абсолютна маса атома вуглецю становить 12,0 уніфікованих одиниць атомної маси (\(u\)). Скільки грамів буде важити один атом кисню?
Рішення
Абсолютна маса атома вуглецю становить 12,0\(u\) або
\[12\,\cancel{u} \times \dfrac{1.6605 \times 10^{–24}\, g}{1 \,\cancel{u}} = 1.99 \times 10^{–23} \, g \text{ (per carbon atom)} \nonumber\]
Маса атома кисню буде на 4/3 більше (з Прикладу\(\PageIndex{1}\)):
\[ \left( \dfrac{4}{3} \right) 1.99 \times 10^{–23} \, g = 2.66 \times 10^{–23} \, g \text{ (per oxygen atom)} \nonumber\]
Крім того, ми можемо зробити розрахунок безпосередньо, як з вуглецем:
\[16\,\cancel{u} \times \dfrac{1.6605 \times 10^{–24}\, g}{1 \,\cancel{u}} = 2.66 \times 10^{–23} \, g \text{ (per oxygen atom)} \nonumber\]
Припустимо, що у нас\(N\) є атоми\(N\) вуглецю, де число досить велике, щоб дати нам купу атомів вуглецю, маса яких становить 12,0 грам. Скільки б важить стільки\(N\) ж атомів кисню?
Рішення
Ми\(\PageIndex{1}\) знову використовуємо результати з Example. Збір атомів\(N\) кисню мав би масу
\[\dfrac{4}{3} \times 12\, g = 16.0\, g. \nonumber\]
Що таке числове значення\(N\) в прикладі\(\PageIndex{3}\)?
- Відповідь
-
Використовуючи результати Приклади\(\PageIndex{2}\) і\(\PageIndex{3}\).
\[N \times 1.99 \times 10^{–23} \, g \text{ (per carbon atom)} = 12\, g \nonumber\]
або
\[N = \dfrac{12\, \cancel{g}}{1.99 \times 10^{–23} \, \cancel{g} \text{ (per carbon atom)}} = 6.03 \times 10^{23} \text{atoms} \nonumber \]
У 12 г вуглецю багато атомів.
Що потрібно зрозуміти про число Авогадро
- Це число, так само, як і «десятка», і, таким чином, безрозмірна.
- Це величезна кількість, набагато більша за величиною, ніж ми можемо візуалізувати
- Його практичне використання обмежується підрахунком крихітних речей, таких як атоми, молекули, «формульні одиниці», електрони або фотони.
- Значення N A можна знати лише з тією точністю, що кількість атомів у вимірюваній вазі речовини можна оцінити. Оскільки велику кількість атомів неможливо підрахувати безпосередньо, було проведено безліч геніальних непрямих вимірювань за участю таких речей, як броунівський рух та рентгенівське розсіювання.
- Поточна величина визначалася шляхом вимірювання відстаней між атомами кремнію в надчистому кристалі цього елемента, який був сформований в ідеальну сферу. (Вимірювання проводилося шляхом рентгенівського розсіювання.) У поєднанні з виміряною масою цієї сфери вона дає число Авогадро. Однак з цим є дві проблеми:
- Кремнієва сфера - це артефакт, а не те, що відбувається в природі, і, таким чином, може бути не ідеально відтворюваним.
- Стандарт маси, кілограм, точно не відомий, і його величина, здається, змінюється. З цих причин є пропозиції переглянути визначення як N A, так і кілограма.
Кроти та їх використання
Моль (скорочено моль) - це міра СІ кількості «хімічної сутності», яка може бути атомом, молекулою, формулою одиниці, електроном або фотоном. Один моль чогось - це просто номер Авогадро, що щось. Або, якщо ви думаєте, як юрист, ви можете віддати перевагу офіційному визначенню СІ:
Моль - це кількість речовини системи, яка містить стільки елементарних сутностей, скільки атомів в 0,012 кілограма вуглецю 12.
Число Авогадро (Equation\ ref {3.2.1}), як і будь-яке чисте число, є безрозмірним. Однак він також визначає моль, тому ми також можемо висловити N A як 6.02 × 10 23 моль —1; у цій формі він належним чином відомий як константа Авогадро. Ця конструкція підкреслює роль числа Авогадро як коефіцієнта перетворення між кількістю родимок та кількістю «сутностей».
Скільки молей атомів нікелю в 80 атомах нікелю?
Рішення
\[\dfrac{80 \;atoms}{6.02 \times 10^{23} \; atoms\; mol^{-1}} = 1.33 \times 10^{-22} mol \nonumber\]
Чи розумна ця відповідь? Та тому, що 80 - це вкрай мала частка\(N_A\).
Молярна маса
Атомна маса, молекулярна маса або формульна маса одного моля фундаментальних одиниць (атомів, молекул або груп атомів, які відповідають формулі чистої речовини) - це відношення його маси до 1/12 маси одного моля атомів С 12, а будучи співвідношенням, безрозмірна. Але в той же час ця молярна маса (як багато хто зараз вважають за краще її називати) також є спостережуваною масою однієї молі (N A) речовини, тому ми часто підкреслюємо це, заявляючи про це явно як стільки грамів (або кілограмів) на моль: g моль —1.
Важливо завжди мати на увазі, що родимка - це число, а не маса. Але кожна окрема частка має масу свою, тому моль будь-якого конкретного речовини завжди буде відповідати певній масі цієї речовини.
Бура - загальна назва тетраборату натрію,\(\ce{Na2B4O7}\).
- скільки родимок бору присутній в 20,0 г бури?
- скільки грам бору присутній в 20,0 г бури?
Рішення
Вага формули\(\ce{Na2B4O7}\) так молекулярна маса:
\[(2 \times 23.0) + (4 \times 10.8) + (7 \times 16.0) = 201.2 \nonumber\]
- 20 г бури містить (20,0 г) ÷ (20,0 г моль —1) = 0,10 моль бури, і таким чином 0,40 моль В.
- 0,40 моль бору має масу (0,40 моль) × (10,8 г моль —1) = 4,3 г.
Рослинний фотосинтетичний пігмент хлорофіл містить 2,68 відсотка магнію за вагою. Скільки атомів Mg буде в 1,00 г хлорофілу?
Рішення
Кожен грам хлорофілу містить 0,0268 г Mg, атомна маса 24,3.
- Кількість родимок в цій вазі Mg: (.0268 г)/(24,2 г моль —1) = 0,00110 моль
- Кількість атомів: (0,00110 моль) × (6.02E23 моль —1) =\(6.64 \times 10^{20}\)
Чи розумна ця відповідь? (Завжди будьте підозрілі до відповідей величезної кількості!) Так, тому що ми очікували б мати величезну кількість атомів у будь-якій спостережуваній кількості речовини.
Молярний об'єм
Це обсяг, який займає один моль чистої речовини. Молярний об'єм залежить від щільності речовини і, як і щільність, змінюється в залежності від температури внаслідок теплового розширення, а також від тиску. Для твердих речовин і рідин ці змінні зазвичай мають невеликий практичний ефект, тому значення, вказані для тиску 1 атм і 25° C, як правило, корисні в досить широкому діапазоні умов. Це точно не стосується газів, молярні обсяги яких необхідно розраховувати під конкретну температуру і тиск.
Метанол, СН 3 ОН, являє собою рідину, що має щільність 0,79 г на мілілітр. Обчисліть молярний обсяг метанолу.
Рішення
Молярним об'ємом буде обсяг, який займає одна молярна маса (32 г) рідини. Висловлюючи щільність в літрах замість мл, ми маємо
\[V_M = \dfrac{32\; g\; mol^{–1}}{790\; g\; L^{–1}}= 0.0405 \;L \;mol^{–1} \nonumber\]
Молярний об'єм металевого елемента дозволяє оцінити розмір атома. Ідея полягає в тому, щоб подумки розділити шматок металу на стільки маленьких кубічних коробок, скільки атомів, а потім обчислити довжину кожної коробки. Припускаючи, що атом сидить в центрі кожної коробки і що кожен атом знаходиться в безпосередньому контакті зі своїми шістьма сусідами (по два вздовж кожного виміру), це дає діаметр атома. Спосіб, яким атоми упаковуються разом у фактичні металеві кристали, як правило, складніше, ніж це, і він варіюється від металу до металу, тому цей розрахунок забезпечує лише приблизне значення.
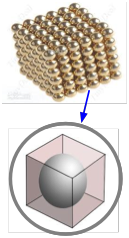
Щільність металевого стронцію становить 2,60 г см —3. Використовуйте це значення для оцінки радіуса атома Sr, атомна маса якого дорівнює 87,6.
Рішення
Молярний об'єм Sr становить:
\[\dfrac{87.6 \; g \; mol^{-1}}{2.60\; g\; cm^{-3}} = 33.7\; cm^3\; mol^{–1}\]
Обсяг кожної «коробки» дорівнює»
\[\dfrac{33.7\; cm^3 mol^{–1}} {6.02 \times 10^{23}\; mol^{–1}} = 5.48 \times 10^{-23}\; cm^3\]
Довжина сторони кожного ящика буде кубовим коренем цього значення,\(3.79 \times 10^{–8}\; cm\). Атомний радіус буде дорівнює половині цього значення, або
\[1.9 \times 10^{–8}\; cm = 1.9 \times 10^{–10}\; m = 190 pm\]
Примітка: У вашому калькуляторі, ймовірно, немає кнопки кореня куба, але, як очікується, ви зможете знайти коріння куба; зазвичай ви можете використовувати кнопку x y з y = 0.333. Ви також повинні мати можливість оцінити величину цього значення для перевірки. Найпростіший спосіб - висловити число так, щоб показник був кратний 3. Візьмемо\(54 \times 10^{-24}\), наприклад. Оскільки 3 3 = 27 і 4 3 = 64, ви знаєте, що корінь куба 55 буде між 3 і 4, тому корінь куба повинен бути трохи менше 4 × 10 —8.
Так наскільки хороший наш атомний радіус? Стандартні таблиці дають атомний радіус стронцію знаходиться в межах 192-220 пм.
