Лавуазьє
- Page ID
- 24642
Навички для розвитку
- Зрозумійте, чому Лавуазьє іноді називають «батьком сучасної хімії»
- Відрізнити точність від точності
Так що ж сталося, щоб перетворити алхімію, яка була схожа на чарівне зілля в Гаррі Поттері, в науку хімії? Це був вимір. Ретельне, ретельне вимірювання величин, таких як маси, обсяги, щільність, температура, тиск.
Раннім героєм вимірювання був Антуан Лавуазьє. Він був одним з перших справжніх вчених-хіміків. Він проводив ретельні експерименти, і намагався робити ніяких висновків, крім тих, які вимагають його дані. Він сказав, що факт, ідея та слово повинні бути максимально тісно пов'язані: що ви не можете вдосконалити свою мову, не покращуючи своє мислення, і ви не можете покращити своє мислення, не покращуючи свою мову. Тож він створив систематичну хімічну номенклатуру, яку ми використовуємо сьогодні. Чудово, якщо прочитати його текст, написаний в 1789 році, призначений для того, щоб познайомити з хімією новачкам, значна частина все ж цілком зрозуміла і навіть коректна за сучасними мірками.
.jpg)
Лавуазьє спочатку описує стани речовини: гази, рідини і тверді речовини. Він вказує, коли твердий матеріал нагрівається, він має тенденцію до розширення, стаючи спочатку рідиною, яка займає постійний обсяг, але може наливатися, на відміну від твердого. Більше нагрівання, і він стає газом, який він описує як еластичний, оскільки він буде розширюватися або стискуватися до різних обсягів в залежності від тиску. На відміну від грецьких філософів, він розумів, що це фізична зміна, а не хімічна зміна, і він має хорошу субмікроскопічну інтуїцію того, що відбувається: частинки матеріалу не змінюються, вони просто розбираються далі.
Він визнав такими елементами: кисень, азот, водень, сірку, фосфор, хлор і фтор (хоча і не знав їх елементарних форм), вуглець, залізо, мідь, срібло, золото, ртуть, свинець, олово, сурма, миш'як, вісмут, кобальт, марганець, молібден, нікель, платина, вольфрам, цинк.
Він спалював сірку і фосфор і деревне вугілля (вуглець) і робив ретельні спостереження, часто використовуючи дзвін банку над відром ртуті, як показано на кресленні з його книги, рис. 1. Це приклад хімічної зміни або хімічної реакції, при якій хімічні реагенти перетворюються на різні хімічні речовини продукту. Якщо запалити сірку в посуді з маркуванням D під дзвіночком з повітрям, вона горить, поки вона не згасне, залишаючи зайву сірку. Повітря, що залишився в банку, вже не годиться для дихання. Якщо покласти мишку в банку, вона загине, так само, як це робило полум'я. Це демонструє поняття граничного реагенту. Реакція або горіння припинилися, коли в ній закінчився кисень, залишаючи в першу чергу азот (і кілька слідів інших газів) в банку. Прістлі, інший вчений, показав йому, як готувати чистий кисневий газ, і він використовував це для проведення багатьох експериментів з горінням.
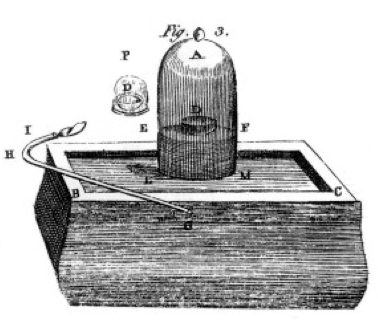
Лавуазьє був одержимий вимірюванням. Він розробив складний апарат для вимірювання всього. Він спалював фосфор, як показано на малюнку 1, і спостерігав за утворенням білого лускатистого продукту. Фосфор (реагент в даному випадку) не був водорозчинний, але продукт був, тому він збирав продукт дуже обережно, відокремлюючи його від не відреагував фосфору шляхом промивання водою. Після висихання він міг виміряти, скільки спалило фосфору, скільки було витрачено кисню (тому що він знав щільність газу кисню), і скільки продукту утворилося. Він виявив, що маса продукту - це сума мас споживаного реагенту в кожному експерименті. Це закон збереження маси (яким, власне, користувалися і деякі раніше алхіміки і хіміки). Він також зауважив, що фосфор не має смаку, але продукт, який він назвав фосфорною кислотою, кислий. Він знав з цих експериментів, що в багатьох випадках елементи поєднуються тільки в певних пропорціях, а також, що кисень може поєднуватися з сіркою, фосфором і т. Д. В двох різних співвідношеннях. Він дав нам термінологію, яку ми використовуємо і сьогодні: сірчана кислота складається з сірки і більше кисню, сірчана кислота складається з сірки і менше кисню. -ous означає менше кисню; -ic означає більше кисню. Докладніше дивіться на сторінці номенклатури.
Лавуазьє приділяв пильну увагу точності і точності. Наприклад, в експерименті, який ми тільки що описали, він вимірював обсяг газу в розтрубній банці, до і після реакції, але зазначив, що після реакції необхідно почекати, поки температура не повернеться до тієї, яка була, коли ви вимірювали спочатку. Якщо газ гарячий при вимірі його обсягу після реакції, він розшириться, і ваша стандартна щільність не буде застосовуватися. Це призведе до систематичної помилки у вимірах: кожен раз, коли ви проводите експеримент, ви будете думати, що залишається більше газу, ніж насправді, і ваше вимірювання не буде точним. Якщо середній результат вашого експерименту близький до правильного значення, він точний. Однак, якщо ваш експеримент дає дуже різні цифри кожного разу, навіть якщо середнє значення правильне, а експеримент точний, це не точно. Точність - це різниця між зустріччю «близько 2 годин» та зустріччю «за 3 хвилини та 27 секунд до 14:00». Точність - це те, наскільки ви конкретні, скільки деталей ви використовуєте. Лавуазьє також допоміг розробити систему одиниць (кг, Л, м), які в даний час використовуються в Кореї та багатьох інших країнах.

Загалом, хоча він не робив дуже багато оригінальних експериментів, яких ніхто не робив раніше, він робив свої експерименти дуже обережно, тому вони були максимально точними і точними, а потім він чітко подумав про них і створив слова, щоб описати хімічні речовини та ідеї, які допомогли зробити все зрозуміліше. Якщо ви прочитаєте підручник з хімії, написаний до Lavoiser, ви будете дуже заплутані, тому що назви хімічних речовин базуватимуться на історії (і звучало б, як вони походять від Гаррі Поттера), а не базуючись на тому, що хімічні речовини. Якщо ви читаєте текст хімії, написаний після Lavoiser, ви розпізнаєте мову як подібну до того, що ми використовуємо сьогодні.
Резюме
Точність описує, наскільки близьке виміряне значення до фактичного значення. Точність описує, наскільки добре група вимірюваних значень узгоджується один з одним. Закон збереження маси говорить, що матерія не може бути ні створена, ні зруйнована хімічним або фізичним процесом. Це призводить до того, що сума мас реагенту, витраченого в будь-якому експерименті, дорівнює масі продукту. Хімічні зміни включають зміну хімічної ідентичності речовини таким чином, що утворюються нові речовини. Фізичні зміни передбачають зміну речовини без зміни його хімічної ідентичності. Горіння та іржавіння - два приклади хімічних процесів під час кип'ятіння та плавлення - приклади фізичних процесів. Хімічні реакції передбачають перетворення реагентів, хімічних речовин, які споживаються в процесі хімічної зміни, в продукти, хімічні речовини, що утворюються в процесі хімічної зміни, які мають інший склад від реагентів. Граничний реагент визначає або обмежує кількість продукту, який може бути отриманий в результаті хімічної реакції.