9.5: Спирти, феноли та ефіри
- Опишіть будову і властивості спиртів, ефірів і фенолів.
- Знайте назву та використання простих спиртів, фенолів та ефірів.
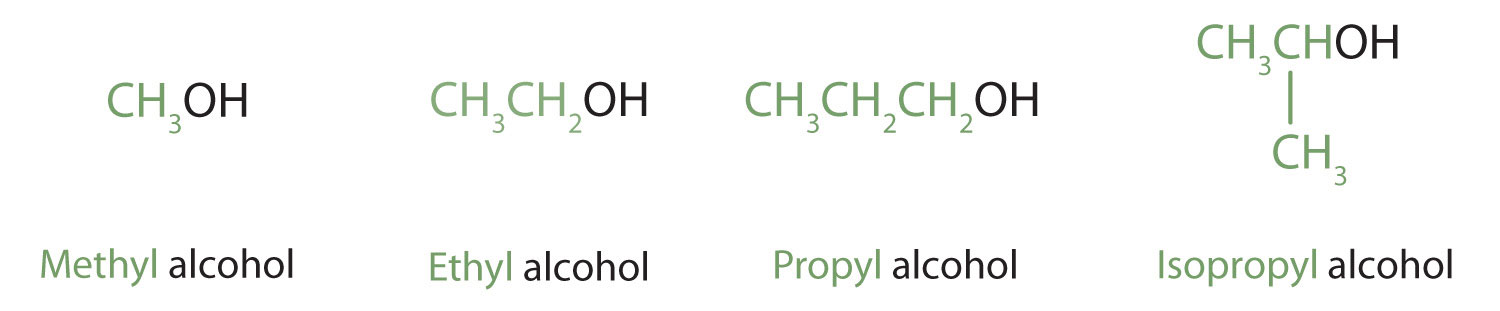
Спирт - це органічна сполука з гідроксильною (ОН) функціональною групою на аліфатичному атомі вуглецю. Оскільки ОН - функціональна група всіх спиртів, ми часто представляємо спирти за загальною формулою ROH, де R - алкільна група. Спирти поширені в природі. Більшість людей знайомі з етиловим спиртом (етанолом), діючою речовиною в алкогольних напоях, але це з'єднання є лише одним із сімейства органічних сполук, відомих як спирти. У сім'ю також входять такі звичні речовини, як холестерин і вуглеводи. Метанол (СН 3 ОН) і етанол (СН 3 СН 2 ОН) є першими двома членами гомологічного ряду спиртів.
Номенклатура спиртів
Спирти з одним - чотирма атомами вуглецю часто називають загальними назвами, в яких за назвою алкільної групи слідує слово спирт:
За даними Міжнародного союзу чистої та прикладної хімії (IUPAC), назва спирту походить від вуглеводню, з якого він був отриманий. Остаточний -e в назві вуглеводню замінюється на -ол, а атом вуглецю, з яким пов'язана група —OH, позначається числом, розміщеним перед назвою.
Розглянемо наступний приклад. Як його слід назвати?
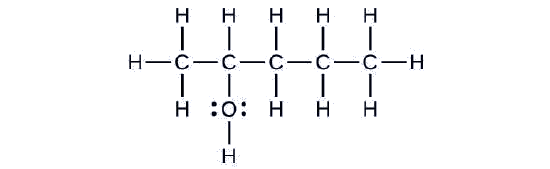
Рішення
Вуглецевий ланцюг містить п'ять атомів вуглецю. Якби гідроксильної групи не було, ми б назвали цю молекулу пентаном. Для вирішення того, що гідроксильна група присутня, міняємо закінчення назви на -ол. У цьому випадку, оскільки —OH приєднаний до вуглецю 2 в ланцюжку, ми б назвали цю молекулу 2-пентанол.
Назвіть наступну молекулу:
- Відповідь
-
2-метил-2-пентанол
IUPAC прийняв нові керівні принципи номенклатури в 2013 році, які вимагають, щоб цей номер розміщувався як «інфікс», а не префікс. Наприклад, нова назва 2-пропанолу буде пропан-2-ол. Широке прийняття цієї нової номенклатури займе деякий час, і студентам рекомендується бути знайомими як зі старими, так і з новими протоколами іменування.
Розглянемо наступний приклад. Як він повинен бути названий відповідно до керівних принципів, прийнятих у 2013 році?

Рішення
Вуглецевий ланцюг містить чотири атома вуглецю. Якби гідроксильної групи не було, ми б назвали цю молекулу бутаном. Для вирішення того, що гідроксильна група присутня, міняємо закінчення назви на -ол. У цьому випадку, оскільки —OH приєднаний до вуглецю 2 в ланцюжку, ми б назвали цю молекулу бутан-2-ол.
«Завжди розміщуйте OH на найменший можливий номер для ланцюга».
У попередньому прикладі, якби атоми вуглецю були пронумеровані зліва направо, то ОН був би поміщений на третій вуглець, а молекула була б названа бутан-3-ол, але бутан-2-ол є більш бажаною назвою.
Назвіть наступні молекули відповідно до керівних принципів, прийнятих у 2013 році?
а.

б.

- Відповідь
-
а. пропан-2-ол
б. гексан-2-ол
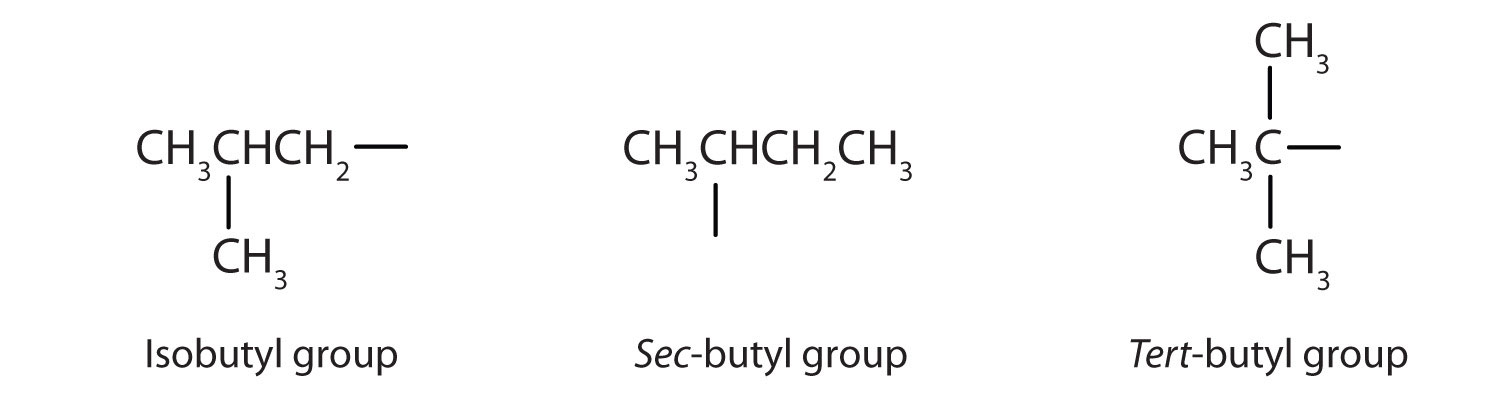
Таблиця9.5.1 назв і класифікує деякі з більш простих спиртів. Деякі загальні назви відображають класифікацію сполуки як вторинної (сек -) або третинної (tert -). Ці позначення не використовуються в номенклатурній системі IUPAC для спиртів. Зверніть увагу, що в таблиці є чотири бутилових спирту, що відповідають чотирьом бутиловим групам: бутилової групи (CH 3 CH 2 CH 2), обговорюваної раніше, і трьох інших:
| Конденсована структурна формула | Загальна назва | Ім'я ІУПАК |
|---|---|---|
| СН 3 ОН | деревний спирт (метиловий спирт) | метанол |
| СН 3 СН 2 ОН | спирт зерновий (етиловий спирт) | етанолу |
| СН 3 СН 2 СН 2 ОН | спирт пропіловий | 1-пропанол |
| (СН 3) 2 ЧОХ | спирт протирання (ізопропіловий спирт) | 2-пропанол |
| СН 3 СН 2 СН 2 СН 2 ОН | бутиловий спирт | 1-бутанол |
| СН 3 СН 2 ЧОХЧ 3 | сек -бутиловий спирт | 2-бутанол |
| (СН 3) 2 ЧЧ 2 ОН | ізобутиловий спирт | 2-метил-1-пропанол |
| (СН 3) 3 СОН | трет-бутиловий спирт | 2-метил-2-пропанол |
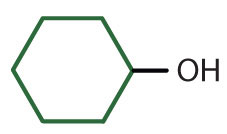 |
циклогексиловий спирт | циклогексанол |
Метанол (метиловий спирт)
Метанол, також відомий як метиловий спирт серед інших, є хімічною речовиною з формулою CH 3 OH (метильна група, пов'язана з гідроксильною групою, часто скорочено MeOH). Метанол придбав назву деревний спирт тому, що колись його виробляли головним чином шляхом руйнівної перегонки деревини. Сьогодні метанол в основному виробляється промисловим шляхом гідрування чадного газу.
СО (г) + 2Н 2 (г) → СН 3 ОН (л)
Метанол - найпростіший спирт, що складається з метильної групи, пов'язаної з гідроксильною групою. Це легка, летюча, безбарвна легкозаймиста рідина з характерним запахом, схожим на запах етанолу (питний алкоголь). При кімнатній температурі це полярна рідина. З більш ніж 20 мільйонів тонн виробляється щорічно, він використовується як паливна добавка і як попередник інших товарних хімічних речовин, включаючи формальдегід, оцтову кислоту, метилтрет-бутиловий ефір, а також безліч більш спеціалізованих хімічних речовин.
Етанол (етиловий спирт)
Етанол (також називають етиловим спиртом, зерновим алкоголем, вживанням алкоголю або просто алкоголем) - це хімічна сполука, простий алкоголь з хімічною формулою C 2 H 6 O. Його формулу також можна записати як CH 3 - CH 2 −OH або C 2 H 5 OH (етилова група, пов'язана з гідроксильною групою), і часто скорочується як eToH. Етанол - летюча, легкозаймиста безбарвна рідина з легким характерним запахом. Це психоактивна речовина і є основним видом алкоголю, що міститься в алкогольних напоях.
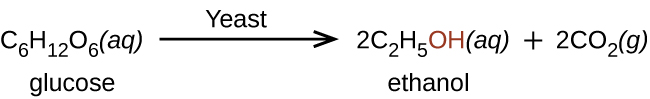
Етанол природним чином виробляється шляхом бродіння цукрів дріжджами або за допомогою нафтохімічних процесів, і найчастіше споживається як популярний рекреаційний препарат. Етанол - це алкоголь, вироблений деякими видами дріжджів, який міститься у вині, пиві та дистильованих напоях. Він давно готується людиною, використовуючи метаболічні зусилля дріжджів при бродінні різних цукрів:
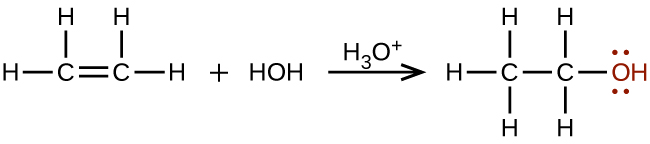
Великі кількості етанолу (для промислового використання) синтезуються з реакції додавання води з етиленом з використанням кислоти в якості каталізатора:
Етанол також має медичне застосування як антисептичний та дезінфікуючий засіб. З'єднання широко використовується як хімічний розчинник, або для наукових хімічних випробувань, або для синтезу інших органічних сполук, і є життєво важливою речовиною, що використовується в багатьох різних видах обробної промисловості. Етанол також використовується як джерело чистого горіння палива.
Токсичність спиртів
Щодо гострої токсичності прості спирти мають низьку гостру токсичність. Дози в кілька мілілітрів переносяться. Для пентанолів, гексанолов, октанолів і більш довгих спиртів ЛД50 (летальна доза, 50%) коливається від 2-5 г/кг (щурів, перорально). Метанол і етанол менш гостро токсичні. Однак метанол набагато токсичніший, ніж етанол. Всі спирти є м'якими подразниками шкіри.
На метаболізм метанолу (і етиленгліколю) впливає наявність етанолу, який має більш високу спорідненість до алкогольдегідрогенази печінки. Таким чином метанол буде виводитися неушкодженим з сечею.
Безпосередня дія алкоголю залежить від концентрації алкоголю в крові п'є (BAC). BAC може бути різним для кожної людини залежно від їх віку, статі, існуючого стану здоров'я, навіть якщо вони п'ють однакову кількість алкоголю.
Різні БАК мають різний ефект. У таблиці9.5.2 наведено загальний вплив алкоголю на організм в залежності від БАК. Однак толерантність значно варіюється між окремими особами, як і індивідуальна реакція на дану дозу; Ефекти алкоголю сильно відрізняються між людьми. Отже, у цьому контексті відсотки BAC - це лише оцінки, що використовуються для ілюстративних цілей.
| мг/дл | Мм |
Рівень алкоголю в крові % в/в |
Ефекти |
|---|---|---|---|
| 50 | 11 | 0,05% | Ейфорія, балакучість, релаксація |
| 100 | 22 | 0,1% | Пригнічення центральної нервової системи, нудота, можлива блювота, порушення рухової та сенсорної функції, порушення пізнання |
| >140 | 30 | > 0,14% | Зниження припливу крові до мозку |
| 300 | 65 | 0,3% | Задурення, можливе несвідомість |
| 400 | 87 | 0,4% | Можлива смерть |
| 500 | 109 | > 0,55% | Смерть |
- Спирт для протирання відноситься або до ізопропілового спирту (пропан-2-ол), або рідин на основі етанолу. Втирання спирту не можна пити, навіть якщо він на основі етанолу, через додані гіркі речовини. Етикетки продуктів для протирання алкоголю містять ряд попереджень про хімічну речовину, включаючи небезпеку горючості та його цільове використання лише як місцевий антисептик, а не для внутрішніх ран або споживання. Його слід використовувати в добре провітрюваному приміщенні через небезпеку інгаляції. Отруєння може статися від прийому всередину, вдихання, всмоктування або вживання спирту для розтирання.
Багатофункціональні спирти
Поліол - це органічна сполука, що містить множинні гідроксильні групи. Приклади поліолів, розглянуті в цьому розділі, включають етиленгліколь, пропіленгліколь та гліцерин.
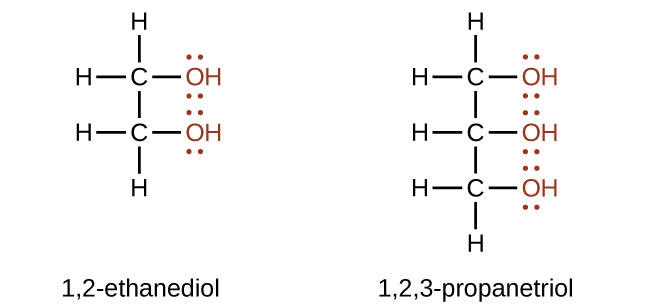
Можна виготовляти спирти, що містять дві і більше гідроксильних груп. Приклади включають 1,2-етандіол (етиленгліколь, який використовується в антифризі) і 1,2,3-пропанетріол (гліцерин, використовується як розчинник для косметики і лікарських засобів):
Етиленгліколь (назва IUPAC: етан-1,2-діол) - органічна сполука з формулою (CH 2 OH) 2. В основному використовується для двох цілей, як сировина при виробництві поліефірних волокон і для рецептур антифризу. Це в'язка рідина без запаху, безбарвна, солодкувата на смак. Етиленгліколь токсичний. Домашні вихованці особливо схильні до отруєння етиленгліколем від витоків антифризу автомобіля.


Пропіленгліколь (назва IUPAC: пропан-1,2-діол) - органічна сполука з хімічною формулою CH 3 CH (OH) CH 2 OH. Це в'язка безбарвна рідина, яка майже не має запаху, але має слабко солодкий смак. Містить дві спиртові групи, він класифікується як діол. Він змішується з широким спектром розчинників, включаючи воду, ацетон та хлороформ. В цілому гліколі не дратівливі, мають дуже низьку летючість і дуже низьку токсичність.


Сорок п'ять відсотків виробленого пропіленгліколю використовується в якості хімічної сировини для виробництва ненасичених поліефірних смол. Пропіленгліколь також використовується в різних їстівних продуктах, таких як напої на основі кави, рідкі підсолоджувачі, морозиво, збиті молочні продукти та сода. Випарники, що використовуються для доставки фармацевтичних препаратів або засобів особистої гігієни, часто включають пропіленгліколь серед інгредієнтів. У дезінфікуючих засобах для рук на спиртовій основі він використовується як зволожувач для запобігання висихання шкіри. Пропіленгліколь використовується як розчинник у багатьох фармацевтичних препаратах, включаючи пероральні, ін'єкційні та місцеві склади, такі як для діазепаму та лоразепаму, які не розчиняються у воді. Деякі склади штучних сліз, такі як Систан, використовують пропліенгліколь як інгредієнт. Пропіленгліколь часто використовується як замінник етиленгліколю при низькій токсичності, екологічно чистому автомобільному антифризі. Застосовується також для утеплення сантехнічних систем в вільних спорудах.
Гліцерин (/ˈlɪsərl/; також називається гліцерином або гліцерином; див. Правописні відмінності) - це проста поліолова сполука. Це безбарвна в'язка рідина без запаху, яка є солодким на смак і нетоксична. Гліцериновий кістяк міститься в багатьох ліпідів, які відомі як гліцериди. Він широко використовується в харчовій промисловості як підсолоджувач і зволожувач у фармацевтичних рецептурах. Гліцерин має три гідроксильні групи, які відповідають за його розчинність у воді і його гігроскопічність.

У продуктах харчування та напоях гліцерин служить зволожувачем, розчинником та підсолоджувачем і може допомогти зберегти продукти. Він також використовується як наповнювач у комерційно приготованих продуктах з низьким вмістом жиру (наприклад, печиво), а також як загущувач у лікерах. Гліцерин і вода використовуються для збереження деяких видів листя рослин. Як замінник цукру, він має приблизно 27 кілокалорій на чайну ложку (цукор має 20) і на 60% такий же солодкий, як сахароза. Він не харчується бактеріями, які утворюють бляшки і викликають зубні порожнини. [потрібне цитування] Як харчова добавка гліцерин маркується як E номер E422. Його додають в глазур (глазур), щоб запобігти занадто жорсткому схоплюванню.
Гліцерин застосовується в медичних, фармацевтичних препаратах і препаратах особистої гігієни, часто як засіб, що поліпшує гладкість, забезпечує мастило, і як зволожувач. Іхтіоз і ксероз були полегшені місцевим застосуванням гліцерину. Він міститься в імунотерапії алергенів, сиропах від кашлю, еліксирах і відхаркувальних препаратах, зубній пасті, ополіскувачах для рота, засобах по догляду за шкірою, кремі для гоління, засобах по догляду за волоссям, милі та особистих мастилах на водній основі (рис.\(\PageIndex{10}\)). У твердих лікарських формах, таких як таблетки, гліцерин використовується як засіб, що утримує таблетки.
Феноли
Сполуки, в яких група OH прикріплена безпосередньо до ароматичного кільця, позначаються AroH і називаються фенолами. Феноли відрізняються від спиртів тим, що вони слабокислі у воді. Вони реагують з водним гідроксидом натрію (NaOH) з утворенням солей.
ArOH(aq)+NaOH(aq)→ArONa(aq)+H2O
Батьківське з'єднання, C 6 H 5 OH, саме по собі називається фенолом. (Стара назва, що підкреслює її легку кислотність, була карболова кислота.) Фенол - біле кристалічне з'єднання, яке має характерний («лікарняний запах») запах.

До вашого здоров'я: феноли і ми
Феноли широко використовуються як антисептики (речовини, що вбивають мікроорганізми на живій тканині) і як дезінфікуючі засоби (речовини, призначені для знищення мікроорганізмів на неживих предметах, таких як меблі або підлога). Першим широко застосовуваним антисептиком став фенол. Джозеф Лістер використовував його для антисептичної хірургії в 1867 році. Однак фенол токсичний для людини і може викликати сильні опіки при нанесенні на шкіру. У крові це системна отрута - тобто та, яка переноситься і вражає всі частини тіла. Його серйозні побічні ефекти призвели до пошуку більш безпечних антисептиків, ряд з яких був знайдений.
Одним з більш безпечних фенольних антисептиків є 4-гексілрезорцин (4-гексил-1,3-дигідроксибензол; резорцин - загальна назва 1,3-дигідроксибензолу, а 4-гексілрезорцин має гексильну групу на четвертому атомі вуглецю резорцинового кільця). Він набагато потужніший за фенол як бактерицид і має менше небажаних побічних ефектів. Дійсно, він досить безпечний для використання в якості активного інгредієнта в деяких полосканнях для ротової порожнини та пастилок для горла.
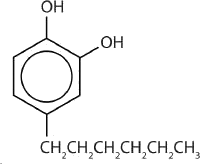
Окрім того, що діє як антисептик, фенол також є корисним попередником у багатьох хімічних синтезах для виробництва фармацевтичних препаратів, харчових консервантів, полімерів, смол та клеїв. Феноли також присутні в ряді біологічних систем та натуральних продуктів, таких як нейромедіатори, ароматизатори та вітаміни, щоб назвати декілька.
знизу: евгенал; 2,4-дихлорфеноксіоцтова кислота; пропофол
Ефіри
Ефіри - це сполуки, які містять функціональну групу —O—. Ефіри не мають призначеного суфікса, як інші типи молекул, які ми назвали досі. У системі IUPAC атом кисню і менша вуглецева гілка називаються алкоксизамінником, а решта молекули - базовим ланцюгом, як у алканів. Як показано в наступній сполуці, червоні символи представляють меншу алкільну групу та атом кисню, який буде названий «метокси». Більша вуглецева гілка буде етан, що робить молекулу метоксиетану. Багато ефірів, як показано нижче, називаються загальними іменами замість імен системи IUPAC. Для загальних назв дві гілки, з'єднані з атомом кисню, називаються окремо і за ними слідують «ефір».
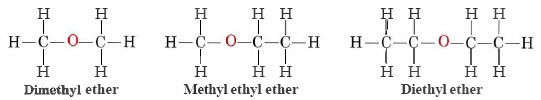
У загальній формулі для ефірів R— O —R вуглеводневі групи (R) можуть бути однаковими або різними.
Молекули ефіру не мають атома водню на атомі кисню (тобто немає групи OH). Тому між молекулами ефіру немає міжмолекулярного водневого зв'язку, і тому ефіри мають досить низькі температури кипіння для даної молярної маси. Дійсно, ефіри мають температури кипіння приблизно такі ж, як у алканів порівнянної молярної маси і набагато нижче, ніж у відповідних спиртів (табл.9.5.3).
| Конденсована структурна формула | Ім'я | Молярна маса | Температура кипіння (° C) | Міжмолекулярний водневий зв'язок у чистій рідині? |
|---|---|---|---|---|
| СН 3 СН 2 СН 3 | пропан | 44 | —42 | ні |
| СН 3 І 3 | диметиловий ефір | 46 | —25 | ні |
| СН 3 СН 2 ОН | етиловий спирт | 46 | 78 | так |
| СН 3 СН 2 СН 2 СН 2 СН 3 | пентан | 72 | 36 | ні |
| СН 3 СН 2 І 2 СН 3 | діетиловий ефір | 74 | 35 | ні |
| СН 3 СН 2 СН 2 СН 2 ОН | бутиловий спирт | 74 | 117 | так |
Однак молекули ефіру мають атом кисню і беруть участь у зв'язку водню з молекулами води. Отже, ефір має приблизно таку ж розчинність у воді, як і ізомерний з ним спирт. Наприклад, диметиловий ефір і етанол (обидва мають молекулярну формулу C 2 H 6 O) повністю розчинні у воді, тоді як діетиловий ефір і 1-бутанол (обидва C 4 H 10 O) ледь розчинні у воді (8 г/100 мл води).
Діетиловий ефір, найбільш широко використовувана сполука цього класу, являє собою безбарвну летючу рідину, яка є легкозаймистою. Вперше він був використаний в 1846 році як знеболюючий засіб, але кращі анестетики зараз багато в чому зайняли його місце. Діетиловий ефір та інші ефіри в даний час використовуються в основному як розчинники для ясен, жирів, восків та смол. Третинний -бутилметиловий ефір, C 4 H 9 OCH 3 (скорочено MTBE - курсивом частини назв не враховуються при ранжируванні груп в алфавітному порядку - так бутил стоїть перед метилом у загальній назві), використовується як добавка для бензину. MTBE належить до групи хімічних речовин, відомих як оксигенати завдяки їх здатності збільшувати вміст кисню в бензині.
Загальний анестетик діє на мозок, щоб виробляти несвідомість і загальну нечутливість до почуття або болю. Діетиловий ефір (CH 3 CH 2 OCH 2 CH 3) був першим загальним анестетиком, який був використаний.
Діетиловий ефір відносно безпечний, оскільки існує досить широкий розрив між дозою, яка виробляє ефективний рівень анестезії, і смертельною дозою. Однак, оскільки він є легкозаймистим і має додатковий недолік, викликаючи нудоту, його замінили новішими інгаляційними анестетиками, включаючи фторсодержащие сполуки галотан, енфлуран та ізофлуран. На жаль, безпека цих складів для персоналу операційних була поставлена під сумнів. Наприклад, жінки-працівники операційної залу, які піддаються впливу галотану, страждають більш високим рівнем викиднів, ніж жінки в загальному населенні.
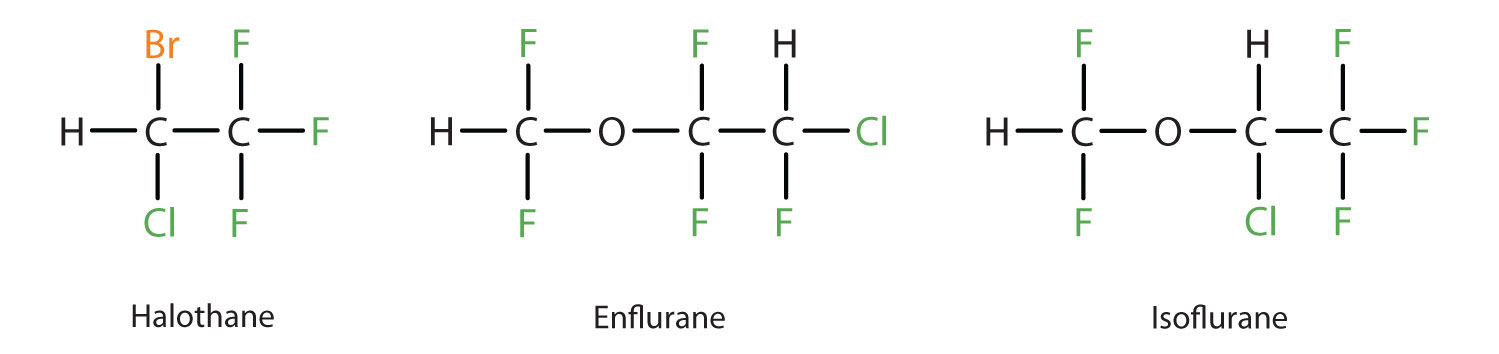
Список важливих ефірів і їх застосування наведено в табл.9.5.4
 |
Оксид етилену | Теж найпростіший епоксид. Більшість етиленоксиду використовується для синтезу етиленгліколів (антифризу), включаючи діетиленгліколь та триетиленгліколь, що становить до 75% світового споживання. |
|---|---|---|
| Диметиловий ефір | Аерозольний спрей пропеллент. Потенційне відновлюване альтернативне паливо для дизельних двигунів з цетановим числом 56—57. | |
| Діетиловий ефір | Звичайний низькокиплячий розчинник (b.p. 34,6° C) і ранній анестетик. Використовується як пускова рідина для дизельних двигунів. Також використовується в якості холодоагенту і при виготовленні бездимного пороху, поряд із застосуванням в парфумерії. | |
 |
Диметоксиетан (DME) | Водорозчинник, що змішується, часто зустрічається в літієвих батареях (b.p. 85° C): |
| Діоксан | Циклічний ефір і висококиплячий розчинник (б.п. 101,1 °С). |
Визначте такі сполуки, як спирт, фенол або ефір.
а.
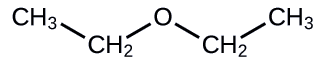

Рішення
а. сполука має загальну формулу R— O —R, тому вона є ефіром. б. сполука має дві гідроксильні (—ОН) групи, тому вона є спиртофолом.
Визначте такі сполуки, як спирт, фенол або ефір.
а.

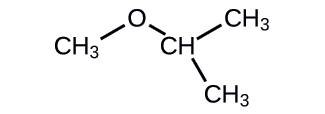
- Відповідь
-
a. спирт б. ефір
Резюме
- Група —ОН є функціональною групою алкоголю. Різні спирти мають широкий спектр застосування в медичній галузі, а також у транспортній, харчовій, косметичній промисловості.
- Назва спирту походить від вуглеводню, з якого він був отриманий.
- —R—O—R— група є функціональною групою ефіру. Діетиловий ефір та інші ефіри в даний час використовуються в основному як розчинники для ясен, жирів, восків та смол. Оксид етилену, зокрема, використовується у виробництві етиленгліколю (антифризу).
- Феноли - це сполуки, в яких група OH прикріплена безпосередньо до ароматичного кільця. Багато феноли використовуються в якості антисептиків.
Дописувачі та атрибуція
- Template:ContribOpenStax
- TextMap: The Basics of GOB Chemistry (Ball et al.)
- Template:ContribAgnewM
- Wikipedia