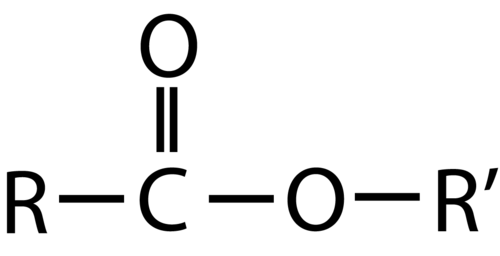9.7: Карбонові кислоти та ефіри
- Page ID
- 20695
- Опишіть будову і властивості карбонових кислот і складних ефірів.
- Назвіть поширені карбонові кислоти і складні ефіри.
Запах оцту обумовлений наявністю в оцті оцтової кислоти, карбонової кислоти. Запах стиглих бананів і багатьох інших фруктів обумовлений наявністю складних ефірів, з'єднань, які можна приготувати реакцією карбонової кислоти зі спиртом. Оскільки складні ефіри не мають водневих зв'язків між молекулами, вони мають менший тиск пари, ніж спирти та карбонові кислоти, з яких вони походять.
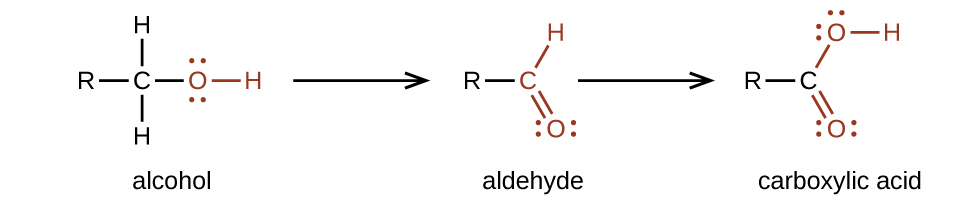
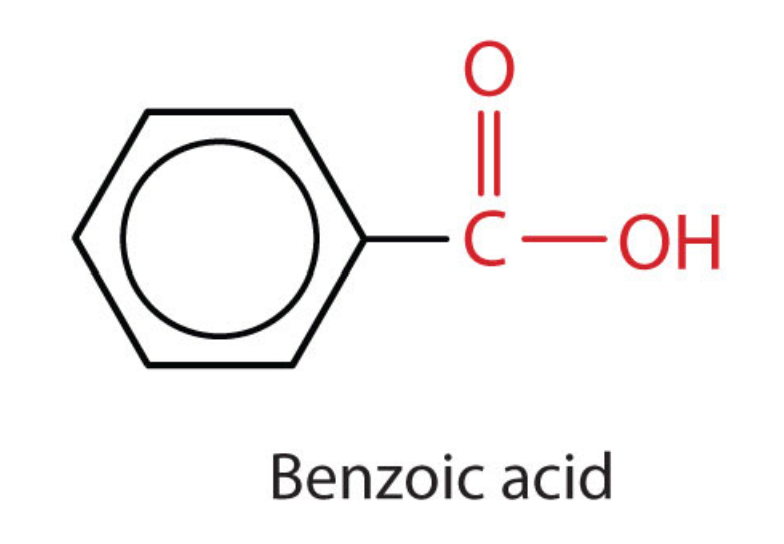
Як карбонові кислоти, так і складні ефіри містять карбонільну групу з другим атомом кисню, зв'язаним з атомом вуглецю в карбонільній групі одним зв'язком. У карбонової кислоти другий атом кисню також зв'язується з атомом водню. У ефірі другий атом кисню зв'язується з іншим атомом вуглецю. Назви карбонових кислот і ефірів включають префікси, які позначають довжини вуглецевих ланцюгів в молекулах і виведені за такими правилами номенклатури, подібними до тих, що стосуються неорганічних кислот і солей (див. Ці приклади):
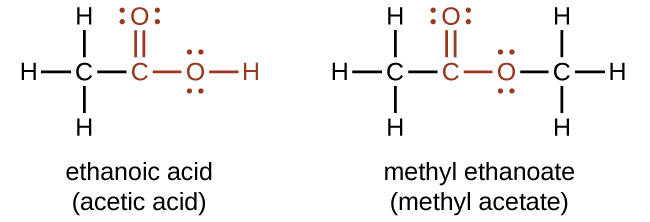
Функціональні групи для кислоти та для ефіру показані червоним кольором у цих формулах.
Карбонові кислоти
Карбонові кислоти зустрічаються широко в природі, часто поєднуються зі спиртами або іншими функціональними групами, як у жирах, маслах, восках. Вони є складовими багатьох продуктів харчування, медикаментів, побутових товарів (рис.\(\PageIndex{1}\)). Не дивно, що багато хто з них найбільш відомі під загальними іменами на основі латинських і грецьких слів, які описують їх джерело.

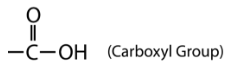
Карбоксильна група містить карбонільну групу, причому атом вуглецю також пов'язаний з гідроксильною\(\left( \ce{-OH} \right)\) групою.\(\ce{C=O}\) Карбонова кислота - це органічна сполука, яка містить карбоксильну функціональну групу. Загальну формулу карбонової кислоти можна скорочувати як\(\ce{R-COOH}\). Атом вуглецю карбоксильної групи може бути приєднаний до атома водню або до вуглецевого ланцюга. Найменування карбонової кислоти виглядає наступним чином: Назвіть батьківську сполуку, знайшовши найдовшу безперервну ланцюг, яка містить карбоксильну групу. Змініть -е в кінці назви алкану на -оєву кислоту.
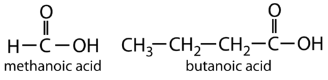
Карбонові кислоти - це слабкі кислоти, тобто вони не на 100% іонізовані у воді. Як правило, лише близько 1% молекул карбонової кислоти, розчиненої у воді, іонізуються в будь-який момент часу. Решта молекули відділяються в розчині.
Готуємо карбонові кислоти шляхом окислення альдегідів або спиртів, функціональна група яких —ОН розташована на атомі вуглецю в кінці ланцюга атомів вуглецю в спирті:
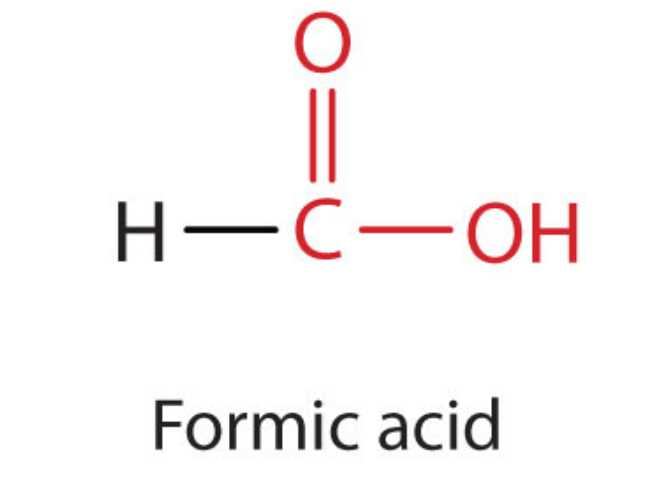
Найпростіша карбонова кислота, мурашина кислота (HCOOH, метанова кислота), була вперше отримана шляхом дистиляції мурах (лат. formica, що означає «мураха»). Укуси деяких мурах впорскують мурашину кислоту, а укуси ос і бджіл містять мурашину кислоту (а також інші отруйні матеріали).
Наступний вищий гомолог - оцтова кислота (СН 3 СООН, етановая кислота), яка виготовляється шляхом бродіння сидру і меду в присутності кисню. Це бродіння виробляє оцет, розчин, що містить 4% -10% оцтової кислоти, плюс ряд інших сполук, які додають його аромат. Оцтова кислота - це, мабуть, найбільш звична слабка кислота, яка використовується в навчальних і промислових хімічних лабораторіях.
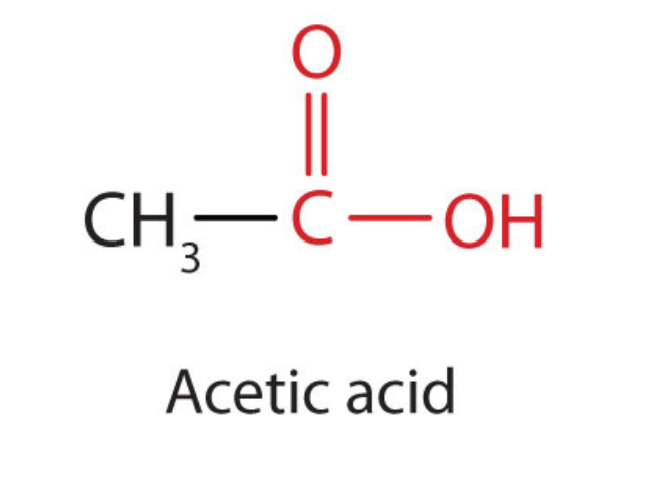
Чиста оцтова кислота твердне при 16,6° C, лише трохи нижче нормальної кімнатної температури. У погано опалюваних лабораторіях кінця 19 - початку 20 століть на півночі Північної Америки і Європи оцтова кислота часто «застигала» на полиці зберігання. З цієї причини чиста оцтова кислота (іноді її називають концентрованою оцтовою кислотою) стала називатися льодовиковою оцтовою кислотою - назва, яка збереглася до наших днів.
Третій гомолог, пропіонова кислота (СН 3 СН 2 СООН, пропіонова кислота), рідко зустрічається в побуті. Четвертий гомолог, масляна кислота (CH 3 CH 2 CH 2 COOH), є одним з найбільш неприємних речовин, які можна собі уявити. Він міститься в прогірклому маслі і є одним з інгредієнтів запаху тіла. Визнаючи надзвичайно малі кількості цього та інших хімічних речовин, бладхаунди здатні відстежувати втікачів.
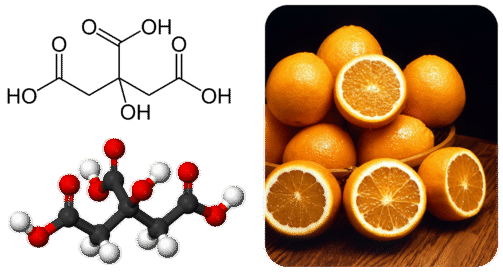
Багато карбонових кислот зустрічаються природним чином у рослин і тварин. Цитрусові, такі як апельсини і лимони, містять лимонну кислоту (рис.\(\PageIndex{4}\)). Етанову і лимонну кислоти часто додають в продукти, щоб надати їм терпкий смак.
Бензойна, пропанова і сорбінова кислоти використовуються в якості харчових консервантів через їх здатність вбивати мікроорганізми, які можуть призвести до псування. Метанова і етанова кислоти широко використовуються в промисловості як відправні точки для виготовлення фарб, клеїв і покриттів.
Складні ефіри: Солодкий запах ROCOOR'
Ефір - це органічна сполука, яка є похідною карбонової кислоти, в якій атом водню гідроксильної групи був замінений алкільною групою. Структура являє собою продукт карбонової кислоти (\(\ce{R}\)порція) і спирту (\(\ce{R'}\)порція). Загальна формула для ефіру наведена нижче.
\(\ce{R}\)Група може бути як водневої, так і вуглецевої ланцюгом. \(\ce{R'}\)Група повинна бути вуглецевим ланцюгом, оскільки атом водню зробить молекулу карбоновою кислотою.
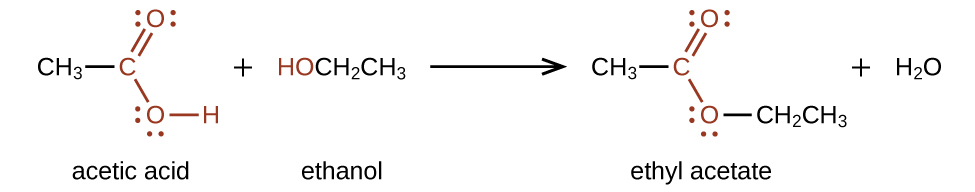
Складні ефіри виробляються в результаті реакції кислот зі спиртами. Наприклад, ефір етилацетату СН 3 СО 2 СН 2 СН 3 утворюється при реакції оцтової кислоти з етанолом:
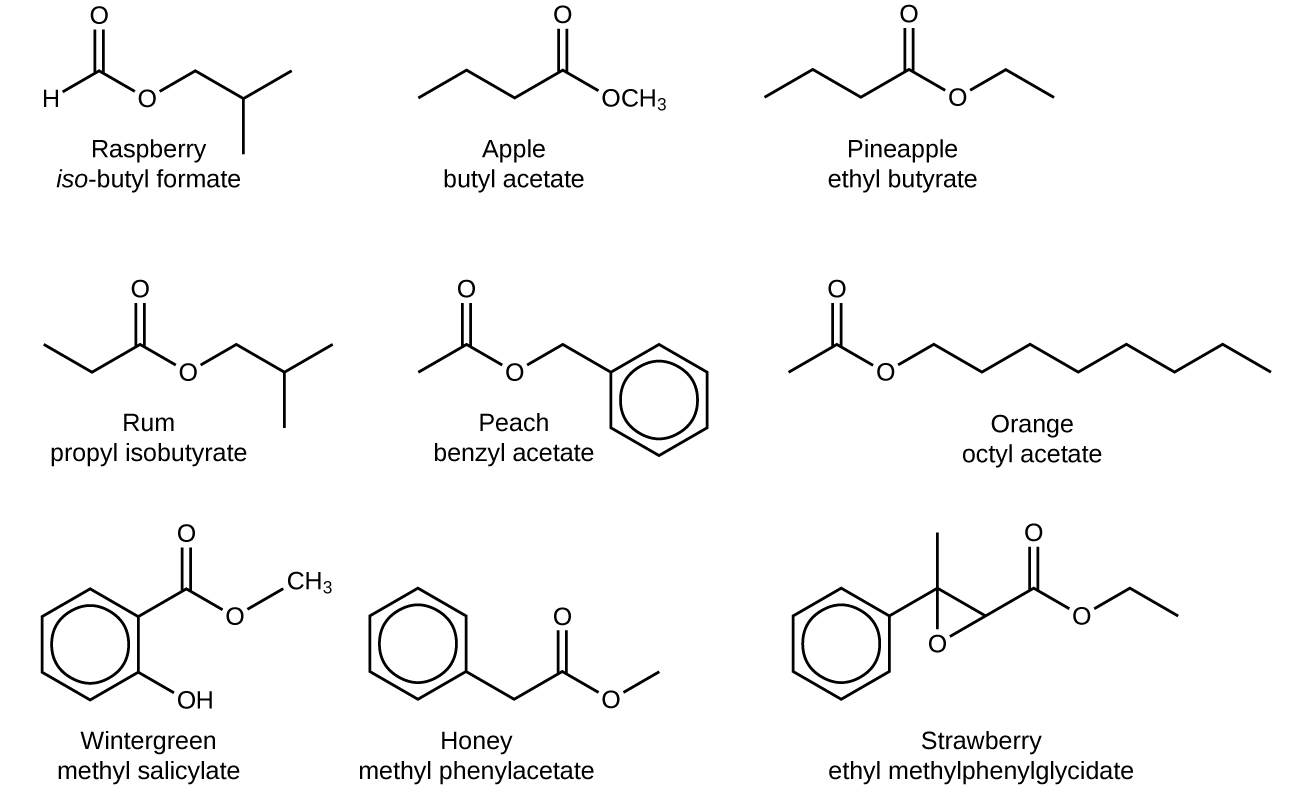
Ефіри - це дуже цікаві сполуки, почасти тому, що багато хто має дуже приємні запахи та аромати. (Пам'ятайте, ніколи нічого не скуштуйте в хімічній лабораторії!) Багато ефіри відбуваються природним шляхом і сприяють запаху квітів і смаку фруктів. Інші складні ефіри синтезуються промислово і додаються до харчових продуктів для поліпшення їх запаху або смаку; цілком ймовірно, що якщо ви їсте продукт, інгредієнти якого включають штучні ароматизатори, ці ароматизатори - це складні ефіри. Ось деякі ефіри та їх використання, завдяки їх запахам, ароматам або обом:
| Естер | Смаки/Запахи | Естер | Смаки/Запахи |
|---|---|---|---|
| алліл гексаноат | ананас | ізобутилформіат | малиновий |
| бензил ацетат | груша | ізобутилацетат | груша |
| бутилбутаноат | ананас | метилфенілацетат | мед |
| етил бутаноат | банан | ноніл каприлат | помаранчевий |
| етил гексаноат | ананас | пентилацетат | яблуко |
| етиловий гептаноат | абрикос | пропілетаноат | груша |
| етил пентаноат | яблуко | пропіл ізобутират | рому |
Серед найважливіших природних ефірів - жири (такі як сало, жир та масло) та олії (такі як лляна, бавовняна та оливкова олії), які є ефірами гліцерину тригідроксильного спирту, C 3 H 5 (OH) 3, з великими карбоновими кислотами, такими як пальмітинова кислота, CH 3 (СН 2) 14 СО 2 Н, стеаринова кислота, СН 3 (СН 2) 16 СО 2 Н та олеїнова кислота,\(\mathrm{CH_3(CH_2)_7CH=CH(CH_2)_7CO_2H}\). Олеїнова кислота є ненасиченою кислотою, вона містить\(\mathrm{C=C}\) подвійний зв'язок. Пальмітинова і стеаринова кислоти - це насичені кислоти, які не містять подвійних або потрійних зв'язків.
Жири і рослинні масла - це ефіри довголанцюгових жирних кислот і гліцерину. Ефіри фосфорної кислоти мають першорядне значення для життя.
Ефіри є звичайними розчинниками. Етилацетат використовується для вилучення органічних розчинів з водних розчинів - наприклад, для видалення кофеїну з кави. Він також використовується для зняття лаку з нігтів і фарби. Селітрат целюлози розчиняють в етилацетаті і бутилацетаті з утворенням Розчинник випаровується в міру «висихання» лаку, залишаючи на поверхні тонку плівку. Висококиплячі ефіри використовуються як пом'якшувачі (пластифікатори) для крихких пластмас.
Резюме
- Карбонова кислота - це органічна сполука, яка містить карбоксильну функціональну групу.
- Загальну формулу карбонової кислоти можна скорочувати як\(\ce{R-COOH}\).
- Багато карбонових кислот використовуються в харчовій промисловості та напоях для ароматизації та/або як консерванти.
- Ефір має групу АБО, прикріплену до атома вуглецю карбонільної групи.
- Жири і рослинні масла - це ефіри довголанцюгових жирних кислот і гліцерину.
- Ефіри зустрічаються широко в природі і, як правило, мають приємні запахи і часто відповідають за характерні аромати фруктів і квітів.
Автори та атрибуція
- (click for details)
Callstack: at (Хімія/Вступний,_концептуальний_та_ЗОБ_Хімія/Хімія_для_зміни_часів_(Hill_і_McCreary)/09:_Органічна_хімія/9.08:_Карбонові_кислоти_та_ефіри), /content/body/div[4]/ul/li[1]/span, line 1, column 1 - Лібретекст: Основи хімії GOB (Ball et al.)
- TextMap: Початок хімії (М'яч та ін.)
- OpenStax