9.1: Аліфатичні вуглеводні
- Page ID
- 20688
- Визначте та ідентифікуйте алкани, алкени, алкіни та циклічні вуглеводні.
- Перерахуйте деякі властивості вуглеводнів.
- Визначте та назвіть прості (прямоланцюгові) алкани, задані формули і запишіть формули для алканів з прямим ланцюгом, задавши їх назви.
- Визначте структурні та геометричні ізомери.
- Напишіть конденсовані структурні формули та намалюйте формули лінійного кута, враховуючи повні структурні формули для алканів, алкенів, алкінів та циклічних вуглеводнів.
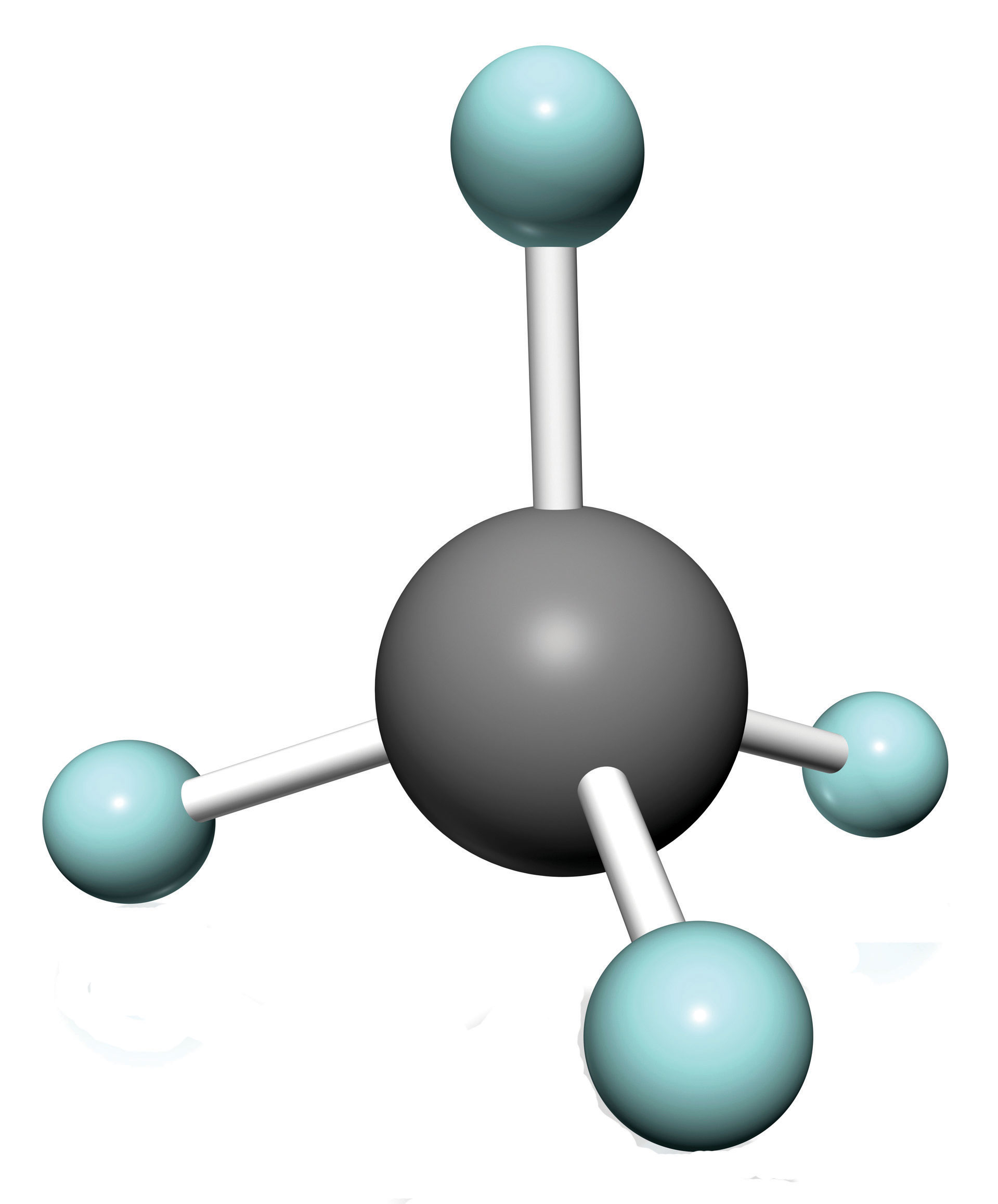
Найпростіші органічні сполуки - це ті, що складаються лише з двох елементів: вуглецю та водню. Ці сполуки називаються вуглеводнями. Самі вуглеводні поділяються на два типи: аліфатичні вуглеводні і ароматичні вуглеводні. Аліфатичні вуглеводні - це вуглеводні на основі ланцюгів атомів С. Існує три види аліфатичних вуглеводнів. Алкани - це аліфатичні вуглеводні з тільки поодинокими ковалентними зв'язками. Алкени - це вуглеводні, які містять принаймні один подвійний зв'язок С—С, а лікіни - вуглеводні, які містять потрійний зв'язок C-C. Іноді ми знаходимо аліфатичний вуглеводень з кільцем атомів С; ці вуглеводні називаються циклоалканами (або циклоалкенами або циклоалкінами). Оскільки алкани мають максимальну кількість атомів Н, можливих за правилами ковалентних зв'язків, алкани також називають насиченими вуглеводнями.
Слово насичений має таке ж значення для вуглеводнів, як і для харчових жирів і масел: молекула не має подвійних зв'язків вуглецю з вуглецем (C = C).
Алкани
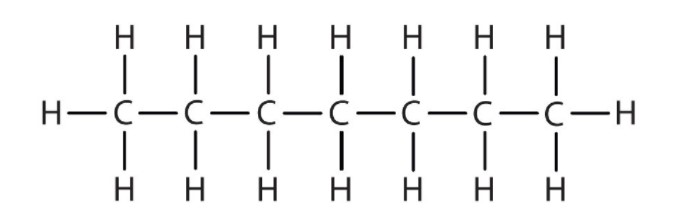
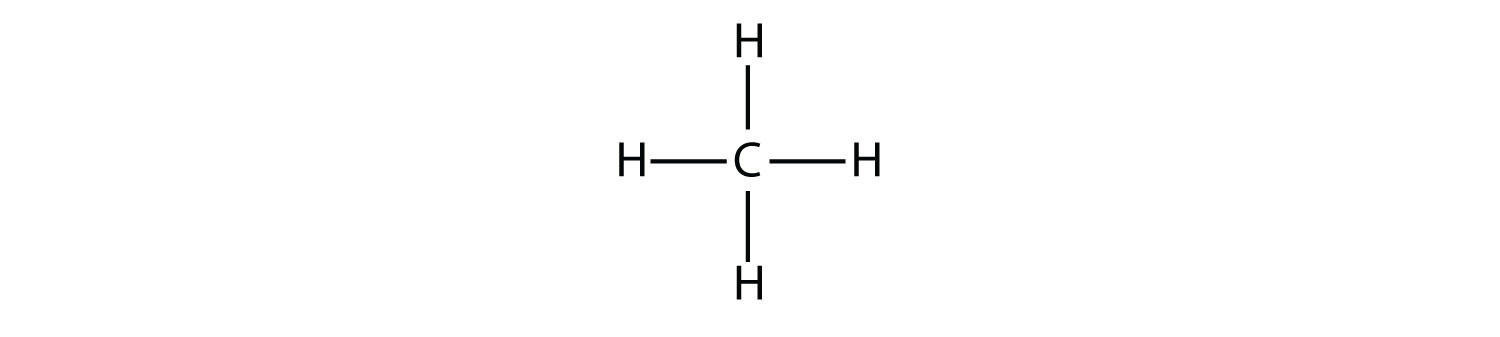
Найпростіші алкани мають свої атоми С, з'єднані прямим ланцюгом; вони називаються нормальними алканами. Названі вони відповідно до кількості атомів С в ланцюжку. Найменший алкан - метан:
Діаграми, що представляють алкани, називаються структурними формулами, оскільки вони показують структуру молекули. У міру збільшення молекул структурні формули стають все більш складними. Один із способів цього полягає у використанні конденсованої структурної формули, яка перераховує формулу кожного атома С в кістці молекули.
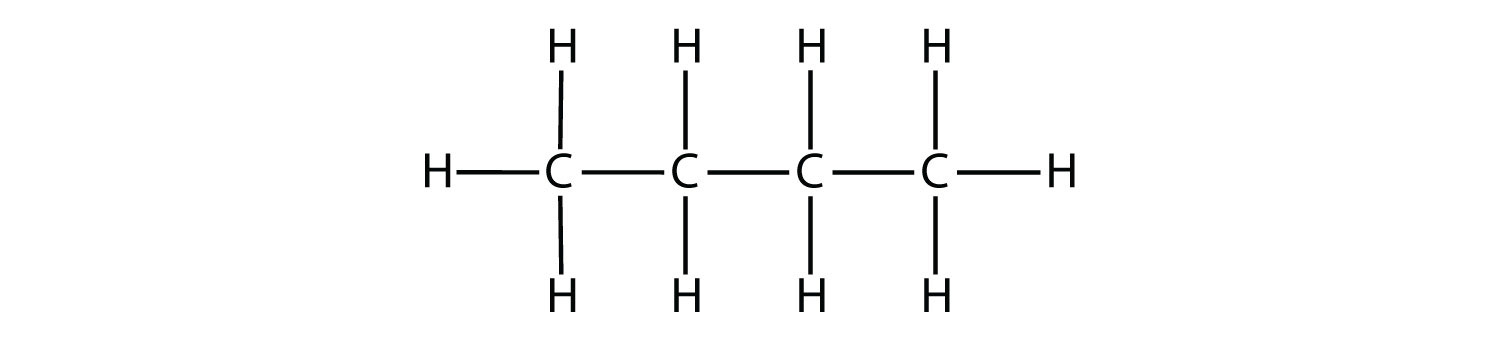
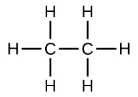
Конденсовані формули показують атоми водню поруч із атомами вуглецю, до яких вони прикріплені, як показано для бутану:

Кінцева конденсована формула - це формула лінійного кута (або креслення лінії), в якій атоми вуглецю маються на увазі в кутах і кінцях ліній, і кожен атом вуглецю, як розуміється, приєднаний до достатньої кількості атомів водню, щоб дати кожному атому вуглецю чотири зв'язки. Наприклад, ми можемо представити пентан (СН 3 СН 2 СН 2 СН 2 СН 3) і ізопентан [(СН 3) 2 ЧСН 2 СН 3] наступним чином:

| Структурна формула | 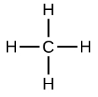 |
 |
|
|---|---|---|---|
| Модель м'яча та палиці |  |
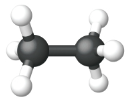 |
|
| Модель заповнення простору | 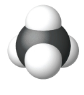 |
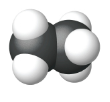 |
|
| Ім'я | Метан | Етан | пропан |
| Конденсована структурна формула | СН 4 | СН 3 СН 3 | СН 3 СН 2 СН 3 |
| Молекулярна формула | СН 4 | С 2 Ч 6 | С 3 Ч 8 |
| Малювання кута лінії |  |
 |
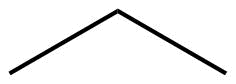 |
Надайте молекулярну формулу, повну структурну формулу, конденсовану структурну формулу та формулу кута прямої ланцюга алкану з 8 атомами вуглецю.
Рішення
| структурна формула | Пояснення | Відповідь |
|---|---|---|
| Молекулярна формула |
Загальна формула алкана - C n H 2 n + 2 Для алкану з 8 атомами вуглецю, C 8 H (2 × 8) + 2 = C 8 H 18. |
З 8 Ч 18. |
| Повна структурна формула | Вісім вуглеців спочатку пов'язані між собою, а всі інші зв'язки з воднем для виконання правила октету. | С 1 -С 2 -С 3 -С 4 -С 5 -С 6 -С 7 - С 8 |
| Конденсована структурна формула |
Кінцеві атоми вуглецю (C 1 і C 8) пов'язані з трьома атомами водню кожен, а шість середніх атомів вуглецю пов'язані з двома атомами водню кожен. Шість середніх атомів вуглецю пов'язані з двома атомами водню, тому структурну формулу можна спростити далі. |
СН 3 СН 2 СН 2 СН 2 СН 2 СН 2 СН 2 СН 3 СН 3 (СН 2) 6 СН 3 |
| Малювання кута лінії | Вісім атомів вуглецю маються на увазі по кутах і кінцях ліній, і кожен атом вуглецю, як розуміється, приєднаний до достатньої кількості атомів водню, щоб дати кожному атому вуглецю чотири зв'язки. |
Гомологічна серія
Метан (CH 4), етан (C 2 H 6) та пропан (C 3 H 8) є початком серії сполук, в яких будь-які два члени в послідовності відрізняються одним атомом вуглецю та двома атомами водню, а саме, одиницею СН 2. Перші 10 учасників цієї серії наведені в табл\(\PageIndex{1}\).
| Молекулярна формула | Конденсована структурна формула | Ім'я |
|---|---|---|
| СН 4 | СН 4 | метан |
| С 2 Ч 6 | СН 3 СН 3 | етану |
| С 3 Ч 8 | СН 3 СН 2 СН 3 | пропан |
| З 4 Ч 10 | СН 3 СН 2 СН 2 СН 3 | бутан |
| З 5 Ч 12 | СН 3 СН 2 СН 2 СН 2 СН 3 | пентан |
| С 6 Ч 14 | СН 3 (СН 2) 4 СН 3 | гексан |
| С 7 Ч 16 | СН 3 (СН 2) 5 СН 3 | гептан |
| З 8 Ч 18 | СН 3 (СН 2) 6 СН 3 | октан |
| З 9 Ч 20 | СН 3 (СН 2) 7 СН 3 | нонан |
| С 10 Ч 22 | СН 3 (СН 2) 8 СН 3 | декан |
Дужки в конденсованих структурних формулах вказують на те, що укладена угруповання атомів прикріплена до сусіднього атома вуглецю.
Розглянемо серії на рис\(\PageIndex{2}\). Послідовність починається з С 3 Н 8, і на кожному кроці додається блок СН 2, рухаючись вгору по ряду. Будь-яке сімейство сполук, в яких сусідні члени відрізняються один від одного певним коефіцієнтом (тут група СН 2), називається гомологічним рядом. Учасники такого ряду, званого гомологами, мають властивості, які змінюються в регулярному і передбачуваному порядку. Принцип гомології дає організацію органічної хімії майже так само, як таблиця Менделєєва надає організацію неорганічної хімії. Замість дивного масиву окремих вуглецевих сполук ми можемо вивчити кілька членів гомологічного ряду і з них вивести деякі властивості інших сполук ряду.
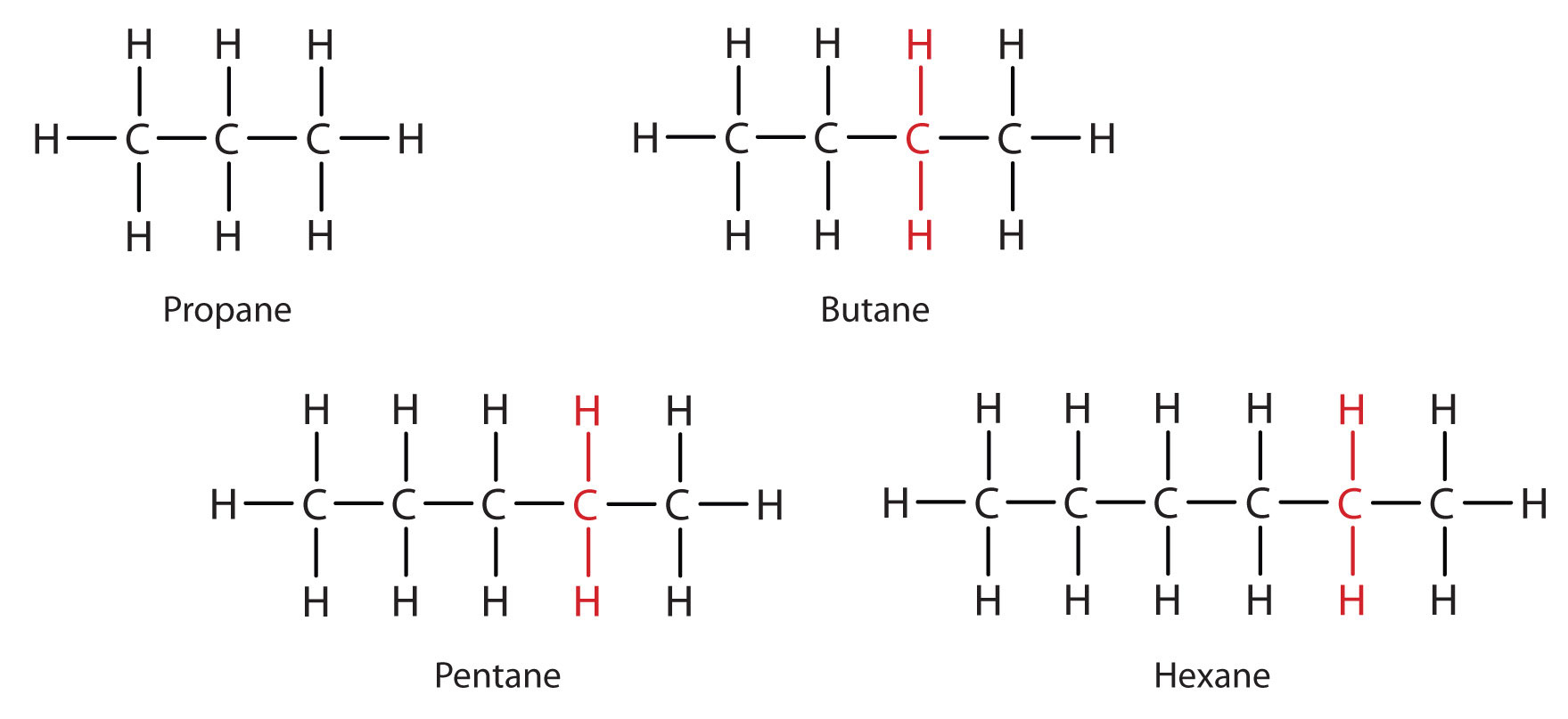
Принцип гомології дозволяє написати загальну формулу для алканів: C n H 2 n + 2. Використовуючи цю формулу, ми можемо написати молекулярну формулу для будь-якого алкану з заданою кількістю атомів вуглецю. Наприклад, алкан з вісьмома атомами вуглецю має молекулярну формулу C 8 H (2 × 8) + 2 = C 8 H 18.
Неймінг (номенклатура IUPAC)
Систематичний спосіб найменування вуглеводнів та інших органічних сполук був розроблений Міжнародним союзом чистої та прикладної хімії (IUPAC). Ці правила, що використовуються у всьому світі, відомі як система номенклатури IUPAC. Назва стовбура в таблиці\(\PageIndex{1}\) вказує на кількість атомів вуглецю в найдовшій безперервному ланцюжку (LCC). Атоми або групи, прикріплені до цього вуглецевого ланцюга, звані замісниками, потім називаються, їх положення позначаються цифрами.
| Стебло | Кількість атомів C |
|---|---|
| метамфетамфетам | 1 |
| ETH- | 2 |
| проп- | 3 |
| але- | 4 |
| pent- | 5 |
| шістнадцятковий | 6 |
| гепт- | 7 |
| жовт- | 8 |
| не- | 9 |
| груд- | 10 |
Безперервний (нерозгалужений) ланцюг атомів вуглецю часто називають прямим ланцюгом, хоча чотиригранне розташування навколо кожного вуглецю надає йому зигзагоподібну форму. Прямоланцюгові алкани іноді називають нормальними алканами, а їх назви дають префікс n -. Наприклад, бутан називається n -бутан. Ми не будемо використовувати цей префікс тут, оскільки він не є частиною системи, встановленої Міжнародним союзом чистої та прикладної хімії.
Як називається восьмивуглецевий алкан?
Рішення
Стебло, яке посилається на вісім атомів вуглецю, є октановим плюс суфікс -ан для алкану, тому відповідь - октан.
Вкажіть назву для наступних сполук:
a. сім вуглецевих алканів
б. шість вуглецевих алканів
- Відповідь
-
а. гептан
б. гексан
Ізомеризм-розгалужені ланцюгові алкани
Одним з цікавих аспектів органічної хімії є те, що вона тривимірна. Молекула може мати форму в просторі, яка може сприяти її властивостям. Молекули можуть відрізнятися за способом розташування атомів - одна і та ж комбінація атомів може бути зібрана не одним способом. Ці сполуки відомі як ізомери. Ізомери - це молекули з однаковими молекулярними формулами, але різним розташуванням атомів. Ми розглянемо деякі можливості ізомерів для алканів і алкенів.
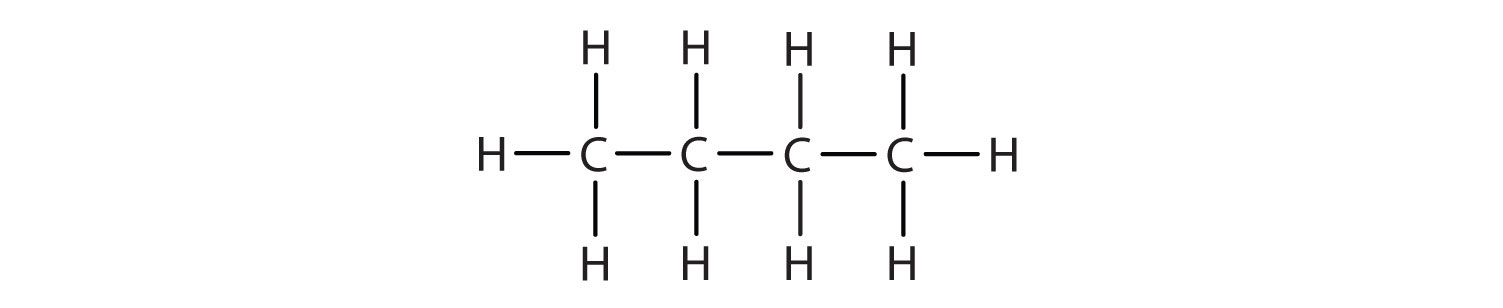
Ми можемо записати структуру бутану (C 4 H 10), нанизуючи чотири атоми вуглецю в ряд,
—С—С—С—
а потім додавання достатньої кількості атомів водню, щоб дати кожному атому вуглецю чотири зв'язки:
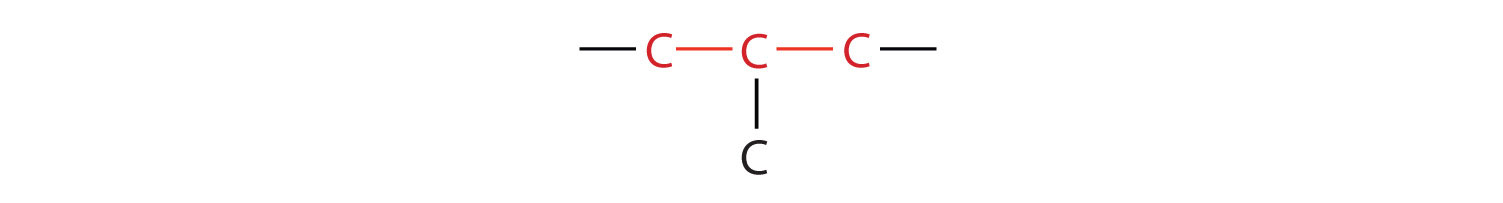
З'єднання бутан має таку структуру, але є й інший спосіб об'єднати 4 атоми вуглецю і 10 атомів водню разом. Помістіть 3 атоми вуглецю в ряд, а потім відгалужуйте четвертий від середнього атома вуглецю:
Тепер ми додаємо достатню кількість атомів водню, щоб дати кожному вуглецю чотири зв'язки.
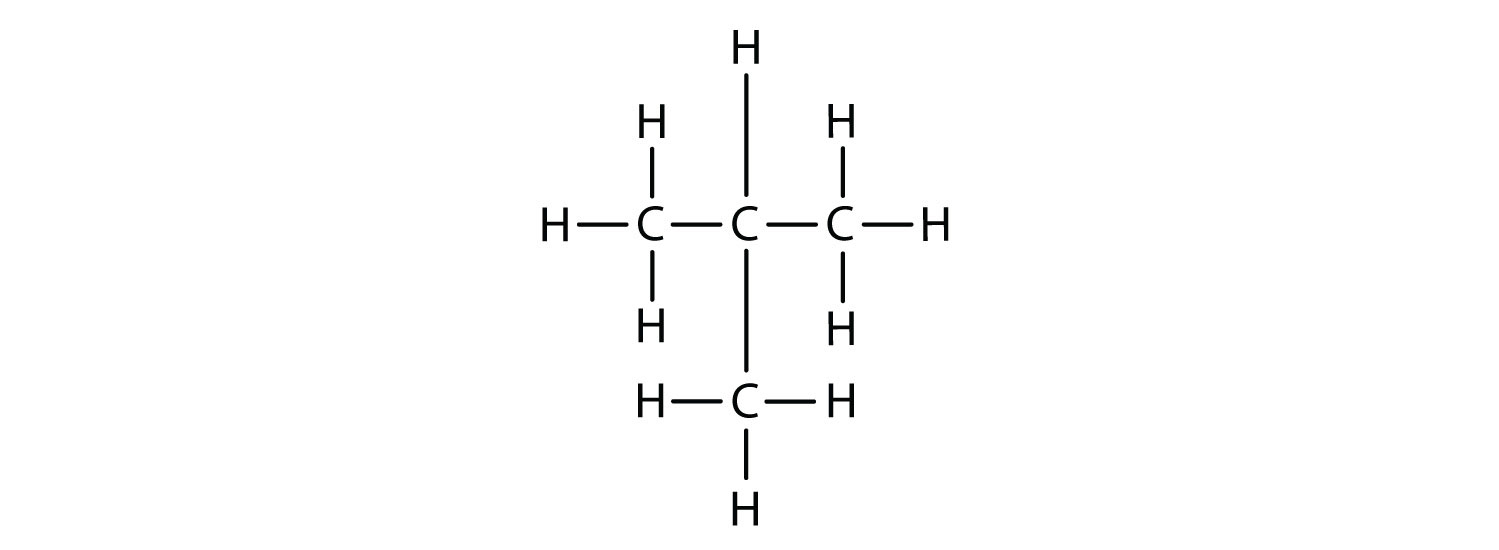
Існує вуглеводень, який відповідає цій структурі, а значить, два різних сполуки мають однакову молекулярну формулу: C 4 H 10. Ці дві сполуки мають різні властивості: наприклад, одна кипить при −0,5° C, інша при −11,7° C. Різні сполуки, що мають однакову молекулярну формулу, називаються ізомерами.
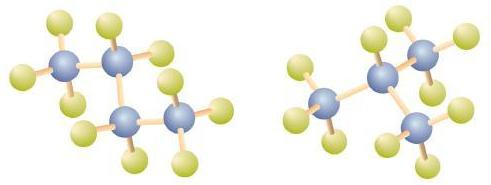
Зверніть увагу, що С 4 Н 10 зображений зігнутою ланцюгом на рис\(\PageIndex{4}\). Чотиривуглецевий ланцюг може бути зігнутий різними способами, оскільки групи можуть вільно обертатися навколо зв'язків C - C. Однак це обертання не змінює ідентичності з'єднання. Важливо розуміти, що згинання ланцюга не змінює ідентичності сполуки; всі наступні являють собою одну і ту ж сполуку, бутан:
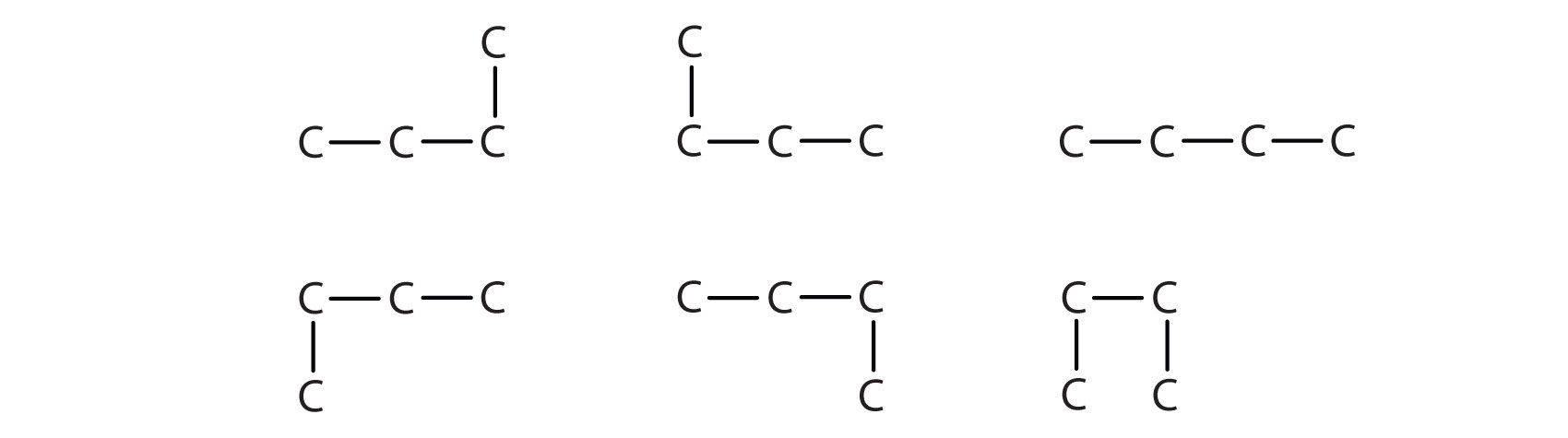
Структура ізобутану показує безперервний ланцюг лише з трьох атомів вуглецю, причому четвертий приєднаний як гілка від середнього атома вуглецю безперервного ланцюга, яка відрізняється від структур бутану (порівняйте дві структури на рис\(\PageIndex{4}\).
На відміну від C 4 H 10, сполуки метану (CH 4), етану (C 2 H 6) та пропану (C 3 H 8) не існують в ізомерних формах, оскільки існує лише один спосіб розташувати атоми в кожній формулі так, щоб кожен атом вуглецю мав чотири зв'язки.
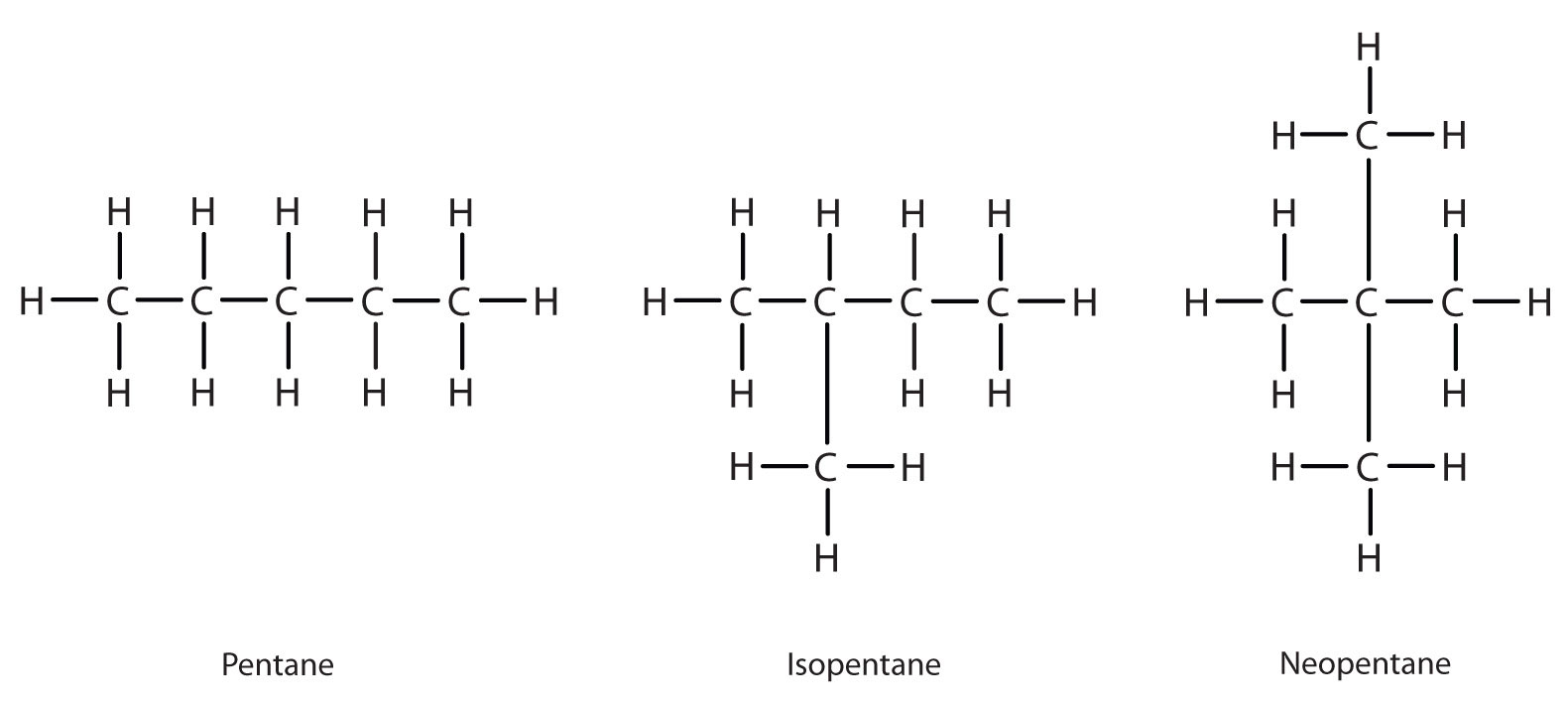
Далі за С 4 Н 10 в гомологічному ряду знаходиться пентан. Кожне з'єднання має однакову молекулярну формулу: C 5 H 12. З'єднання в крайньому лівому куті є пентаном, оскільки воно має всі п'ять атомів вуглецю в безперервному ланцюзі. З'єднання посередині - ізопентан; як і ізобутан, він має одну гілку CH 3 від другого атома вуглецю безперервного ланцюга. З'єднання в крайньому правому куті, виявлене після двох інших, отримало назву neopentane (від грецького neos, що означає «новий»). Хоча всі три мають однакову молекулярну формулу, вони мають різні властивості, включаючи температуру кипіння: пентан, 36,1° C; ізопентан, 27,7° C; і неопентан, 9,5° C.
Іменування розгалужених алканів
Ви вже вивчили основи номенклатури -назви перших 10 нормальних вуглеводнів. Тут ми додамо кілька кроків до процедури, щоб ви могли назвати розгалужені вуглеводні.
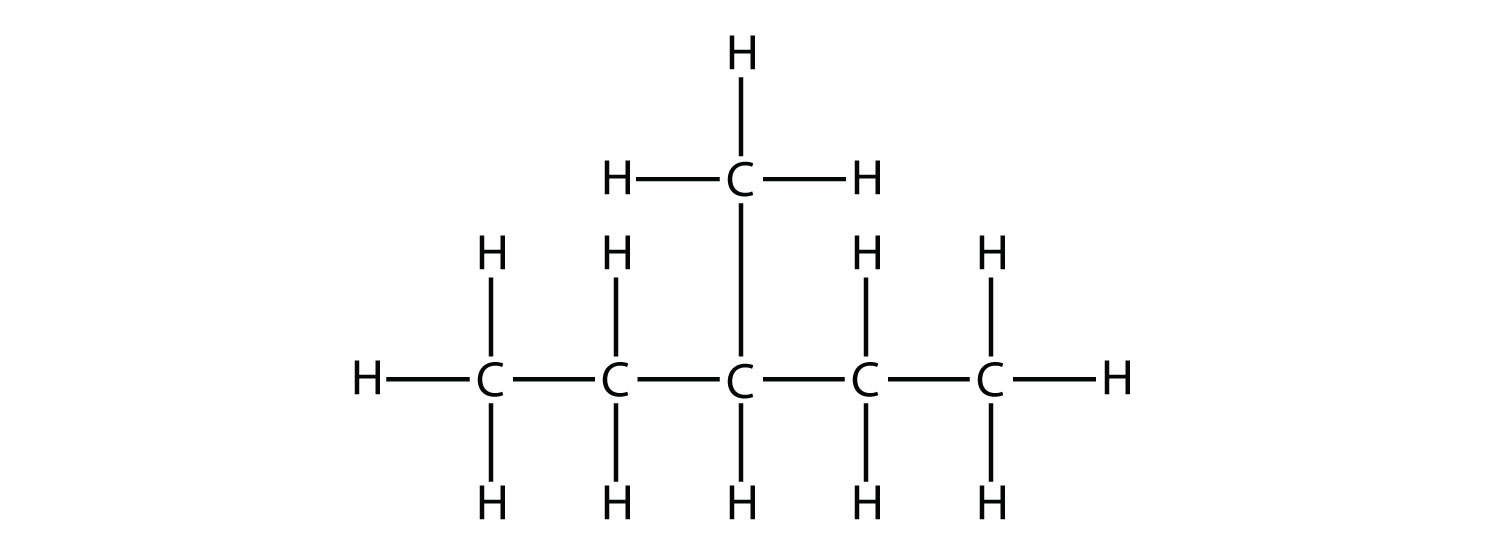
Спочатку, з огляду на будову алкана, ідентифікують найдовшу безперервну ланцюг атомів С. Зверніть увагу, що найдовша ланцюг може бути не проведена по прямій лінії. Найдовша ланцюг визначає батьківське найменування вуглеводню. Наприклад, в молекулі
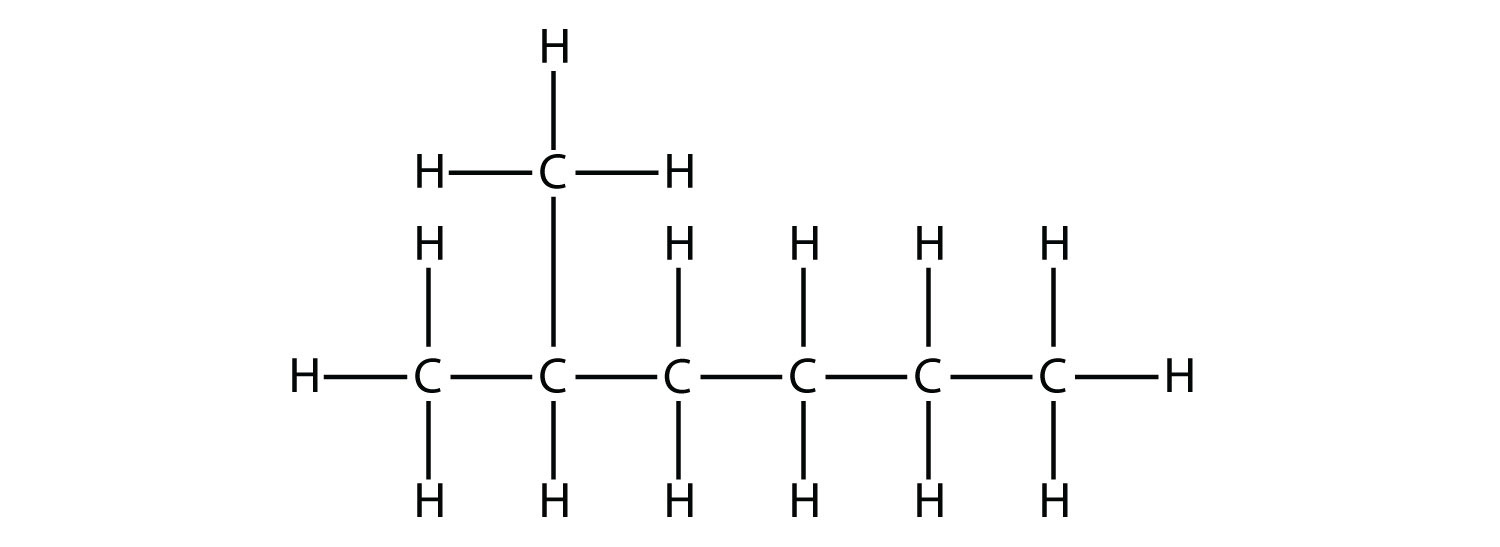
найдовша ланцюг вуглецю має шість атомів С. Тому він буде названий як гексан. Однак в молекулі
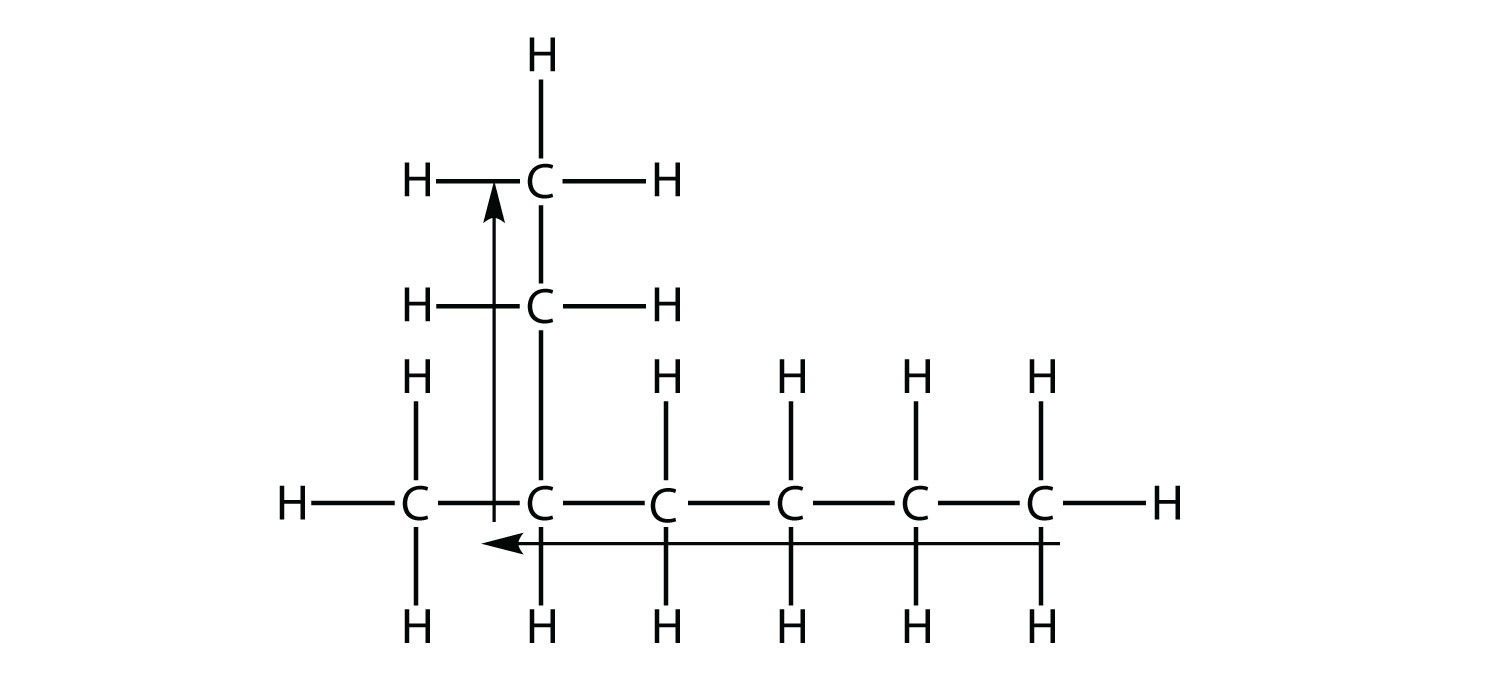
найдовша ланцюжок атомів С не шість, а сім, як показано на малюнку. Таким чином, ця молекула буде названа гептаном.
Наступним кроком є виявлення гілок, або замінників, на головному ланцюжку. Назви замісників, або алкільних груп, походять від назв материнських вуглеводнів; однак замість того, щоб мати закінчення - ane, назва замінника має закінчення - yl. Таблиця\(\PageIndex{3}\), перераховує імена замінників для п'яти найменших замінників.
| Формула замінника | Кількість атомів C | Найменування замінника |
|---|---|---|
| СН 3 | 1 | метил - |
| СН 3 СН 2 | 2 | етиловий - |
| СН 3 СН 2 СН 2 | 3 | пропіл - |
| СН 3 СН 2 СН 2 СН 2 | 4 | бутил - |
| СН 3 СН 2 СН 2 СН 2 СН 2 | 5 | пентиль - |
| і так далі | і так далі | і так далі |
При іменуванні розгалуженого вуглеводню назва замінника поєднується з батьківською назвою вуглеводню без пробілів. Однак є, ймовірно, ще один крок. Найдовша ланцюг вуглеводню повинна бути пронумерована, а числове положення замінника повинно бути включено для обліку можливих ізомерів. Як і у випадку з подвійними і потрійними зв'язками, основний ланцюг нумерується, щоб дати заміснику мінімально можливе число. Наприклад, в цьому алкане
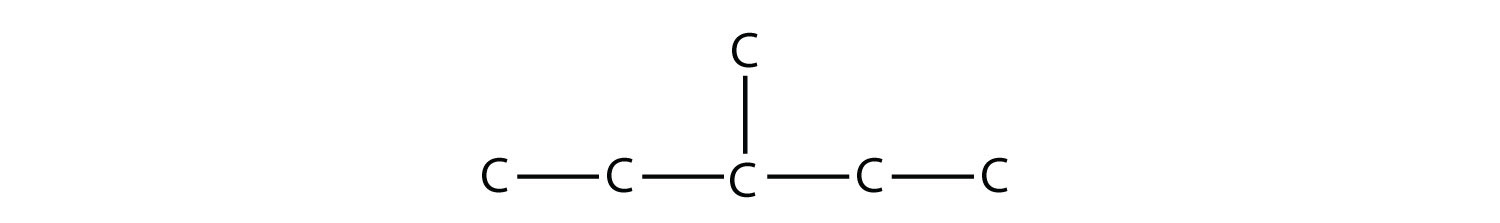
найдовший ланцюг - п'ять атомів С довжиною, тому це пентан. На третьому атомі С є одновуглецевий замінник, тому в положенні 3 є метильна група. Ми вказуємо позицію за допомогою числа, за яким слідує дефіс, назва замінника та назва батьківського вуглеводню - в даному випадку 3-метилпентан. Ця назва специфічна для цього конкретного вуглеводню та жодної іншої молекули. Номенклатура органічної хімії дуже специфічна!
Для наочності прийнято писати структурну формулу вуглеводню без атомів Н. Таким чином, ми також можемо представляти 3-метилпентан як
де розуміється, що будь-які неписані ковалентні зв'язки - це зв'язки з атомами Н. З цим розумінням ми визнаємо, що структурна формула 3-метилпентану відноситься до молекули з формулою C 6 H 14.
Назвіть цю молекулу.
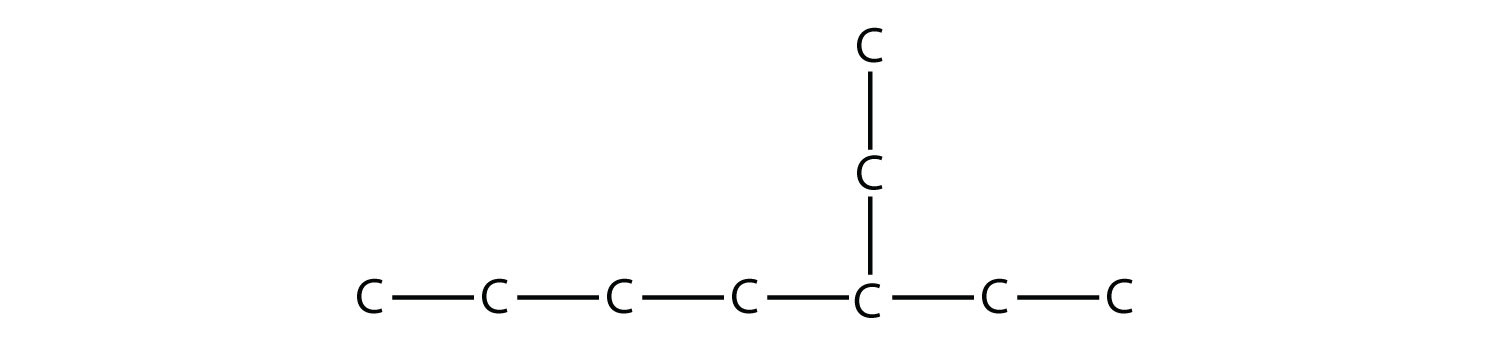
Рішення
Найдовша безперервна вуглецевий ланцюг має сім атомів С, тому ця молекула буде названа гептаном. На головному ланцюзі є двовуглецевий замінник, який є етиловою групою. Щоб дати заміснику найнижчу нумерацію, нумеруємо ланцюжок з правого боку і бачимо, що замінник знаходиться на третьому атомі С. Таким чином, цей вуглеводень - 3-етилгептан.
Назвіть цю молекулу.
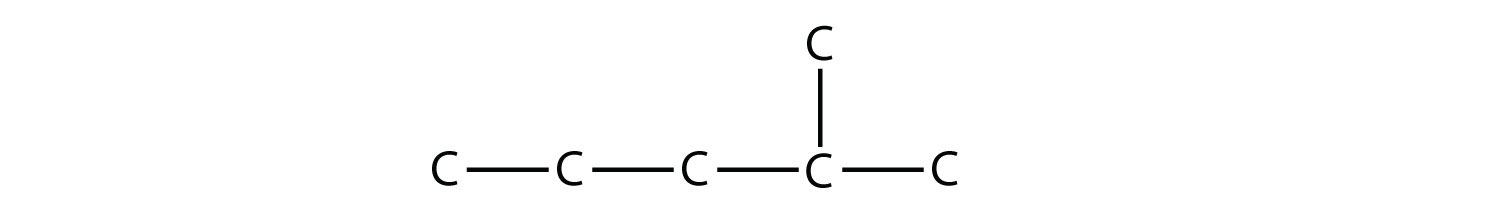
Відповідь
2-метилпентан
Розгалужені вуглеводні можуть мати більше одного замінника. Якщо замісники різні, то дайте кожному заміснику число (використовуючи найменші можливі числа) і перерахуйте замісники в алфавітному порядку, з числами, розділеними дефісами і без пробілів в назві. Отже, молекула
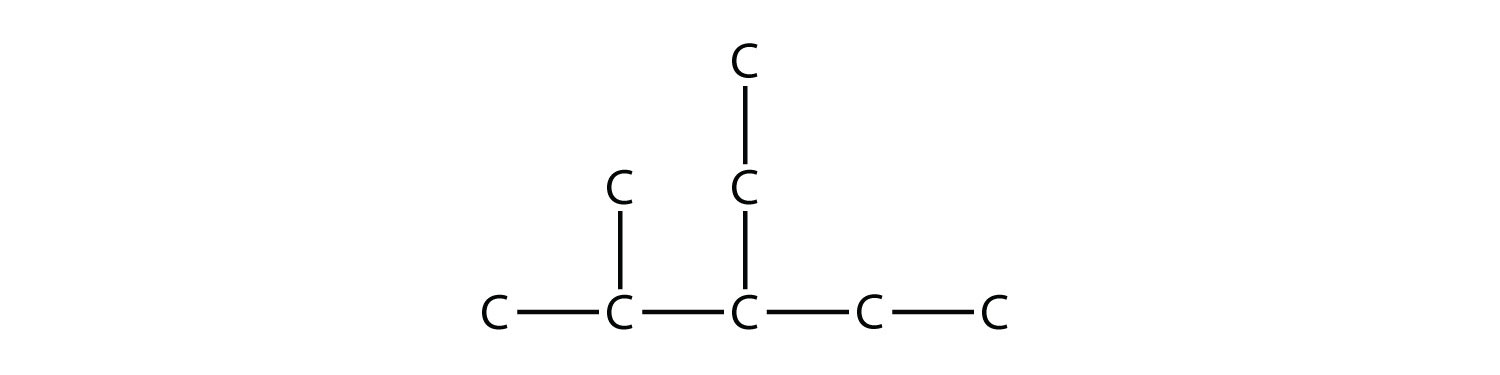
являє собою 3-етил-2-метилпентан.
Якщо замісники однакові, то використовуйте ім'я замінника тільки один раз, але використовуйте більше одного числа, розділеного комою. Крім того, поставте числовий префікс перед назвою замінника, який вказує на кількість замісників цього типу. Числові префікси наведені в табл\(\PageIndex{4}\). Число значень позиції має узгоджуватися з числовим префіксом перед замісником.
| Кількість однакових замінників | Числовий префікс |
|---|---|
| 2 | ді - |
| 3 | три- |
| 4 | тетра - |
| 5 | пента - |
| і так далі | і так далі |
Розглянемо цю молекулу:
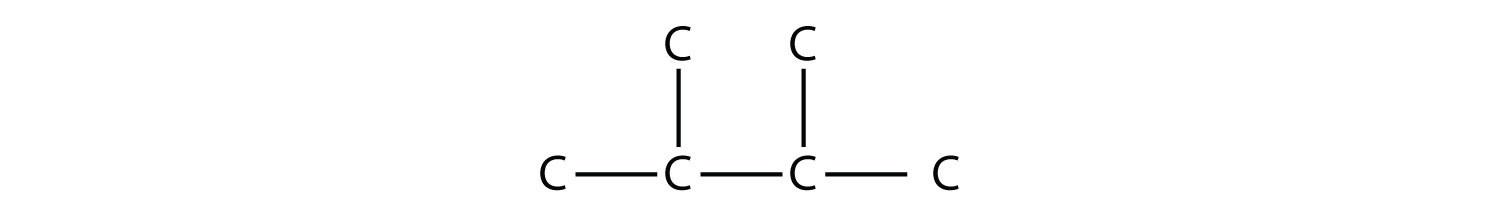
Найдовша ланцюг має чотири атома С, тому це бутан. Існує два замісника, кожен з яких складається з одного атома С; вони є метильними групами. Метильні групи знаходяться на другому і третьому атомах С в ланцюжку (незалежно від того, з якого кінця починається нумерація), тому ми б назвали цю молекулу 2,3-диметилбутаном. Зверніть увагу на кому між числами, дефіс між числами і ім'ям замінника, а також наявність префікса di - перед метилом. Інші молекули - навіть з більшою кількістю замінників - можуть називатися аналогічно.
Назвіть цю молекулу.
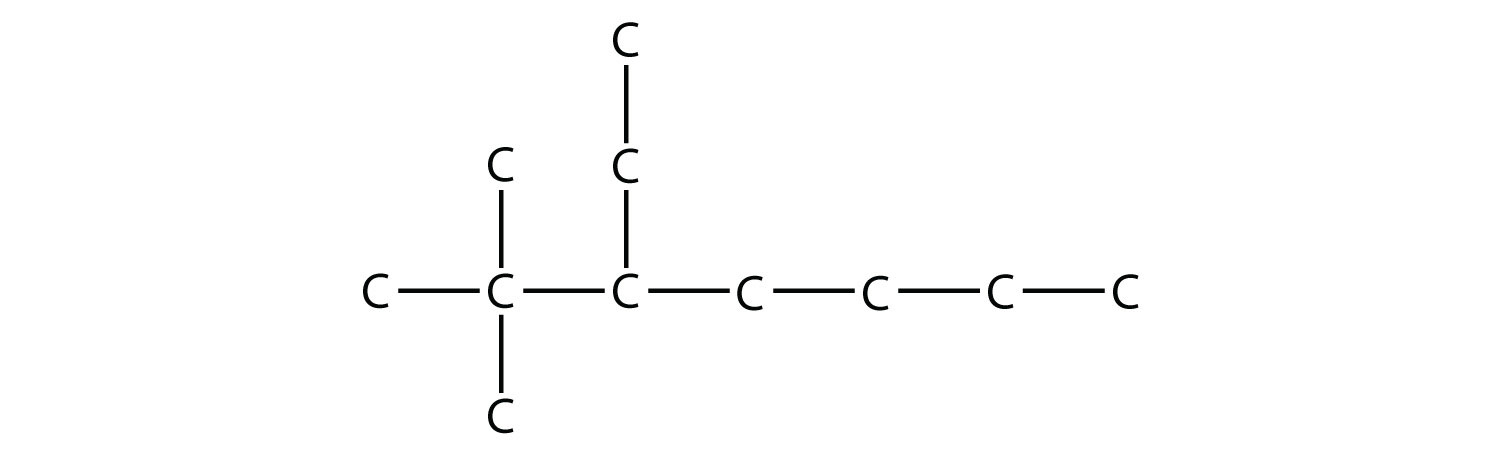
Рішення
Найдовший ланцюг має сім атомів С, тому ми називаємо цю молекулу гептаном. Знаходимо два одновуглецевих замісника на другому атомі С і двовуглецевий замінник на третьому атомі С. Так ця молекула називається 3-етил-2,2-диметилгептан.
Назвіть цю молекулу.
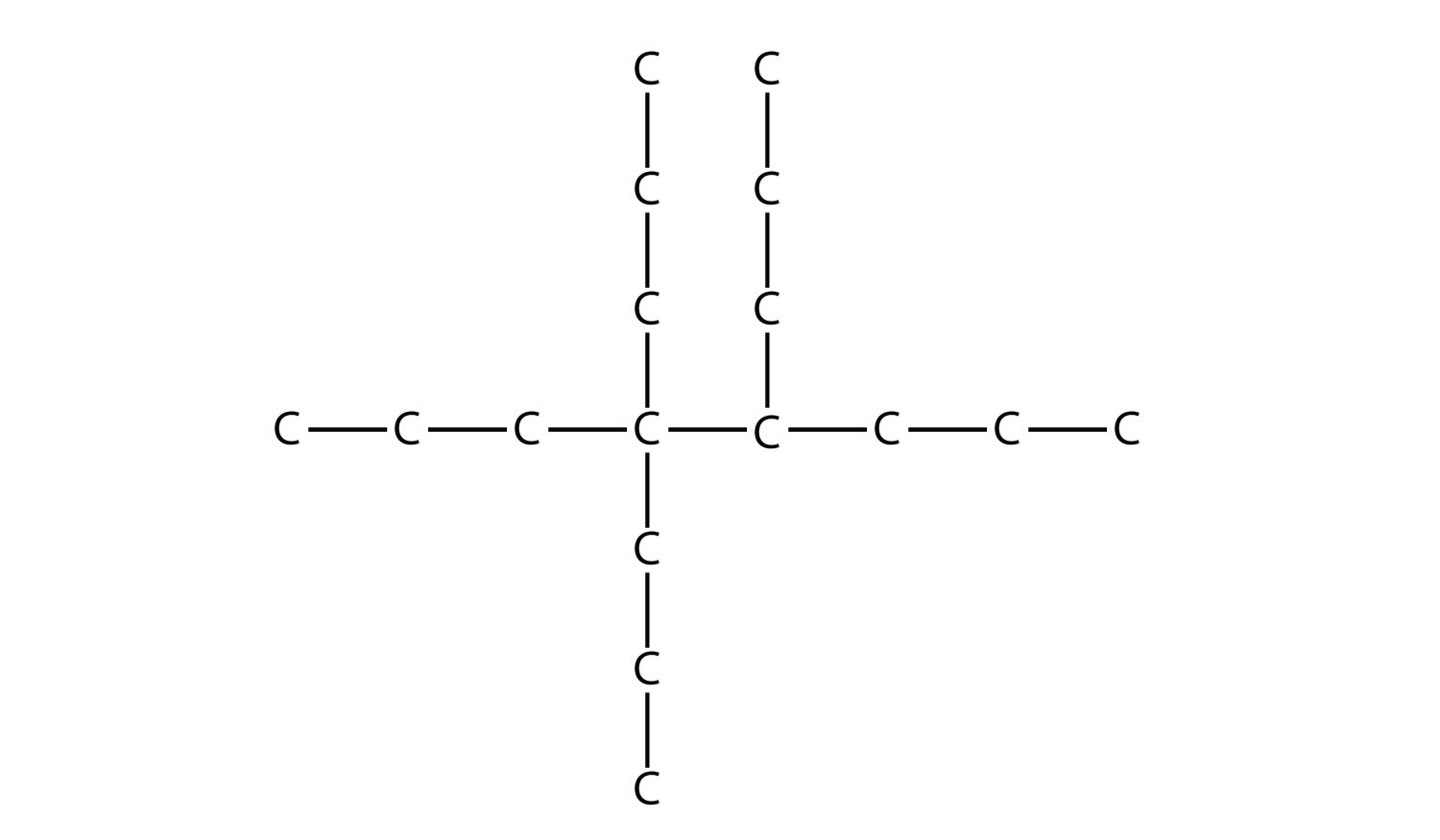
Відповідь
4,4,5-трипропілоктан
властивості алканів
Всі алкани складаються з атомів вуглецю та водню і мають подібні зв'язки, структури та формули; всі нециклічні алкани мають формулу C n H 2n +2. Кількість атомів вуглецю, присутніх в алкані, не має меж. Більша кількість атомів у молекулах призведе до сильніших міжмолекулярних атракціонів (сил дисперсії) і відповідно до різних фізичних властивостей молекул. Такі властивості, як температура плавлення і температура кипіння (таблиця\(\PageIndex{5}\)), зазвичай змінюються плавно і передбачувано в міру зміни кількості атомів вуглецю і водню в молекулах.
| Алкан | Молекулярна формула | Температура плавлення (° C) | Температура кипіння (° C) | Фаза при СТП 4 | Кількість структурних ізомерів |
|---|---|---|---|---|---|
| метан | СН 4 | —182,5 | —161,5 | газ | 1 |
| етану | С 2 Ч 6 | —183,3 | —88.6 | газ | 1 |
| пропан | С 3 Ч 8 | —187,7 | —42.1 | газ | 1 |
| бутан | З 4 Ч 10 | —138,3 | —0,5 | газ | 2 |
| пентан | З 5 Ч 12 | —129,7 | 36.1 | рідкий | 3 |
| гексан | С 6 Ч 14 | —95,3 | 68.7 | рідкий | 5 |
| гептан | С 7 Ч 16 | —90,6 | 98.4 | рідкий | 9 |
| октан | З 8 Ч 18 | —56.8 | 125.7 | рідкий | 18 |
| нонан | З 9 Ч 20 | —53,6 | 150.8 | рідкий | 35 |
| декан | С 10 Ч 22 | —29.7 | 174.0 | рідкий | 75 |
| тетрадекан | C 14 Ч 30 | 5.9 | 253.5 | твердий | 1858 |
| октадекан | С 18 Ч 38 | 28.2 | 316.1 | твердий | 60 523 |
Алкани є відносно стабільними молекулами, але тепло або світло активують реакції, які передбачають розрив одиночних зв'язків С—Н або С—С. Горіння є однією з таких реакцій:
\[\ce{CH4}(g)+\ce{2O2}(g)⟶\ce{CO2}(g)+\ce{2H2O}(g) \nonumber \]
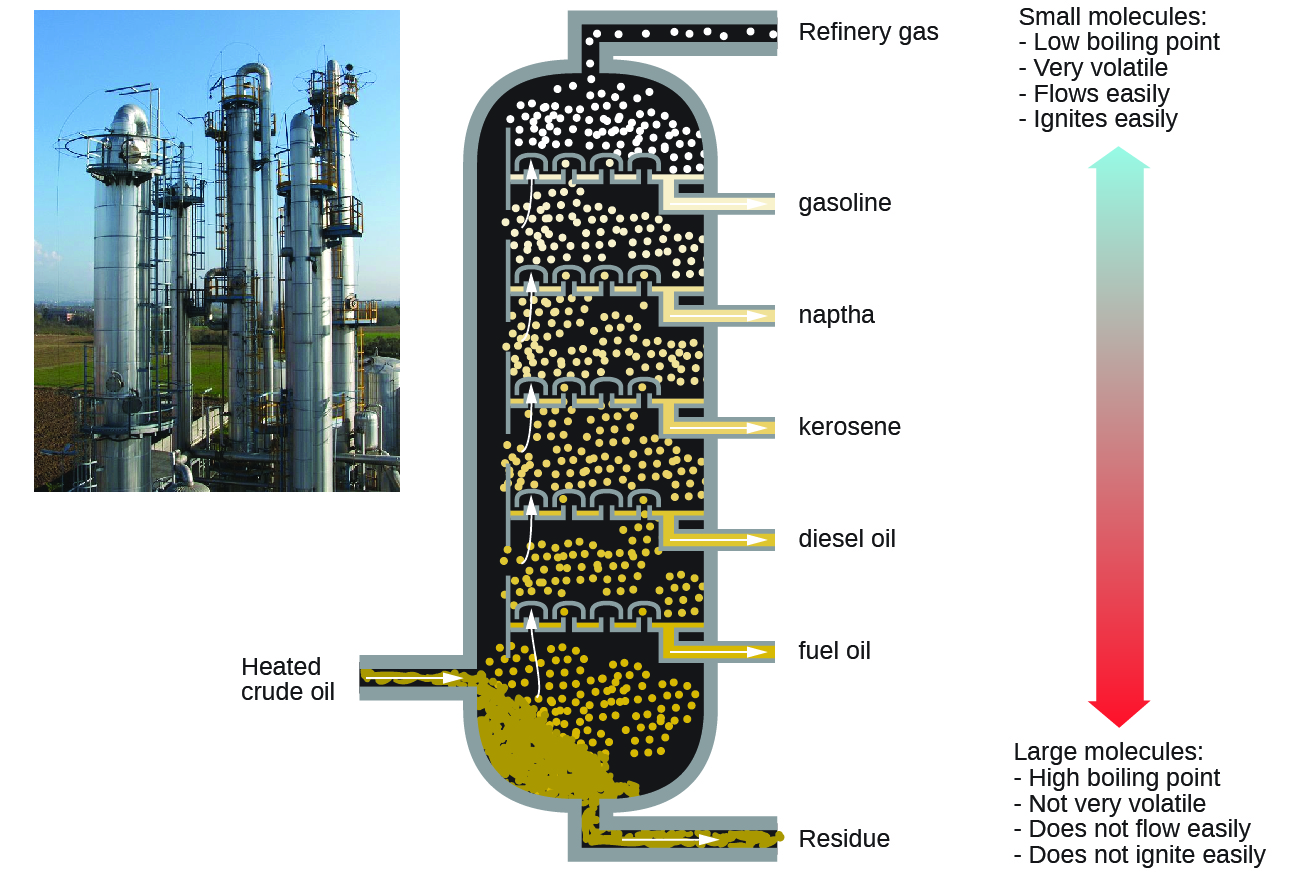
Алкани горять в присутності кисню, високоекзотермічна окислювально-відновна реакція, яка виробляє вуглекислий газ і воду. Як наслідок, алкани є відмінним паливом. Наприклад, метан, CH 4, є основним компонентом природного газу. Бутан, С 4 Н 10, використовується в кемпінгових печах і запальничках є алкан. Бензин являє собою рідку суміш алканів безперервного і розгалуженого ланцюга, кожен з яких містить від п'яти до дев'яти атомів вуглецю, плюс різні добавки для поліпшення його характеристик в якості палива. Гас, дизельне паливо і мазут - це перш за все суміші алканів з більш високими молекулярними масами. Основним джерелом цих рідких алканових палив є сира нафта, складна суміш, яка відокремлюється шляхом фракційної перегонки. Фракційна перегонка використовує відмінності в температурах кипіння компонентів суміші (рис.\(\PageIndex{10}\)). Ви можете згадати, що температура кипіння - це функція міжмолекулярних взаємодій, про яку йшла мова в розділі про розчини і колоїди.
У реакції заміщення інша типова реакція алканів, один або кілька атомів водню алкана замінюються іншим атомом або групою атомів. Ніякі вуглецево-вуглецеві зв'язки в цих реакціях не порушуються, і гібридизація атомів вуглецю не змінюється. Наприклад, реакція між етаном і молекулярним хлором, зображена тут, є реакцією заміщення:
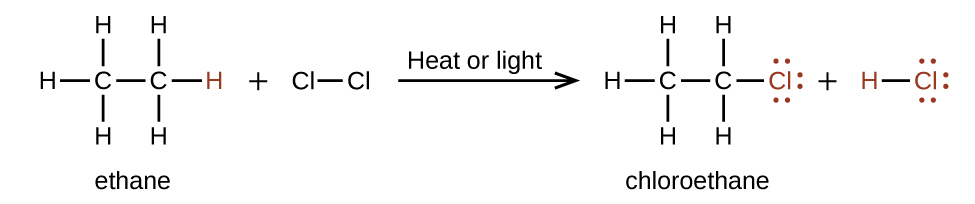
Частина C—Cl молекули хлоретану є прикладом функціональної групи, частини або фрагмента молекули, яка надає специфічну хімічну реакційну здатність. Типи функціональних груп, присутні в органічній молекулі, є основними детермінантами її хімічних властивостей і використовуються як засіб класифікації органічних сполук, як детально описано в інших розділах цієї глави.
Циклічні вуглеводні
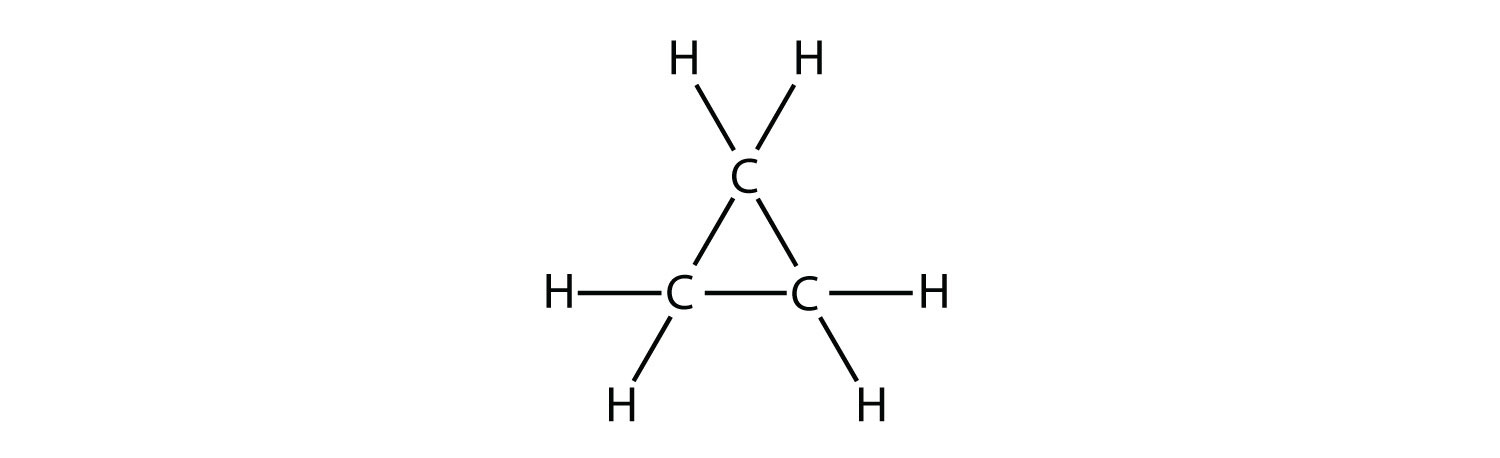
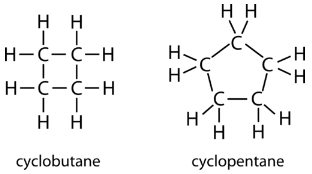
Циклічний вуглеводень - це вуглеводень, в якому вуглецевий ланцюг з'єднується з собою кільцем. Циклоалкан - це циклічний вуглеводень, в якому всі вуглецево-вуглецеві зв'язки є поодинокими зв'язками. Як і інші алкани, циклоалкани є насиченими сполуками. Циклоалкани мають загальну формулу\(\ce{C_{n}H_{2n}}\). Найпростіший циклоалкан, показаний нижче, - це циклопропан, тривуглецеве кільце.
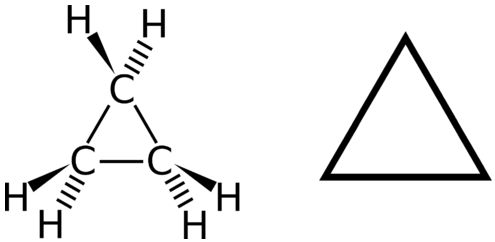
Структурні формули циклічних вуглеводнів можуть бути представлені декількома способами, дві з яких наведені вище. Кожен атом можна показати як в структурі зліва від малюнка вище. Зручна стенографія - опустити символи елемента і показати тільки форму, як в трикутнику праворуч. Під атомами вуглецю розуміють вершини трикутника.
Атоми вуглецю в циклоалканах все ще\(sp^3\) гібридизовані, з ідеальним кутом зв'язку\(109.5^\text{o}\). Однак дослідження структури циклопропану показує, що трикутна структура призводить до кута\(\ce{C-C-C}\) зв'язку\(60^\text{o}\). Таке відхилення від ідеального кута називається кільцевим деформацією і робить циклопропан досить нестійкою і реактивною молекулою. Кільцева деформація зменшується для циклобутану, з кутом зв'язку\(90^\text{o}\), але все ще є значним. Циклопентан має кут зв'язку близько\(108^\text{o}\). Ця мінімальна кільцева деформація для циклопентану робить його більш стабільною сполукою.
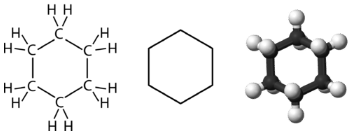
Циклогексан - це шестивуглецевий циклоалкан, показаний нижче
Всі три зображення циклогексану дещо вводять в оману, оскільки молекула не плоска. Для того, щоб зменшити деформацію кільця і досягти кута зв'язку приблизно\(109.5^\text{o}\), молекула знімається. Стягування кільця означає, що кожен інший атом вуглецю знаходиться вище і нижче площини. На малюнку нижче показані дві можливості для зібраної молекули циклогексану. Кожна з структур називається конформацією. Конформація праворуч називається конформацією човна, тоді як та, що зліва, називається конформацією стільця.
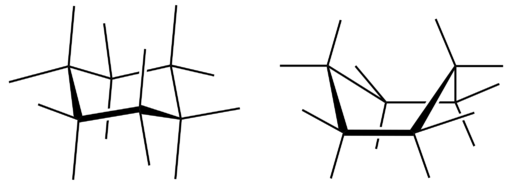
Хоча обидві конформації зменшують кільцеву деформацію порівняно з плоскою молекулою, стілець є кращим. Це пов'язано з тим, що конформація стільця призводить до меншої кількості відштовхуючих взаємодій між атомами водню. Однак взаємоперетворення легко відбувається між двома конформаціями.
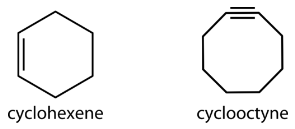
Більші циклоалкани теж існують, але зустрічаються рідше. Циклічні вуглеводні також можуть бути ненасиченими. Циклоалкен - це циклічний вуглеводень з принаймні одним подвійним зв'язком вуглець-вуглець. Циклоалкін являє собою циклічний вуглеводень з щонайменше одним вуглецево-вуглецевим потрійним зв'язком. Нижче наведені спрощені структурні формули для циклогексену та циклооктину.
Ненасичені вуглеводні: алкени та алкіни
Алкени
Органічні сполуки, що містять одну або кілька подвійних або потрійних зв'язків між атомами вуглецю, описуються як ненасичені. Ненасичені вуглеводні мають менше максимальної кількості можливих атомів Н. Ненасичені молекули вуглеводнів, які містять одну або кілька подвійних зв'язків, називаються алкенами. Атоми вуглецю, пов'язані подвійним зв'язком, пов'язані між собою двома зв'язками, однією σ зв'язком і однією π зв'язком. Подвійні та потрійні зв'язки породжують різну геометрію навколо атома вуглецю, який бере участь в них, що призводить до важливих відмінностей у молекулярній формі та властивостях. Різні геометрії відповідають за різні властивості ненасичених порівняно з насиченими жирами.
Слово un насичений має таке ж значення для вуглеводнів, що і для харчових жирів і масел: молекула має принаймні один подвійний вуглець-вуглець (C = C) або потрійний зв'язок (C = C).
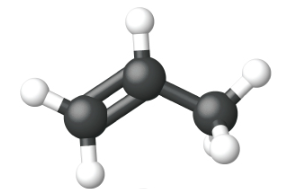
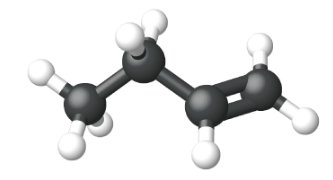
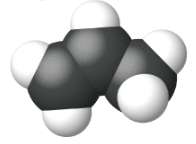
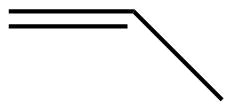
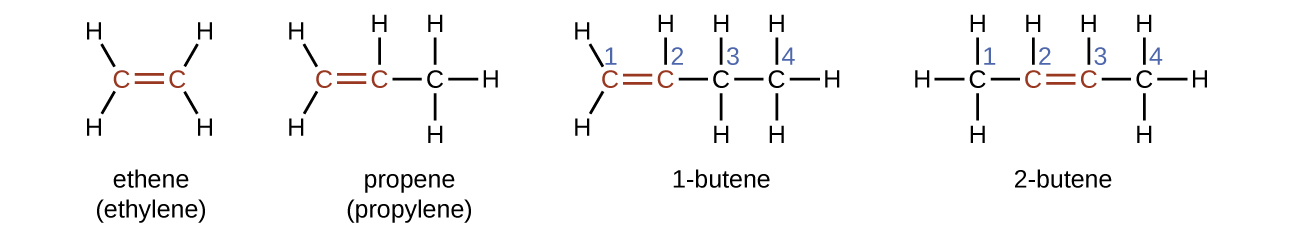
Етен, С 2 Н 4, є найпростішим алкеном. Кожен атом вуглецю в етені, який зазвичай називають етиленом, має тригональну плоску структуру. Другий член ряду - пропен (пропілен) (рис.\(\PageIndex{16}\)); в ряду слідують ізомери бутену. Чотири атома вуглецю в ланцюжку бутену дозволяють утворювати ізомери, засновані на положенні подвійного зв'язку, а також нову форму ізомерії.
| Структурна формула | 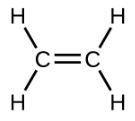 |
 |
 |
|---|---|---|---|
| Модель м'яча та палиці |  |
 |
 |
| Модель заповнення простору | 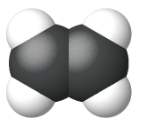 |
 |
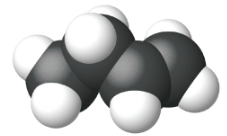 |
| Ім'я | етен | пропен | 1-бутен |
| Конденсована структурна формула | СН 2 СН 2 | СН 2 ЧЧ 3 | СН 3 СН 2 ЧЧ 2 |
| Молекулярна формула | С 2 Н 2 | С 3 Ч 6 | С 4 Ч 8 |
| Малювання кута лінії |  |
 |
 |
Назва алкена походить від назви алкана з такою ж кількістю атомів вуглецю. Наявність подвійного зв'язку позначається заміною суфікса -ane на суфікс -ene. Розташування подвійного зв'язку ідентифікується шляхом іменування меншого з чисел атомів вуглецю, що беруть участь в подвійному зв'язку:
Алкіни
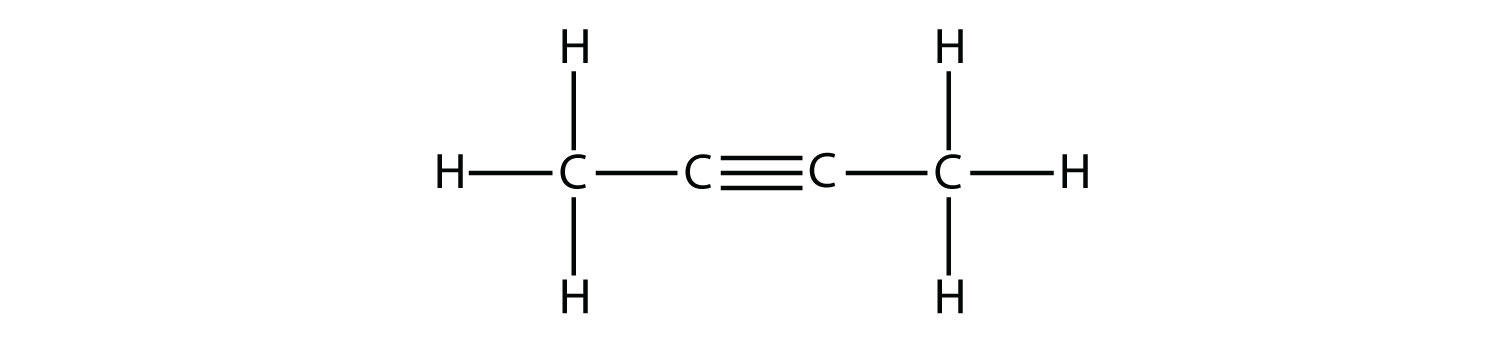
Молекули вуглеводнів з однією або декількома потрійними зв'язками називаються алкіни; вони складають ще один ряд ненасичених вуглеводнів. Два атома вуглецю, з'єднані потрійним зв'язком, пов'язані між собою однією σ зв'язком і двома π зв'язками. Sp -гібридизовані вуглеці, що беруть участь у потрійному зв'язку, мають кути зв'язку 180°, надаючи цим типам зв'язків лінійну, стрижнеподібну форму.
Найпростішим членом алкінного ряду є етин, C 2 H 2, який зазвичай називають ацетиленом. Структура Льюїса для етину, лінійної молекули, становить:
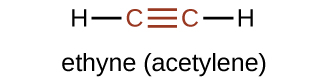
Номенклатура IUPAC для алкінів аналогічна номенклатурі для алкенів, за винятком того, що суфікс -yne використовується для позначення потрійного зв'язку в ланцюзі. Наприклад,\(\mathrm{CH_3CH_2C≡CH}\) називається 1-бутином.
Неймінг алкенів і алкінів
Подібним чином названі алкени і алкіни. Найбільша відмінність полягає в тому, що при виявленні найдовшого вуглецевого ланцюга він повинен містити подвійну або потрійну зв'язок C - C. Крім того, при нумерації основного ланцюга подвійний або потрійний зв'язок отримує мінімально можливе число. Це означає, що можуть бути замісники з довшим або більшим числом, ніж це може бути дозволено, якщо молекула була алканом. Наприклад, ця молекула
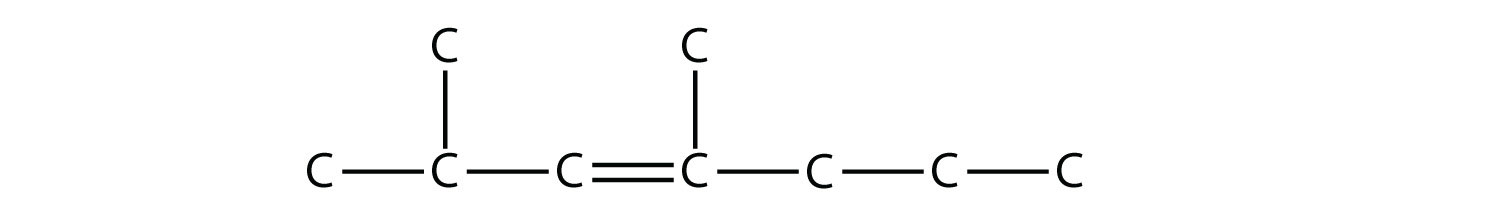
це 2,4-диметил-3-гептен (зверніть увагу на число і дефіси, які вказують на положення подвійного зв'язку).
Назвіть цю молекулу.
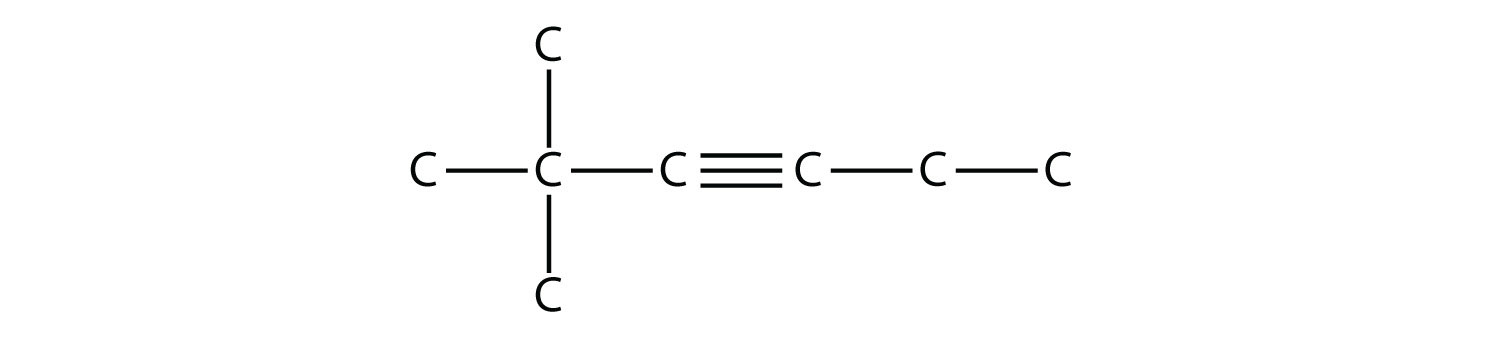
Рішення
Найдовший ланцюг, який містить потрійний зв'язок С—С, має шість атомів С, так що це молекула гексину. Потрійний зв'язок починається з третього атома С, так що це 3-гексин. Нарешті, на ланцюзі є дві метильні групи; щоб дати їм якомога менше число, ми нумеруємо ланцюг з лівого боку, надаючи метильним групам друге положення. Так назва цієї молекули - 2,2-диметил-3-гексин.
Назвіть цю молекулу.
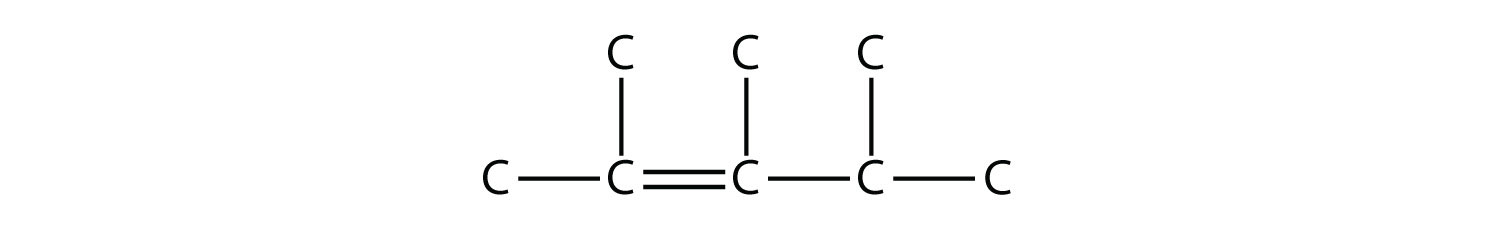
- Відповідь
-
2,3,4-триметил-2-пентен
Визначте молекулу як алкан, алкен або алкін.
Рішення
1. Молекула має принаймні один потрійний зв'язок вуглецю з вуглецем (C = C), тому вона є алкіном.
2. Молекула має подвійний зв'язок вуглецю з вуглецем (C = C), тому вона є алкеном.
3. Молекула має лише одиничні зв'язки вуглецю з вуглецем, тому вона є алканом.
Визначте молекулу як алкан, алкен або алкін.
- Відповідь
-
1. алкан, 2. алкен, 3. алкін
Властивості алкенів і алкінів
Етилен (загальна промислова назва етилену) є основною сировиною при виробництві поліетилену та інших важливих сполук. У 2010 році у всьому світі було вироблено понад 135 мільйонів тонн етилену для використання в полімерній, нафтохімічній та пластмасовій промисловості. Етилен виробляється промисловим шляхом в процесі, званому крекінгом, в якому довгі вуглеводневі ланцюги в нафтової суміші розбиваються на більш дрібні молекули.
Галогени також можуть вступати в реакцію з алкенами і алкінами, але реакція інша. У цих випадках галоген реагує з подвійним або потрійним зв'язком C-C і вставляє себе на кожен атом С, що бере участь у множинних зв'язках. Ця реакція називається реакцією приєднання. Одним із прикладів є
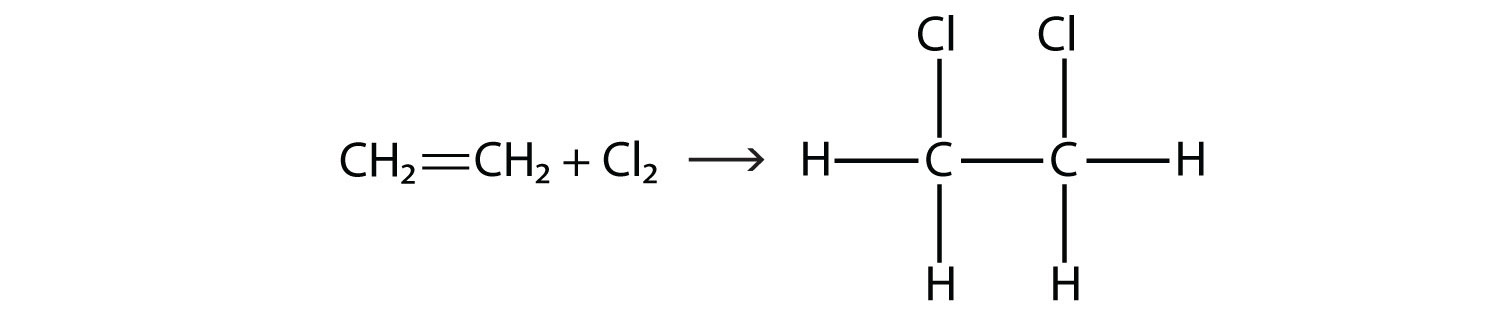
Умови реакції зазвичай м'які; у багатьох випадках галоген спонтанно реагує з алкеном або алкіном.
Водень також може бути доданий через множинний зв'язок; ця реакція називається реакцією гідрування. Однак у цьому випадку умови реакції можуть бути не м'якими; може знадобитися високий тиск газу Н 2. Платиновий або паладієвий каталізатор зазвичай використовується для того, щоб реакція протікала розумними темпами:
\[CH_{2}=CH_{2}+H_{2}\overset{metal\: catalyst}{\rightarrow} CH_{3}CH_{3} \nonumber \]
Геометричні ізомери (Cis-Trans) Ізомери
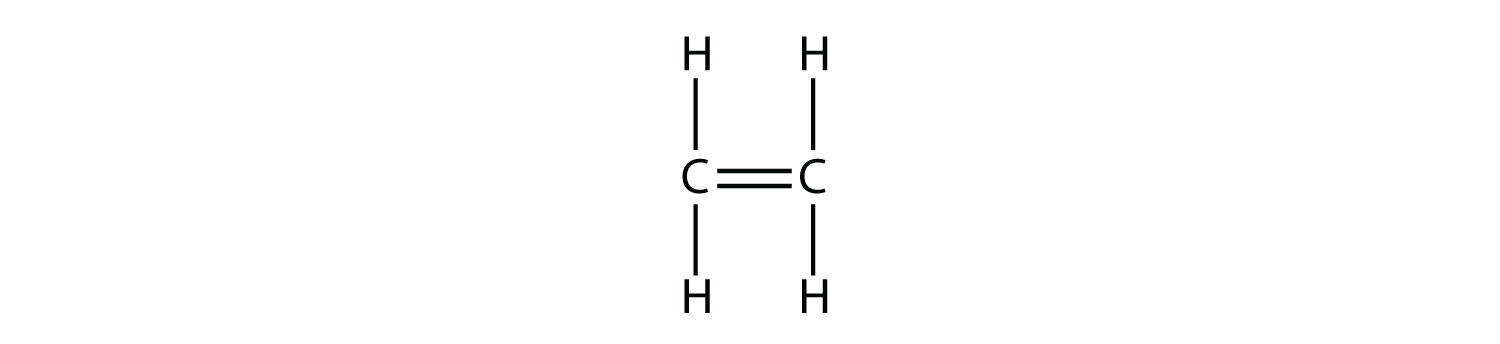
З такою молекулою, як 2-бутен, можна спостерігати інший тип ізомерії, званий геометричною ізомерією. Геометричні ізомери - це ізомери, в яких порядок з'єднання атомів однаковий, але розташування атомів у просторі різне. Подвійний зв'язок в алкені не може вільно обертатися через характер зв'язків пі. Тому існує два різних способи побудови молекули 2-бутену. На зображенні нижче показані два геометричні ізомери, звані цис-2-бутен і транс-2-бутен.
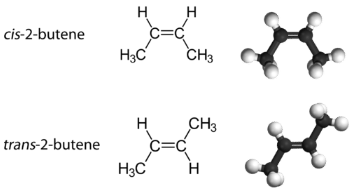
Ізомер цис має два одиничних атома водню на одній стороні молекули, тоді як транс-ізомер має їх на протилежних сторонам молекули. В обох молекулах порядок зв'язку атомів однаковий. Для того, щоб геометричні ізомери існували, в молекулі повинна бути жорстка структура, щоб запобігти вільному обертанню навколо зв'язку. Якби подвійний зв'язок в алкені був здатний обертатися, двох геометричних ізомерів вище не існувало б. Крім того, два атоми вуглецю повинні мати дві різні групи, прикріплені для того, щоб там були геометричні ізомери. Пропен не має геометричних ізомерів, оскільки один з атомів вуглецю має два одиночних водню, пов'язані з ним.
Фізико-хімічні властивості геометричних ізомерів, як правило, різні. У той час як цис-2-бутен є полярною молекулою, транс-2-бутен неполярний. Тепло або опромінення світлом можуть бути використані для перетворення одного геометричного ізомеру в інший. Вхід енергії повинен бути досить великим, щоб розірвати pi зв'язок між двома атомами вуглецю, який слабший, ніж сигма-зв'язок. У цей момент тепер єдиний зв'язок вільно обертається, і ізомери можуть взаємоконвертувати.
Як і у алкенів, алкіни проявляють структурну ізомерію, починаючи з 1-бутину та 2-бутину. Однак геометричних ізомерів з алкінами немає, оскільки існує лише одна інша група, пов'язана з атомами вуглецю, які беруть участь у потрійному зв'язку.
Резюме
- Прості алкани існують у вигляді гомологічного ряду, в якому сусідні члени відрізняються одиницею СН 2.
- Конденсовані хімічні формули показують атоми водню (або інші атоми або групи) поруч із атомами вуглецю, до яких вони прикріплені.
- Лінійно-кутові формули мають на увазі атом вуглецю по кутах і кінцях ліній. Зрозуміло, що кожен атом вуглецю приєднаний до достатньої кількості атомів водню, щоб дати кожному атому вуглецю чотири зв'язки.
- Алкани мають як загальні назви, так і систематичні назви, зазначені IUPAC.
- Наведено назви та структури типових циклічних вуглеводнів.
- Визначено структурні та геометричні ізомери.
- Наведено приклади ізомерів алкану та алкену.
Автори та атрибуція
- OpenSTAX
- TextMap: Beginning Chemistry (Ball et al.)
- Template:ContribCK12
- Template:ContribAgnewM
- Template:ContribAgnewH