6.6: Закон про ідеальний газ та деякі програми
- Page ID
- 22689
- Вивчіть ідеальний закон газу.
- Застосовуйте ідеальний закон газу до будь-якого набору умов газу.
- Застосовуйте ідеальний закон газу до молярних обсягів, щільності та стехіометрії.
Поки що газові закони, які ми розглянули, вимагають, щоб газ змінив свої умови; тоді ми прогнозуємо зміну однієї з його властивостей. Чи існують закони газу, які пов'язують фізичні властивості газу в будь-який момент часу? Розглянемо подальше продовження закону про комбінований газ на включення п. За аналогією із законом Авогадро n позиціонується в знаменнику дробу, протилежному обсягу. Отже,
\[\frac{PV}{nT}=constant\nonumber \]
Оскільки тиск, об'єм, температура та кількість є єдиними чотирма незалежними фізичними властивостями газу, константа у вищезгаданому рівнянні справді є постійною. Дійсно, оскільки нам не потрібно вказувати ідентичність газу, щоб застосувати газові закони, ця константа однакова для всіх газів. Визначимо цю константу символом R, тому попереднє рівняння записується як
\[\dfrac{PV}{nT}=R\nonumber \]
який зазвичай переставляється як
\[PV = nRT\nonumber \]
Це рівняння називається законом ідеального газу. Він пов'язує чотири незалежні властивості газу в будь-який час. Константа\(R\) називається постійною закону ідеального газу. Його величина залежить від одиниць, використовуваних для вираження тиску і обсягу.
| Числове значення | Одиниці |
|---|---|
| 0.08205 | \(\dfrac{L.atm}{mol.K}\) |
| 62.36 | \(\dfrac{L.torr}{mol.K}=\dfrac{L.mmHg}{mol.K}\) |
| 8.314 | \(\dfrac{J}{mol.K}\) |
Ідеальний закон газу використовується, як і будь-який інший закон газу, при цьому увага приділяється одиниці та вираженню температури в кельвіні. Однак ідеальний закон газу не вимагає зміни умов проби газу. Ідеальний закон газу має на увазі, що якщо знати будь-які три фізичні властивості газу, можна обчислити четверте властивість.
Зразок 4,22 моль\(\ce{Ar}\) має тиск 1,21 атм і температуру 34° C Який його обсяг?
Рішення
Насамперед необхідно перетворити температуру в кельвіни:
\[34 + 273 = 307\, \ce{K} \nonumber\]
Тепер ми можемо підставити умови в ідеальний закон газу:
\[(1.21atm)(V)=(4.22\, mol)\left(0.08205\dfrac{L.atm}{mol.K}\right)(307\, K)\nonumber \]
Блок атм знаходиться в чисельнику обох сторін, тому він скасовує. У правій частині рівняння одиниці моль і К з'являються в чисельнику та знаменнику, тому вони також скасовують. Єдина одиниця, що залишилася - L, яка є одиницею об'єму, яку ми шукаємо. Виділяємо змінну обсягу діленням обох сторін рівняння на 1,21:
\[V=\dfrac{(4.22)(0.08205)(307)}{1.21}L\nonumber \]
Тоді вирішивши для обсягу, отримуємо V = 87,9 л
Зразок 0,0997 моль\(\ce{O2}\) має тиск 0,692 атм і температуру 333 К. Який його обсяг?
- Відповідь
-
3.94 Л
При заданій температурі 0,00332 г Hg в газовій фазі має тиск 0,00120 мм рт.ст. і обсяг 435 л. Яка його температура?
Рішення
Нам не дано кількість молей Hg безпосередньо, але нам дається маса. Ми можемо використовувати молярну масу Hg для перетворення на кількість родимок.
\[0.00332\cancel{g\, Hg}\times \frac{1\, mol\, Hg}{200.59\cancel{g\, \, Hg}}=0.0000165\, mol=1.65\times 10^{-5}mol\nonumber \]
Тиск задається в одиницях міліметрів ртутного стовпа. Ми можемо або перетворити це в атмосфери, або використовувати значення ідеальної газової константи, яка включає одиницю мм рт.ст. Ми візьмемо другий варіант. Підставляючи в ідеальний закон газу,
\[(0.00332\, mm\, Hg)(435\, L)=(1.65\times 10^{-5}mol)(62.36\frac{L.mmHg}{mol.K})T\nonumber \]
Одиниці мм рт.ст., L та моль скасовують, залишаючи одиницю K, одиницю температури. Ізолюючи Т з одного боку, отримуємо
\[T=\frac{(0.00332)(435)}{(1.65\times 10^{-5})(62.36)}K\nonumber \]
Потім вирішивши для K, отримаємо T = 1,404 К.
Для 0,00554 моль зразка Н 2 Р = 23,44 торр і Т = 557 К. Який його обсяг?
- Відповідь
-
8.21 Л
Ідеальний закон газу також може бути використаний в задачах стехіометрії.
Який обсяг\(\ce{H2}\) виробляється при 299 К і 1,07 атм при реагуванні 55,8 г\(\ce{Zn}\) металу з надлишком\(\ce{HCl}\)?
\[\ce{Zn(s) + 2HCl(aq) -> ZnCl2(aq) + H2(g)}\nonumber \]
Рішення
Тут ми маємо проблему стехіометрії, де нам потрібно знайти кількість вироблених родимок H 2. Тоді ми можемо використовувати ідеальний закон газу, із заданою температурою та тиском, щоб визначити обсяг виробленого газу. Спочатку розраховується кількість родимок Н 2:
\[55.8\cancel{g\, Zn}\times \frac{1\cancel{mol\, Zn}}{65.41\cancel{g\, Zn}}\times \dfrac{1\, mol\, H_{2}}{1\cancel{mol\, Zn}}=0.853\, H_{2}\nonumber \]
Тепер, коли ми знаємо кількість молів газу, ми можемо використовувати ідеальний закон газу для визначення обсягу, враховуючи інші умови:
\[(1.07atm)V=(0.853\, mol)\left(0.08205\dfrac{L.atm}{mol.K}\right)(299\, K)\nonumber \]
Всі одиниці скасовують, крім L, для обсягу, що означає V = 19,6 л
Який тиск\(\ce{HCl}\) утворюється, якщо 3,44 г\(\ce{Cl2}\) реагують в 4,55 л при 455 К?
\[\ce{H2(g) + Cl2(g) → 2HCl(g)}\nonumber \]
- Відповідь
-
0,796 атм
До теперішнього часу повинно бути очевидно, що деякі фізичні властивості газів сильно залежать від умов. Що нам потрібно, так це набір стандартних умов, щоб властивості газів можна було правильно порівнювати один з одним. Стандартна температура і тиск (STP) визначається як рівно 100 кПа тиску (0,986 атм) і 273 К (0° C). Для простоти ми будемо використовувати 1 атм в якості стандартного тиску. Визначення СТП дозволяє більш безпосередньо порівнювати властивості газів, які відрізняються один від одного.
Однією з властивостей, що поділяються між газами, є молярний обсяг. Молярний об'єм - це обсяг 1 моль газу. На STP молярний об'єм газу можна легко визначити, використовуючи ідеальний закон газу:
\[(1\, atm)V=(1\, mol) \left(0.08205\dfrac{L.atm}{mol.K}\right)(273\, K)\nonumber \]
Всі одиниці скасовують, крім L, одиниці об'єму. Отже V = 22,4 л
Відзначимо, що ідентичність газу ми не вказали; ми вказали лише, що тиск дорівнює 1 атм, а температура 273 К. Це робить для дуже корисного наближення: будь-який газ при СТП має обсяг 22,4 л на моль газу; тобто молярний об'єм при СТП дорівнює 22,4 л/моль (рис. \(\PageIndex{1}\)). Цей молярний об'єм робить корисним коефіцієнтом перетворення в задачах стехіометрії, якщо умови знаходяться на STP. Якщо умови не на STP, молярний об'єм 22,4 л/моль непридатний. Однак, якщо умови знаходяться на STP, комбінований закон газу може бути використаний для обчислення того, яким буде обсяг газу, якщо при STP; тоді можна використовувати молярний об'єм 22,4 л/моль.
Скільки родимок\(\ce{Ar}\) присутній в 38,7 л при СТП?
Рішення
Ми можемо використовувати молярний об'єм, 22,4 л/моль, як коефіцієнт перетворення, але нам потрібно змінити дріб, щоб одиниці L скасували і вводити моль одиниці. Це одноетапне перетворення:
\[38.7\, \cancel{L}\times \frac{1\, mol}{22.4\cancel{L}}=1.73\, mol\nonumber \]
Який обсяг має 4,87\(\ce{Kr}\) моль при STP?
- Відповідь
-
109 Л
Який обсяг\(\ce{H2}\) виробляється при СТП, коли 55,8 г\(\ce{Zn}\) металу вступають в реакцію з надлишком\(\ce{HCl}\)?
\[\ce{Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)} \nonumber \]
Рішення
Це проблема стехіометрії зі скручуванням: нам потрібно використовувати молярний об'єм газу при СТП, щоб визначити остаточну відповідь. Перша частина розрахунку така ж, як і в попередньому прикладі:
\[55.8\cancel{g\, Zn}\times \frac{1\cancel{mol\, Zn}}{65.41\cancel{g\, Zn}}\times \frac{1\, mol\, H_{2}}{1\cancel{mol\, Zn}}=0.853\, H_{2}\nonumber \]
Тепер ми можемо використовувати молярний об'єм, 22,4 л/моль, тому що газ знаходиться на STP:
\[0.853\cancel{mol\, H_{2}}\times \frac{22.4\, L}{1\cancel{mol\, H_{2}}}=19.1\, L\, H_{2}\nonumber \]
Крім того, ми могли б застосувати молярний об'єм як третій коефіцієнт перетворення в початковому розрахунку стехіометрії.
Який обсяг\(\ce{HCl}\) утворюється, якщо 3,44 г\(\ce{Cl2}\) реагують на STP?
\[\ce{H2(g) + Cl2(g) → 2HCl(g)} \nonumber \]
- Відповідь
-
2.17 Л
Ідеальний закон газу також може бути використаний для визначення щільності газів. Щільність, нагадаємо, визначається як маса речовини, поділена на його обсяг:
\[d=\dfrac{m}{V} \label{density}\]
Припустимо, що у вас рівно 1 моль газу. Якщо знати ідентичність газу, можна визначити молярну масу речовини. Використовуючи ідеальний закон газу, ви також можете визначити обсяг цього моля газу, використовуючи будь-які умови температури та тиску. Потім можна розрахувати щільність газу, скориставшись
\[\text{density}=\dfrac{\text{molar mass}}{\text{molar volume}} \nonumber\]
Яка щільність\(\ce{N2}\) при 25°C і 0,955 атм?
Рішення
По-перше, ми повинні перетворити температуру в кельвін:
\[25 + 273 = 298\, \ce{K} \nonumber\]
Якщо припустити рівно 1 моль\(\ce{N2}\), то ми знаємо його масу: 28,0 м Використовуючи закон ідеального газу, можна обчислити обсяг:
\[(0.955\, atm)V=(1\, mol)\left(0.08205\frac{L.atm}{mol.K}\right)(298\, K)\nonumber \]
Всі блоки скасовують за винятком\(L\), одиниці об'єму. Так\(V = 25.6\,\ce{L}\)
Знаючи молярну масу і молярний об'єм, ми можемо визначити щільність за цих\(\ce{N2}\) умов за допомогою Equation\ ref {density}:
\[d=\frac{28.0\, g}{25.6\, L}=1.09\, g/L\nonumber \]
Яка щільність\(\ce{CO2}\) при тиску 0,0079 атм і 227 К? (Це приблизні атмосферні умови на Марсі.)
- Відповідь
-
0,019 г/л
Дихання (правильніше називається диханням) - це процес, за допомогою якого ми втягуємо повітря в легені, щоб наші тіла могли забрати кисень з повітря. Давайте застосуємо газові закони до дихання.
Почніть з розгляду тиску. Ми втягуємо повітря в наші легені, оскільки діафрагма, м'яз під легенями, рухається вниз, щоб зменшити тиск у легенях, змушуючи зовнішнє повітря спрямовуватися, щоб заповнити об'єм нижчого тиску. Ми виганяємо повітря діафрагмою, що штовхається на легені, збільшуючи тиск всередині легенів і змушуючи повітря високого тиску назовні. Які зміни тиску беруть участь? Чверть атмосфери? Десята частина атмосфери? Насправді, в нормальних умовах це лише 1 або 2 торр різниці тиску, що змушує нас вдихати і виходити.
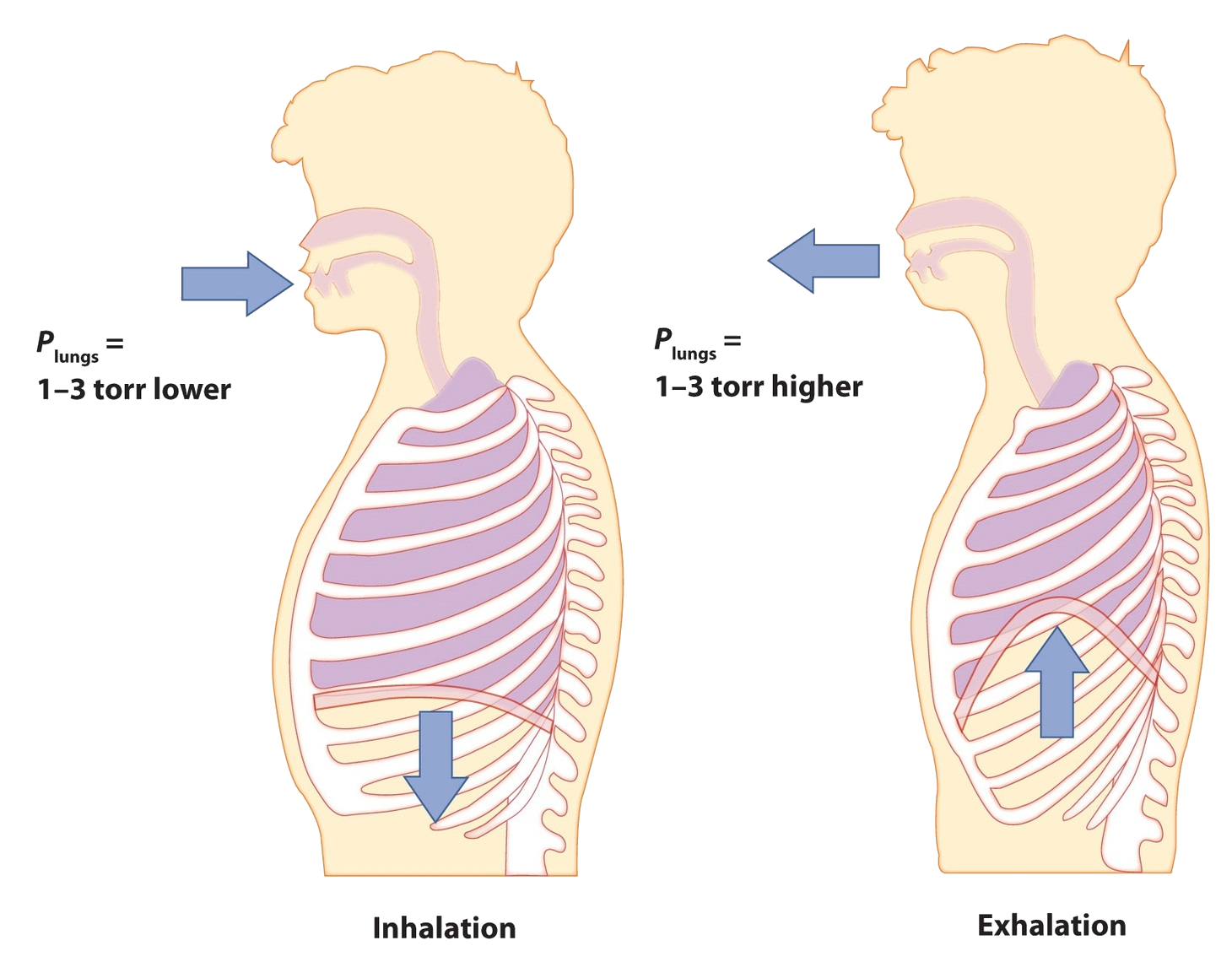
Нормальне дихання становить близько 0,50 л. Якщо температура в приміщенні близько 22°C, то повітря має температуру близько 295 К. При нормальному тиску 1,0 атм, скільки моль повітря ми приймаємо на кожен вдих? Ідеальний закон газу дає нам відповідь:
\[(1.0\, atm)(0.50\, L)=n \left(0.08205\dfrac{L.atm}{mol.K}\right)(295\, K)\nonumber \]
Вирішуючи за кількістю родимок, отримуємо
\[n = 0.021\, \ce{mol\, air} \nonumber\]
Це закінчується приблизно 0,6 г повітря на дихання - не так багато, але достатньо, щоб зберегти нас в живих.
Резюме
- Ідеальний закон газу пов'язує чотири незалежні фізичні властивості газу в будь-який час.
- Ідеальний закон газу може бути використаний в стехіометрії проблеми з хімічними реакціями, що включають гази.
- Стандартна температура і тиск (STP) є корисним набором еталонних умов для порівняння інших властивостей газів.
- При СТП гази мають обсяг 22,4 л на моль.
- Ідеальний закон газу можна використовувати для визначення щільності газів.
