18.3: Амінокислоти
- Розпізнавати амінокислоти і класифікувати їх виходячи з особливостей їх бічних ланцюгів.
- Визначте, які амінокислоти є хіральними.
Білки у всіх живих видах, від бактерій до людини, - це полімери, побудовані з одного набору з 20 амінокислот. Людина може синтезувати лише близько половини необхідних амінокислот; решта повинна бути отримана з раціону і відомі як незамінні амінокислоти. Однак дві додаткові амінокислоти були виявлені в обмеженій кількості в білках: Селеноцистеїн був відкритий в 1986 році, а піролізин був відкритий в 2002 році.
Амінокислотна структура
Кожна амінокислота містить аміногрупу (—NH 2), карбоксильну групу (—COOH) та бічний ланцюг або групу R, які всі приєднані до альфа (α-) вуглецю (безпосередньо пов'язаного з карбоксильною функціональною групою). Тому амінокислоти прийнято називати альфа-амінокислотами (α-аміно) кислотами. На малюнку18.3.1 нижче показано будову дженерикаα -амінокислоти.
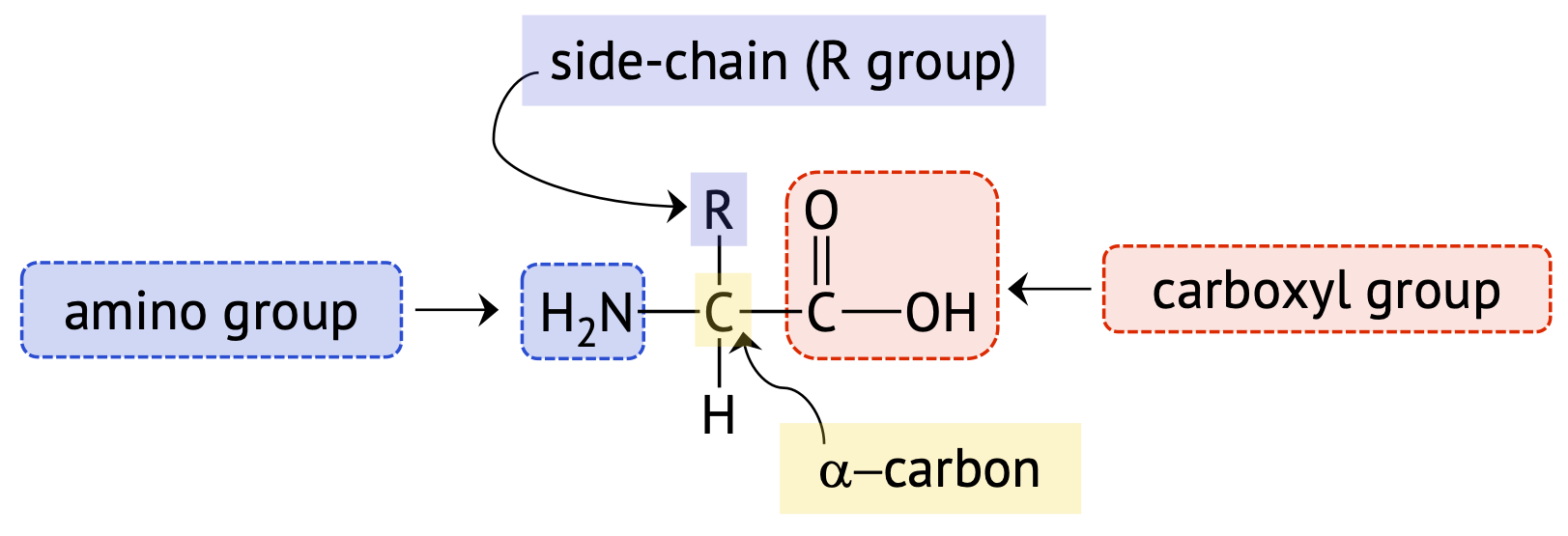
Амінокислотні бічні ланцюги
Амінокислотні бічні ланцюги або групи R можуть варіюватися від одного атома водню (як у гліцину), до простого вуглеводневого ланцюга, до вуглеводню, що містить функціональну групу. Кожна група R має відмінності в розмірах, формі, розчинності та іонізаційних властивостях, що сприяє унікальним властивостям окремої амінокислоти і може впливати на загальну структуру та функцію білка.
У таблиці18.3.1 нижче перераховані 20 поширених амінокислот разом з їх назвами, їх трьох- і однобуквенними кодами, структурами та відмінними рисами. Трилітерні коди, як правило, перші три літери назви амінокислоти, за винятком кількох випадків, таких як ізолейцин (Іль) та триптофан (Trp). Аналогічно однобуквенний код зазвичай є першою літерою в назві амінокислоти, але там, де буква не є унікальною, використовується буква, фонетично схожа на назву амінокислоти: F для F енілаланін, R для R гінін, і W для t W iptophan. Ця таблиця також групує амінокислоти відповідно до того, чи є бічний ланцюг при нейтральному рН неполярним, полярним незарядженим, позитивно зарядженим або негативно зарядженим.
| Загальна назва | Трилітерний (однобуквенний) код | Систематичне (IUPAC) Назва | Структурна формула (при рН 6) | Ізоелектрична точка (pI) | Відмінна риса |
|---|---|---|---|---|---|
| Амінокислоти з неполярною групою R | |||||
| гліцин | Глі (Г) | аміноетанової кислоти | 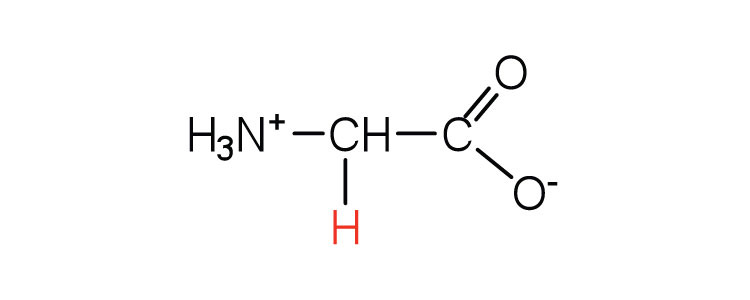 |
6.0 | єдина амінокислота, яка не має хірального вуглецю |
| аланін | Ала (А) | 2-амінопропанова кислота | 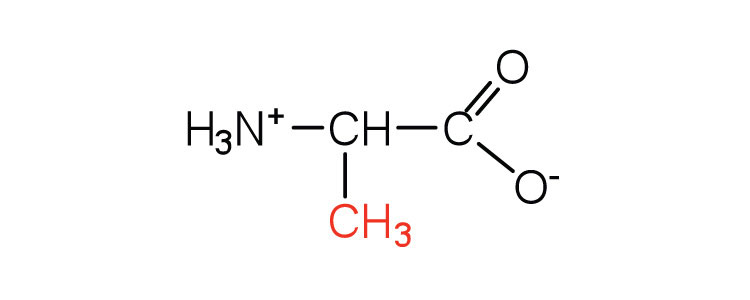 |
6.0 | метильна група, це другий найменший бічний ланцюг |
| валін | Вал (V) | 2-аміно-3-метилбутанова кислота | 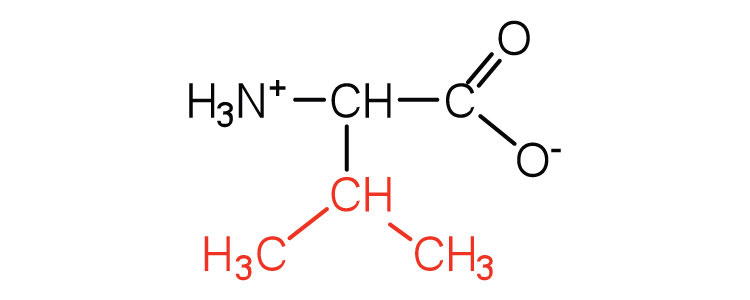 |
6.0 | амінокислота з розгалуженим ланцюгом |
| лейцин | Лей (L) | 2-аміно-4-метилпентановая кислота | 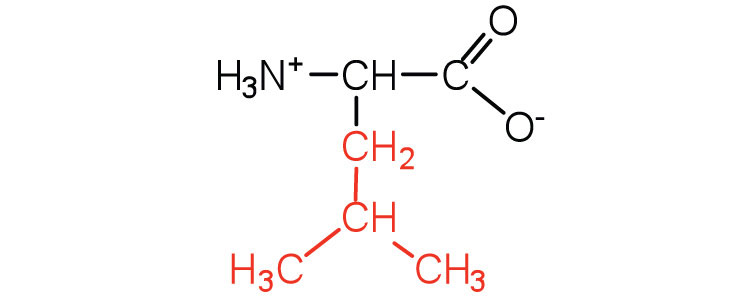 |
6.0 | амінокислота з розгалуженим ланцюгом |
| ізолейцин | Іль (I) | 2-аміно-3-метилпентановая кислота | 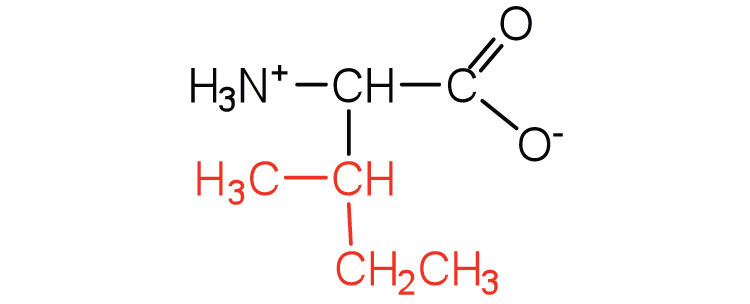 |
6.0 | незамінна амінокислота, оскільки більшість тварин не можуть синтезувати амінокислоти з розгалуженим ланцюгом |
| фенілаланін | Фе (F) | 2-аміно-3-фенілпропанова кислота | 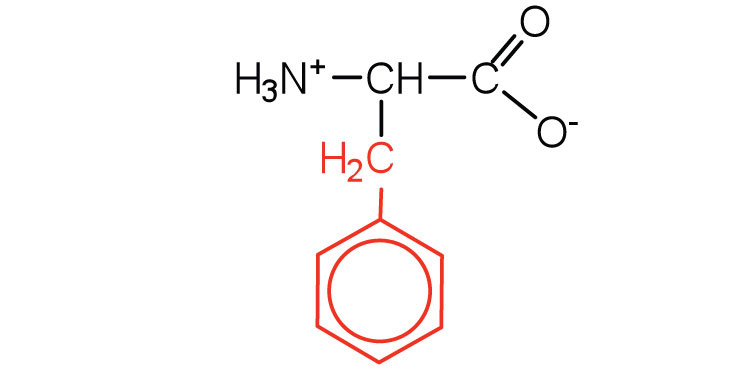 |
5.5 | також класифікується як ароматична амінокислота |
| триптофан | трп (Вт) | 2-аміно-3- (1 Н -індол-3-іл) -пропанова кислота | 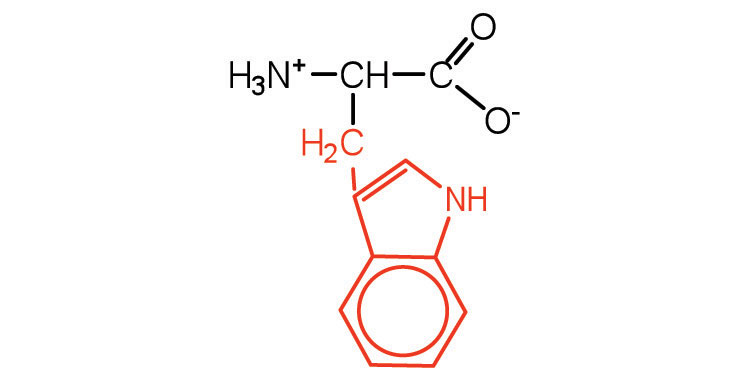 |
5.9 | також класифікується як ароматична амінокислота |
| метіонін | Мет (М) | 2-аміно-4- (метилтіо) бутанова кислота | 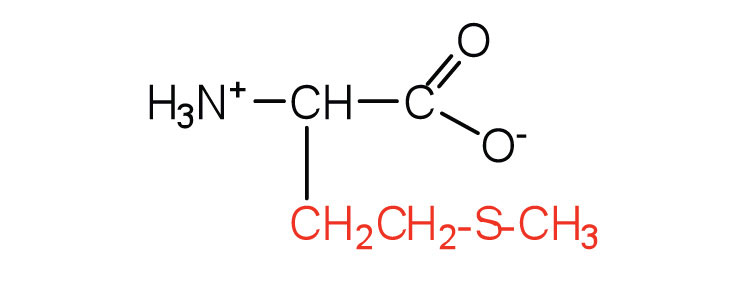 |
5.7 | функції бічного ланцюга як донор метильної групи |
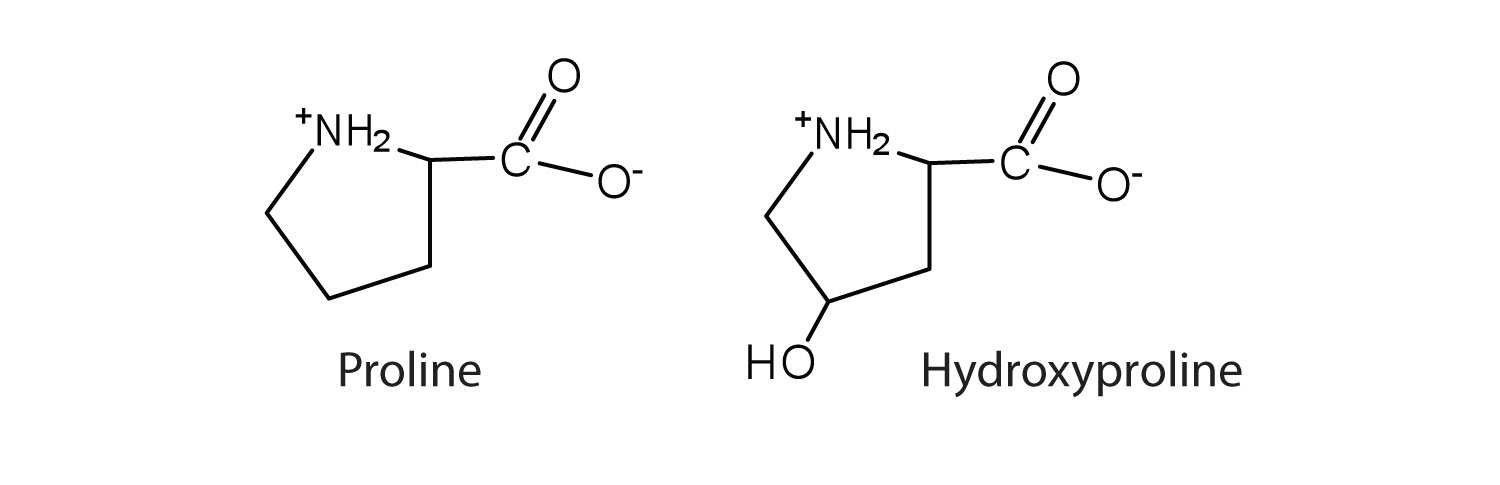
| пролін | Про (P) | піролідин-2-карбонова кислота | 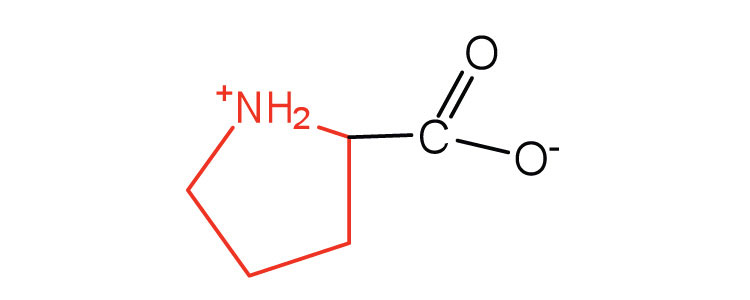 |
6.3 | містить вторинну амінну групу; іменується α-імінокислотою |
| Амінокислоти з полярною, але нейтральною групою R | |||||
| серин | Сер (S) | 2-аміно-3-гідроксипропанова кислота | 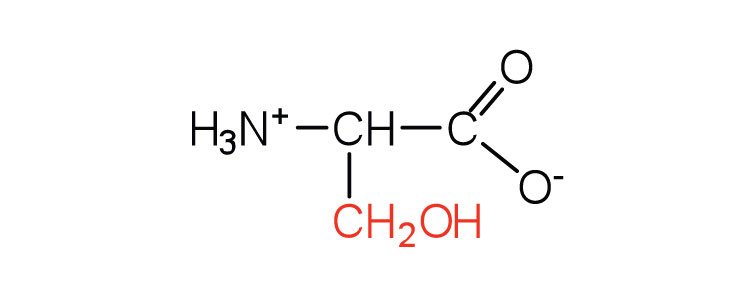 |
5.7 | виявлено на активному місці багатьох ферментів |
| треонін | Thr (Т) | 2-аміно-3-гідроксибутанова кислота | 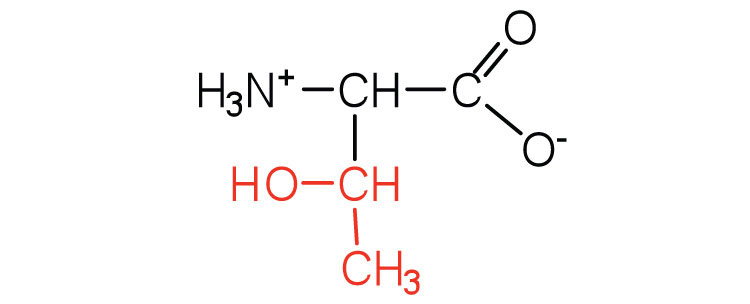 |
5.6 | названий за його схожість з цукровою треозою |
| цистеїн | Cys (C) | 2-аміно-3-меркаптопропанова кислота | 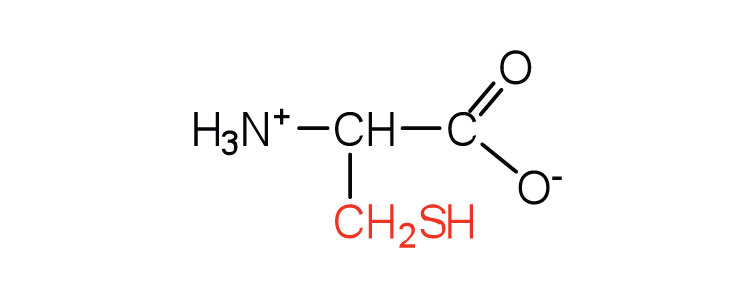 |
5.0 | окислення двох молекул цистеїну дає цистин |
| тирозину | Тир (Y) | 2-аміно-3- (4-гідроксифеніл) -пропанова кислота | 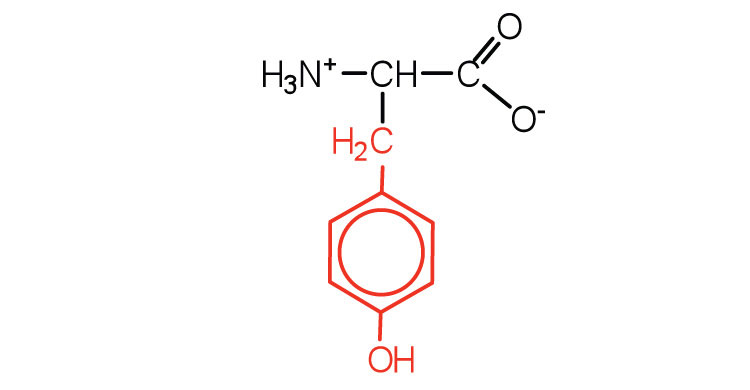 |
5.7 | також класифікується як ароматична амінокислота |
| аспарагін | Асн (Н) | 2-аміно-3-карбамоїлпропанова кислота | 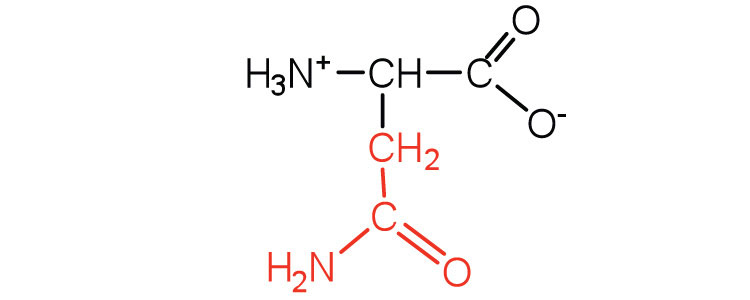 |
5.4 | амід аспарагінової кислоти |
| глютамін | Глен (Q) | 2-аміно-4-карбамойлбутанова кислота | 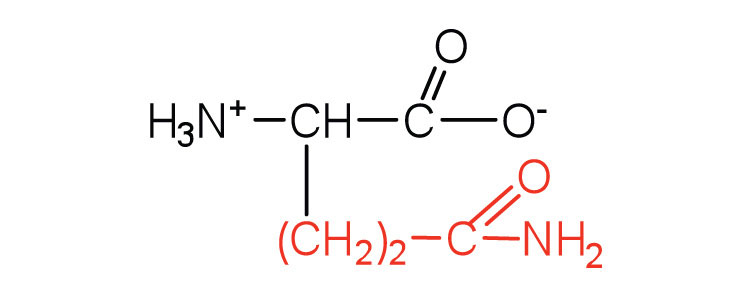 |
5.7 | амід глутамінової кислоти |
| Амінокислоти з негативно зарядженою групою R | |||||
| аспарагінова кислота | Жерех (D) | 2-амінобутандіова кислота | 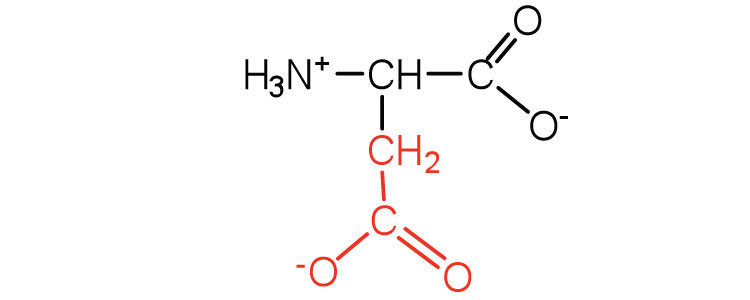 |
3.0 | карбоксильні групи іонізуються при фізіологічному рН; також відомий як аспартат |
| глутамінова кислота | Клей (E) | 2-амінопентандіова кислота | 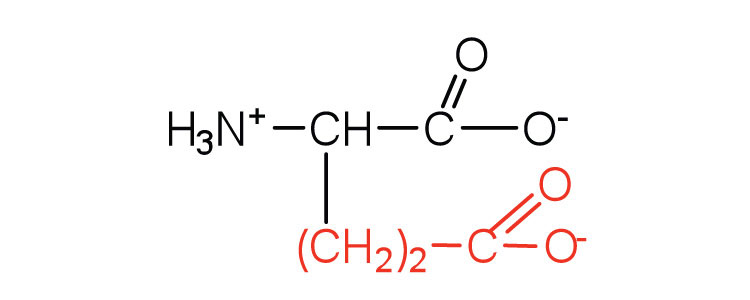 |
3.2 | карбоксильні групи іонізуються при фізіологічному рН; також відомий як глутамат |
| Амінокислоти з позитивно зарядженою групою R | |||||
| гістидин | Його (H) | 2-аміно-3- (1 Н -імідазол-4-іл) -пропанова кислота | 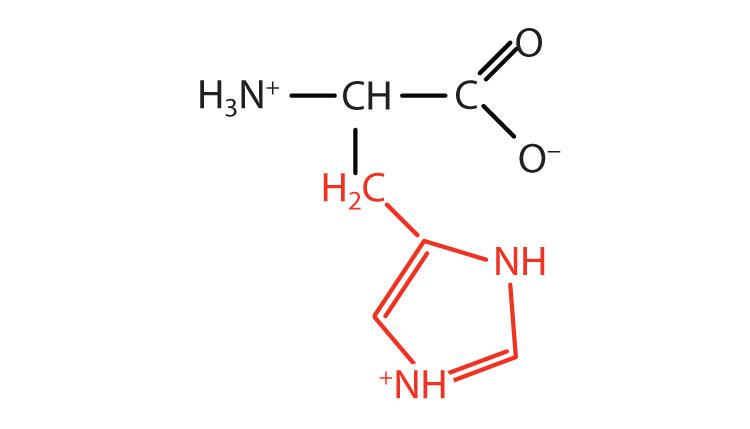 |
7.6 | єдина амінокислота, група R якої має pK a (6,0) поблизу фізіологічного рН |
| лізин | Ліс (K) | 2,6-діаміногексанова кислота | 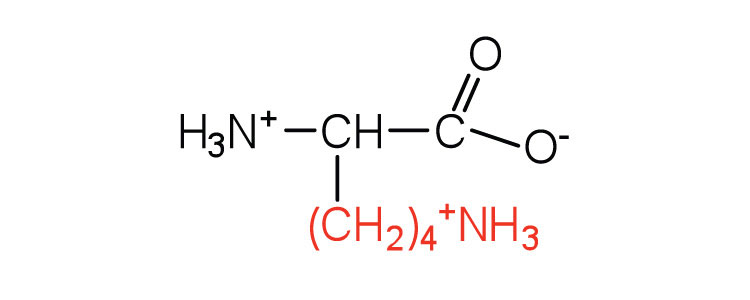 |
9.7 | є дещо амфіпатичним завдяки довгому вуглеводневому хвосту і позитивно зарядженої аміногрупи наϵ вуглеці |
| аргінін | Арг (R) | 2-аміно-5-гуанідінопентанова кислота | 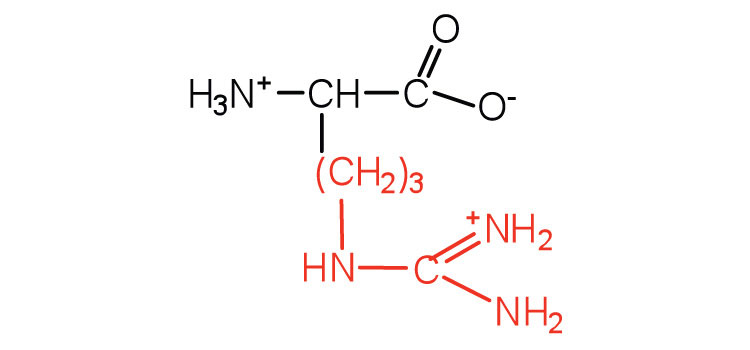 |
10.8 | майже така ж міцна основа, як гідроксид натрію |
Першою амінокислотою, яку потрібно було виділити, був аспарагін в 1806 році. Його отримували з білка, знайденого в спаржевому соку (звідси і назва). Гліцин, основна амінокислота, що міститься в желатині, був названий за його солодкий смак (грецьке glykys, що означає «солодкий»). Глютамінова кислота названа такою, оскільки вона була вперше виділена з глютену. Кристалічна сіль глутамінової кислоти називається глутамат натрію (глутамат натрію), який природним чином зустрічається в деяких продуктах, але також додається в якості пікантного або «умами» підсилювача смаку.
У деяких випадках амінокислота, що міститься в білку, насправді є похідним однієї із загальних 20 амінокислот (однією з таких похідних є гідроксипролін). Модифікація проліну відбувається після того, як амінокислота була зібрана в білок.
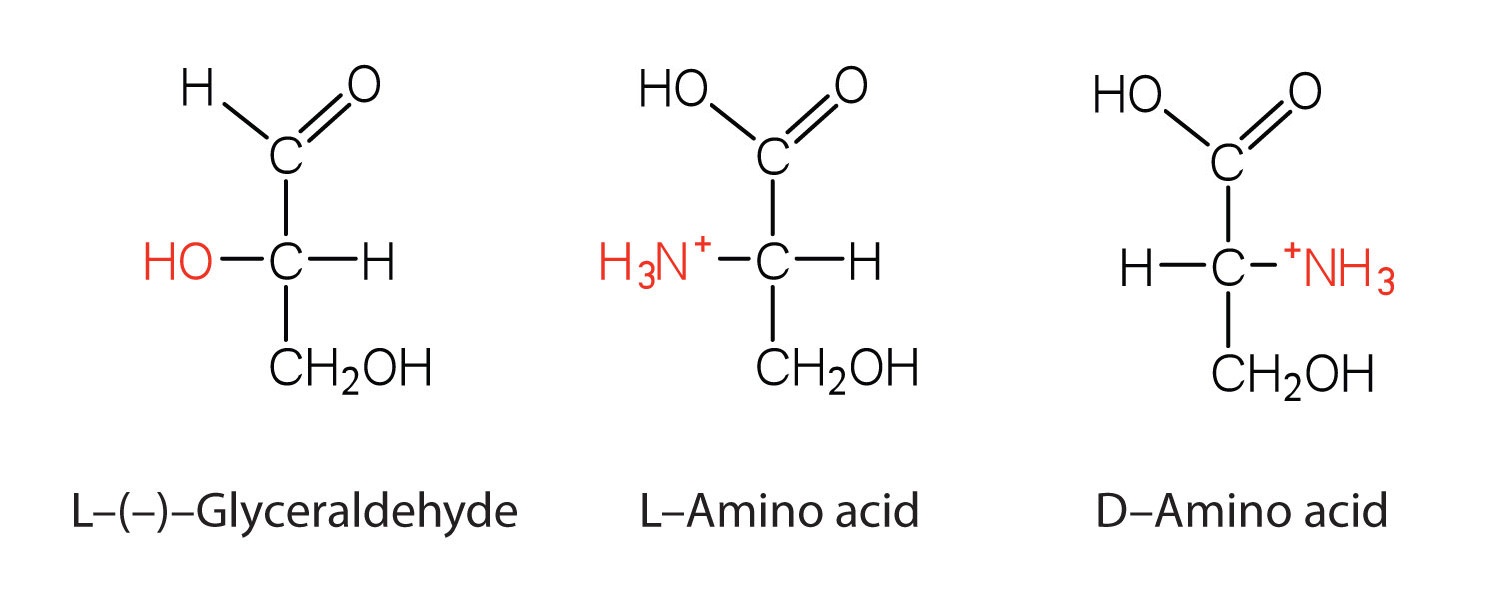
Хіральність амінокислот
Зверніть увагу в таблиці18.3.1, що гліцин є єдиною амінокислотою, чия (\ альфа\) -вуглець не є хіральним, іншими словами молекула і дзеркальне зображення гліцину ідентичні. Всі інші амінокислоти мають дві форми, які є дзеркальним відображенням один одного, вони є енантіомерами. Як видно на малюнку нижче, «лівша» форма молекули відома як L-амінокислота, а «правша» форма - D-амінокислота.
Резюме
Амінокислоти можна класифікувати на основі характеристик їх відмінних бічних ланцюгів як неполярні, полярні, але незаряджені, негативно заряджені або позитивно заряджені. Амінокислоти, що містяться в білках, - це L-амінокислоти.
