17.2: Кислотність карбонових кислот
- ВизначтеpKa і використовуйте його для визначення кислотності різних карбонових кислот.
- Опишіть реакції між карбоновими кислотами і сильними підставами.
Іонізація карбонових кислот
Карбонові кислоти називаються такими, оскільки вони, як правило, більш кислі, ніж інші функціональні групи в органічній хімії. У розведених водних розчинами вони діють як слабкі кислоти, які частково дисоціюють з утворенням відповідного аніону карбоксилату та катіону гідронію (H 3 O +). Карбоксилатні аніони названі шляхом заміни - ic кислоти, що закінчується від карбонової кислоти на - їли, див. Приклади нижче.
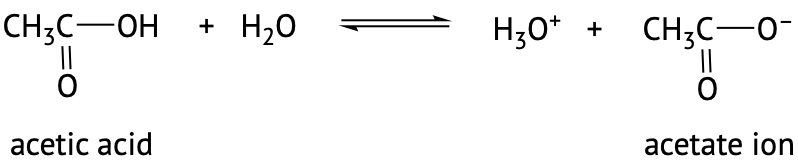
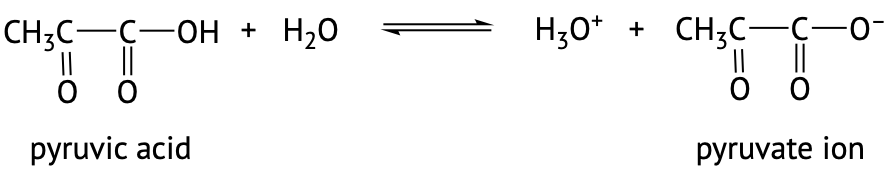
Ступінь дисоціації цих слабких кислот у воді описуєтьсяKa величинами. Пам'ятайте, що з'єднання з меншимKa значенням буде більш слабкою кислотою.
RCOOH+H2O⇌RCOO−+H3O+Ka=[RCOO−][H3O+][RCOOH]
При порівнянні кислотності органічних і біомолекул корисно (і краще) використовувати замістьpKa значень значення, які обчислюються шляхом взяття негативного журналуKa:pKa= –logKa.Ka При використанніpKa шкали важливо знати, що більш слабкі кислоти мають більші і більш позитивніpKa значення, це протилежноKa значенням. pKaЗначення деяких типових карбонових кислот наведені в табл17.2.1. (Пам'ятайте, щоpKa це вираз журналу, що означає, що кожнаpKa одиниця 1 представляє 10-кратну зміну кислотності.)
| Ім'я | З'єднання | Ka | pKa |
|---|---|---|---|
| мурашина кислота | ХОХОХ | \ (K_a\)» style="вирівнювання тексту: центр; "> 1.8 X 10 —4 | \ (pk_a\)» style="вирівнювання тексту: центр; "> 3.74 |
| оцтова кислота | СН 3 СООН | \ (K_a\)» style="вирівнювання тексту: центр; "> 1.8 X 10 —5 | \ (pk_a\)» style="вирівнювання тексту: центр; "> 4.74 |
| пропанова кислота | СН 3 СН 2 СООН | \ (K_a\)» style="вирівнювання тексту: центр; "> 1.3 X 10 —5 | \ (pk_a\)» style="вирівнювання тексту: центр; "> 4.89 |
| бутанової кислоти | СН 3 СН 2 СН 2 СООН | \ (K_a\)» style="вирівнювання тексту: центр; "> 1.5 X 10 —5 | \ (pk_a\)» style="вирівнювання тексту: центр; "> 4.82 |
| хлороцтова кислота | КЛЧ 2 СООН | \ (K_a\)» style="вирівнювання тексту: центр; "> 1.4 X 10 —3 | \ (pk_a\)» style="вирівнювання тексту: центр; "> 2.85 |
| трихлороцтова кислота | Cl 3 СООН | \ (K_a\)» style="вирівнювання тексту: центр; "> 2.3 X 10 —1 | \ (pk_a\)» style="вирівнювання тексту: центр; "> 0.64 |
| гексанова кислота | СН 3 (СН 2) 4 СООН | \ (K_a\)» style="вирівнювання тексту: центр; "> 1.3 X 10 —5 | \ (pk_a\)» style="вирівнювання тексту: центр; "> 4.89 |
| бензойна кислота | C 6 Ч 5 КУН | \ (K_a\)» style="вирівнювання тексту: центр; "> 6.5 X 10 —5 | \ (pk_a\)» style="вирівнювання тексту: центр; "> 4.19 |
| щавлева кислота | КАЛЬКУН | \ (K_a\)» style="вирівнювання тексту: центр; "> 5.4 X 10 —2 | \ (pk_a\)» style="вирівнювання тексту: центр; "> 1.27 |
| — ОККУН | \ (K_a\)» style="вирівнювання тексту: центр; "> 5.2 X 10 —5 | \ (pk_a\)» style="вирівнювання тексту: центр; "> 4.28 | |
| глутарової кислоти | ГАЧОК (СН 2) 3 КУН | \ (K_a\)» style="вирівнювання тексту: центр; "> 4.5 X 10 —5 | \ (pk_a\)» style="вирівнювання тексту: центр; "> 4.35 |
| — ООЦ (СН 2) 3 СООН | \ (K_a\)» style="вирівнювання тексту: центр; "> 3.8 X 10 —6 | \ (pk_a\)» style="вирівнювання тексту: центр; "> 5.42 |
Нейтралізація карбонових кислот
Карбонові кислоти будуть реагувати з основами, такими як гідроксид натрію (NaOH), карбонат натрію (Na 2 CO 3) та бікарбонат натрію (NaHCO 3), утворюючи воду та сіль карбонової кислоти:
РСОХ + Анох (aq) → РКО − Na + (aq) + Н 2 О
2РСООН + Na 2 СО 3 (ак) → 2РСОО − Na + (aq) + Н 2 О + СО 2 (г)
ROOH + NaHCO (aq) → RCOO − Na + (aq) + H 2 O + СО 2 (г)
У цих реакціях карбонові кислоти діють подібно неорганічним кислотам: вони нейтралізують основні сполуки. З розчинами іонів карбонату (CO2–3) і бікарбонату (HCO–3) вони також утворюють вуглекислий газ.
Солі карбонової кислоти називаються так само, як і неорганічні солі: за назвою катіона слідує назва органічного аніону. Назва аніона отримують шляхом скидання закінчення - ic назви кислоти і заміни його суфіксом - їли. Це правило застосовується незалежно від того, чи використовуємо ми загальні імена або назви Міжнародного союзу чистої та прикладної хімії (IUPAC):

Солі довголанцюгових карбонових кислот називаються милами.
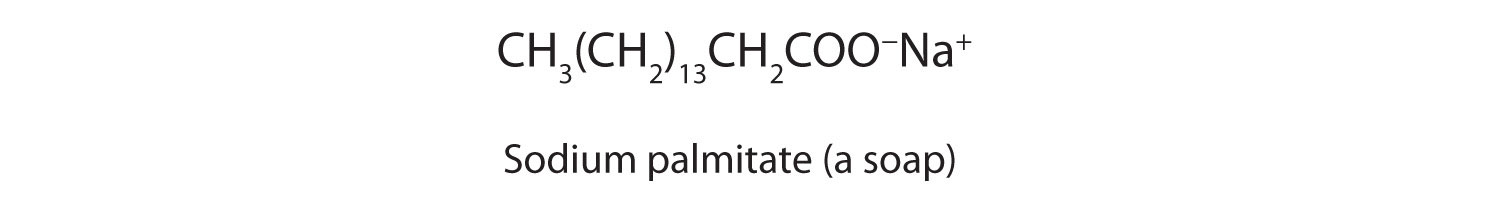
Напишіть рівняння для кожної реакції.
- іонізація пропіонової кислоти у воді (H 2 O)
- нейтралізація пропіонової кислоти водним гідроксидом натрію (NaOH)
Рішення
Пропіонова кислота має три атома вуглецю, тому її формула - СН 2 СН 2 СООН.
- Пропіонова кислота іонізується у воді з утворенням іона пропіонату та іона гідронію (H 3 O +). СН 3 СН 2 СООН (ак) + Н 2 О () → СН 3 СН 2 СОО − (aq) + Н 3 О + (aq)
- Пропіонова кислота реагує з NaOH (aq) з утворенням пропіонату натрію і води. СН 3 СН 2 СООН (ак) + NaOH (aq) → СН 3 СН 2 СОО − Na + (aq) + Н 2 О ()
Напишіть рівняння для кожної реакції.
- іонізація мурашиної кислоти у воді
- іонізація р -хлорбензойної кислоти у воді
Напишіть рівняння реакції деканової кислоти з кожним з'єднанням.
- водний гідроксид натрію (NaOH)
- водний бікарбонат натрію (NaHCO 3)
Рішення
- Деканова кислота має 10 атомів вуглецю. Він реагує з NaOH, утворюючи сіль і воду (H 2 O). СН 3 (СН 2) 8 СООН+NaOH (aq) → СН 3 (СН 2) 8 СОО − Na + (aq) + Н 2 О ()
- З NaHCO 3 продукти являють собою сіль, H 2 O і вуглекислий газ (СО 2). СН 3 (СН 2) 8 СООН + NaHCO 3 (aq) → СН 3 (СН 2) 8 СОО − Na + (aq) + Н 2 О () + СО 2 (г)
Напишіть рівняння реакції бензойної кислоти з кожним з'єднанням.
- водний гідроксид натрію (NaOH)
- водний бікарбонат натрію (NaHCO 3)
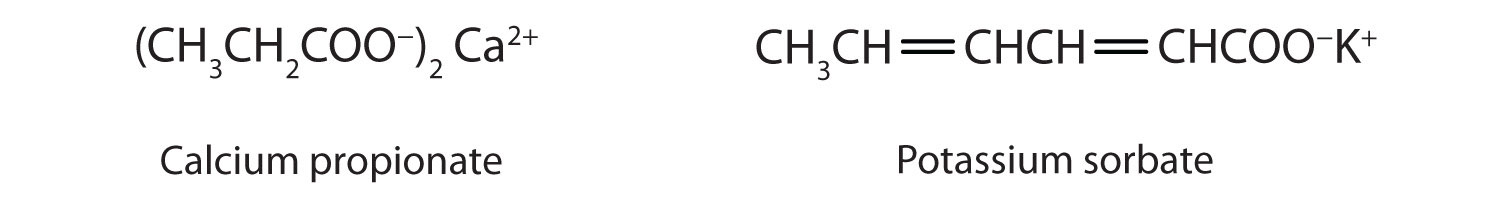
Деякі органічні солі використовуються як консерванти в харчових продуктах. Вони запобігають псування, пригнічуючи ріст бактерій і грибків. Наприклад, кальцій і пропіонат натрію додають в плавлений сир і хлібобулочні вироби; бензоат натрію додають в сидр, желе, соління та сиропи; а сорбат натрію і сорбат калію додають у фруктові соки, квашену капусту, безалкогольні напої та вино. Шукайте їх на етикетках інгредієнтів наступного разу, коли ви купуєте продукти.