7.3: Екзотермічні та ендотермічні реакції
- Page ID
- 21608
- Використовуйте енергії дисоціації зв'язків для обчислення зміни ентальпії або теплоти реакції.
- Визначте, чи є хімічний процес екзотермічним або ендотермічним.
Ендотермічні та екзотермічні реакції
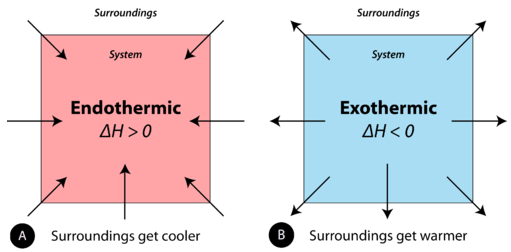
Ендотермічні та екзотермічні реакції можна розглядати як енергію як реагент реакції або продукт. Ендотермічні реакції вимагають енергії, тому енергія є реагентом. Тепло надходить від оточення до системи (реакційна суміш) і ентальпія системи\(\Delta H\) збільшується (позитивна). Як обговорювалося в попередньому розділі, тепло виділяється (вважається продуктом) в екзотермічній реакції, а ентальпія системи\(\Delta H\) зменшується (негативна).
В ході ендотермічного процесу система отримує тепло від навколишнього середовища, і тому температура навколишнього середовища знижується (стає холодною). Хімічна реакція є екзотермічною, якщо тепло виділяється системою в навколишнє середовище. Оскільки оточення набирає тепло від системи, температура оточення підвищується. Див\(\PageIndex{1}\). Малюнок.
Ендотермічна реакція: Коли\(1 \: \text{mol}\) карбонат кальцію розкладається на\(1 \: \text{mol}\) оксид кальцію та\(1 \: \text{mol}\) вуглекислий газ, тепло\(177.8 \: \text{kJ}\) поглинається. Оскільки тепло поглинається системою,\(177.8 \: \text{kJ}\) записується як реагент. \(\Delta H\)Позитивний для ендотермічної реакції.

\[\ce{CaCO_3} \left( s \right) \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right) \: \: \: \: \: \Delta H = +177.8 \: \text{kJ}\]
Екзотермічна реакція: При згорянні газу метану виділяється тепло, що робить реакцію екзотермічною. Зокрема, при\(1 \: \text{mol}\) згорянні метану виділяється 890,4 кілоджоуля теплової енергії. Цю інформацію можна показати як частину збалансованого рівняння двома способами. По-перше, кількість виділеного тепла може бути записано в стороні продукту реакції. Інший спосіб - написати\(\Delta H\) інформацію з негативним знаком,\(-890.4 \: \text{kJ}\).
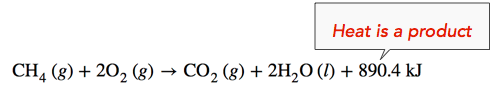
\[\ce{CH_4} \left( g \right) + 2 \ce{O_2} \left( g \right) \rightarrow \ce{CO_2} \left( g \right) + 2 \ce{H_2O} \left( l \right) \: \: \: \: \: \Delta H = -890.4 \: \text{kJ}\]
Кожна хімічна реакція екзотермічна або ендотермічна?
- СН 4 (г) + 2О 2 (г) → СО 2 (г) + 2Н 2 О () + 213 ккал
- N 2 (г) + O 2 (г) + 45 ккал → 2NO (г)
Рішення
- Оскільки енергія (213 ккал) є продуктом, енергія віддається реакцією. Тому дана реакція носить екзотермічний характер.
- Оскільки енергія (45 ккал) є реагентом, енергія засвоюється реакцією. Тому дана реакція ендотермічна.
Кожна хімічна реакція екзотермічна або ендотермічна?
- Н 2 (г) + F 2 (г) → 2HF (г) + 130 ккал
- 2С (и) + Н 2 (г) + 5,3 ккал → С 2 Н 2 (г)
- Відповідь
-
а. енергія (130 ккал) виробляється, отже реакція екзотермічна
б. енергія (5,3 ккал) подається або поглинається для реагування, отже, реакція ендотермічна
Енергетичні діаграми
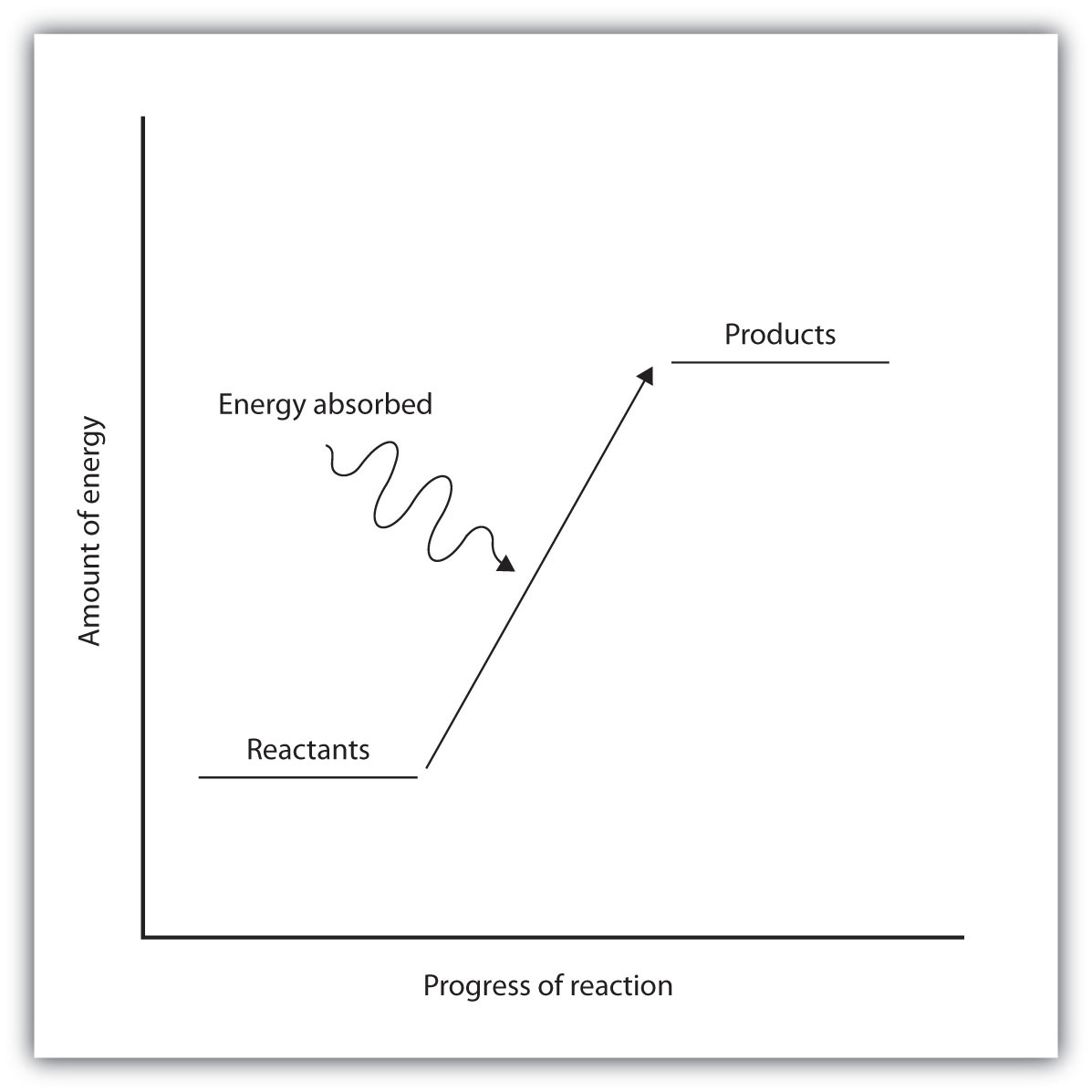
Ендотермічні та екзотермічні реакції можуть бути наочно представлені діаграмами енергетичного рівня, подібними до тих, що наведені на рис\(\PageIndex{2}\). В ендотермічних реакціях реагенти мають більш високу енергію зв'язку (більш міцні зв'язки), ніж продукти. Міцні зв'язки мають меншу потенційну енергію, ніж слабкі зв'язки. Значить, енергія реагентів нижче, ніж у продуктів. Цей тип реакції представлений діаграмою енергетичного рівня «в гору», показаної на малюнку\(\PageIndex{2A}\). Щоб ендотермічна хімічна реакція тривала, реагенти повинні поглинати енергію з навколишнього середовища для перетворення в продукти.
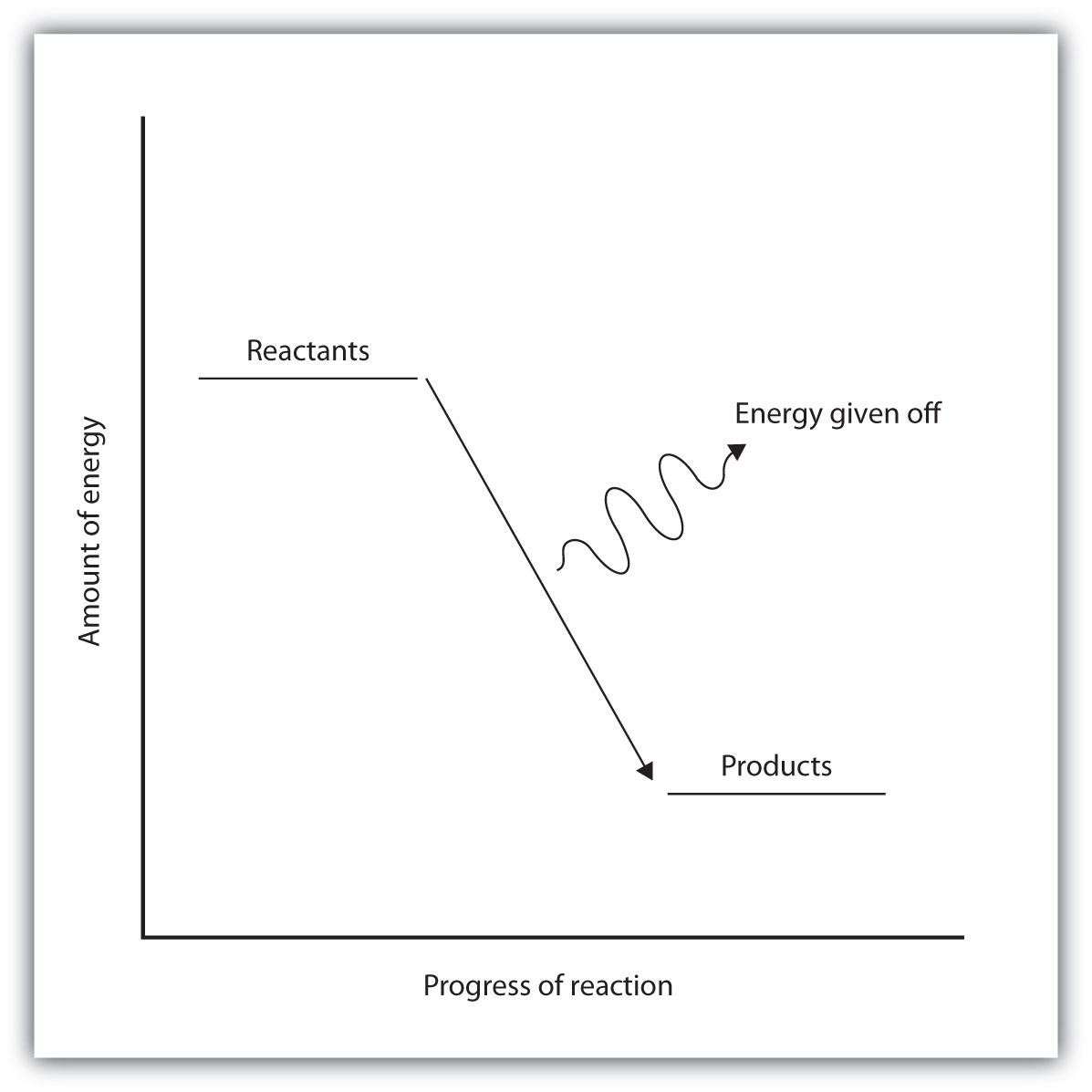
При екзотермічній реакції зв'язки в продукті мають більш високу енергію зв'язку (більш міцні зв'язки), ніж реагенти. Іншими словами, енергія продуктів нижче, ніж енергія реагентів, отже, енергетично скорочується, показана на малюнку\(\PageIndex{2B}\). Енергія віддається, коли реагенти перетворюються на продукти. Енергія, що виділяється, зазвичай у вигляді тепла (хоча кілька реакцій виділяють енергію як світло). В ході екзотермічної реакції тепло надходить від системи до її оточення, і, таким чином, нагрівається.
| Ендотермічні реакції | Екзотермічні реакції |
|---|---|
| Тепло поглинається реагентами з утворенням продуктів. | Тепло виділяється. |
| Тепло поглинається з оточення, в результаті оточення стає холодним. | Тепло виділяється реакцією на оточення; оточення відчувають себе жарко. |
| \(\Delta H_{rxn}\)позитивний | \(\Delta H_{rxn}\)негативний |
| Зв'язки, розірвані в реагентах, міцніші, ніж зв'язки, що утворюються в продуктах. | Утворені в продуктах зв'язки міцніші, ніж зв'язки, розірвані в реагентах. |
| Реагенти мають меншу енергію, ніж продукти. | Продукти мають меншу енергію, ніж у реагентів. |
| Представлений енергетичною діаграмою «в гору». | Представлений діаграмою енергії «під гору» |
Концепція Огляд Вправи
- Який зв'язок між енергетичними та хімічними зв'язками?
- Чому енергія змінюється в ході хімічної реакції?
- Дві різні реакції виконуються в двох однакових пробірках. При реакції А пробірка стає дуже теплою в міру протікання реакції. При реакції В пробірка стає холодною. Яка реакція ендотермічна, а яка екзотермічна? Поясніть.
- Класифікують «палаючий папір» як ендотермічні або екзотермічні процеси.
Відповіді
- Хімічні зв'язки мають певну енергію, яка залежить від елементів в зв'язку і кількості зв'язків між атомами.
- Енергія змінюється, оскільки зв'язки переставляються, щоб зробити нові зв'язки з різними енергіями.
- Реакція А є екзотермічною, оскільки тепло виходить з системи, змушуючи пробірку відчувати себе гарячою. Реакція B є ендотермічною, оскільки тепло поглинається системою, змушуючи пробірку відчувати себе холодною.
- «Палаючий папір» є екзотермічним, оскільки горіння (також відоме як згоряння) виділяє тепло
Ключові виноси
- Атоми утримуються разом за допомогою певної кількості енергії, яка називається енергією зв'язку.
- Енергія потрібна для розриву зв'язків. Енергія виділяється, коли утворюються хімічні зв'язки, тому що атоми стають більш стабільними.
- Хімічні процеси позначаються як екзотермічні або ендотермічні залежно від того, виділяють вони або поглинають енергію відповідно.